De borst bestaat uit vet en stroma dat glandulair weefsel ondersteunt, een vertakkend, ductaal systeem met 6-10 hoofdkanalen die in open verbinding staan met de tepel. Zowel goedaardige als kwaadaardige laesies ontwikkelen zich in de borst. Bij jonge vrouwen zijn fibroadenomen veel voorkomende laesies, en bij oudere vrouwen komen fibrocystische veranderingen vaker voor. Andere benigne laesies zijn onder andere vetnecrose en inflammatoire aandoeningen zoals borstabces en mastitis. Minder gebruikelijke laesies, zoals hamartomen en pseudo-angiomateuze hyperplasie, komen soms voor. Ductale hyperplasie vormt een onderdeel van fibrocystische veranderingen. Atypische hyperplasie kan moeilijk te onderscheiden zijn van laaggradig ductaal carcinoom in situ en deze laesies vertegenwoordigen een spectrum van ziektes die zich kunnen ontwikkelen tot een borstcarcinoom. Bestralingswijzigingen kunnen een massa produceren die bij aspiratiecytologie atypisch kan lijken. Eveneens kunnen zwangerschap en lactatiewijzigingen ook worden verward met mailigniteit op aspiraten, omdat de klinische informatie essentieel is voor een nauwkeurige, cytologische diagnose.
Maligniteiten in de borst kunnen primair of metastatisch zijn. Metastasen in de borst zijn onder andere lymfoom, maligne melanoom en andere secundaire tumoren, zoals renale, bronchiale, ovariële of pulmonale carcinomen. Het meest significant vanuit diagnostisch oogpunt, is primair borstcarcinoom, ductaal type, niet anders gespecificeerd (NOS). Het op een na meest voorkomende primaire borstneoplasma is lobulair carcinoom. Ductaal carcinoom in situ en lobulair carcinoom in situ zijn eenvoudig vast te stellen op excisie-biopsieën, maar zijn moeilijker betrouwbaar te diagnosticeren via cytologie.
Borstcytologie spelt een rol bij zowel screening als diagnostische doeleinden. Van elke willekeurige laesie die aan het licht komt door mammografische screening, kan een monster worden afgenomen met een fijne naald, via directe aspiratie indien palpabel, of via stereotactische of ultrasound geleiding indien niet-palpabel. Als het cytologiemonster onvoldoende of twijfelachtig is, kan een kernbiopsie of vriescoupe gebruikt worden. Palpabele borstmassa’s zijn eenvoudig te aspireren en kunnen snel verwerkt worden voor een snelle diagnose.
Fijne-naald aspiratiecytologie is een nuttig hulpmiddel voor het stellen van de diagnose van borstlaesies, zowel palpabel als niet-palpabel. Het is veilig, snel, goedkoop (in vergelijking met kernbiopsieën), en het is een relatief pijnloze procedure en kan zowel door klinisch specialisten als door pathologen worden uitgevoerd. Bij uitvoering door cytopathologen is het ongeschiktheidspercentage laag, omdat er snel kleuringen kunnen worden uitgevoerd om de monsters te beoordelen. De procedure kan zonodig snel worden herhaald. De cyto-histologische correlatie is uitstekend als deze wordt uitgevoerd door ervaren cytopathologen. Een klein nadeel van fijne-naald aspiraten is dat het niet altijd mogelijk is om onderscheid te maken tussen invasieve en in situ laesies; dergelijke problemen komen soms ook voor bij kernbiopsieën.
Het geaspireerde materiaal wordt als uitstrijkje op een objectglaasje aangebracht of wordt in een Cytolytoplossing® gespoten. De naald wordt met dezelfde oplossing afgespoeld voor iedere gemaakte doorgang. Met behulp van de vloeistof kunnen meerdere bijna identieke objectglaasjes worden gemaakt, zodat het lab materiaal kan bewaren voor speciale kleuringen zoals oestrogeen- en progesteronreceptoren en HER2/neu proteïne-overexpressie.
Er zijn ook speciale soorten ductaal carcinoom zoals tubulair, colloïde (mucineus), metaplastisch, medullair, apocriene en squameus. De definitie van veel van deze speciale soorten van borsttumoren is gebaseerd op bewijs dat meer dan 90% van de laesies de typische kenmerken van die soort vertoont. Omdat bij cytologie alleen monsters van een deel van de tumor worden verzameld, is het onjuist om deze tumoren cytologisch als tubulair of mucineus te categoriseren. De verdenking kan worden vermeld in de uitslag door er een beschrijving aan toe te voegen zoals “ductaal carcinoom, met mucineuze of tubulaire kenmerken” en verder geen exact type, dat wellicht kan verschillen met het excisiemonster. Tubulaire carcinomen bestaan uit tabulaire en acinaire structuren. Aspiraten van mucineus carcinoom zijn vaak grof slijmachtig en vertonen overvloedig mucine op het uitstrijkje. Sommige zeldzaamheden, zoals adenoïde cystisch carcinoom, zoals die wordt wordt waargenomen bij de speekselklier, kunnen ook tot ontwikkeling komen. Deze tumor bootst goedaardige collageensferulose na, aangezien deze ook extracellulair hyaline materiaal bevat, met dezelfde kleuringseigenschappen, maar in de vorm van zowel globulea als tabulaire of cilindrische structuren. De vergezellende tumorcellen zijn klein en ongedetailleerd, met weinig cytoplasma, maar goedaardige ductale, apocriene en metaplastische cellen worden niet aangetroffen.
Herinnering: U kunt op elke willekeurige afbeelding
in de Atlas klikken voor een vergroot beeld.
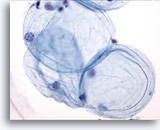
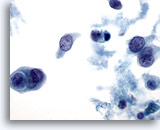
Afbeelding 1
Borst FNA, Vet.
Vetcellen of adipocyten zijn grote, sferische cellen met doorschijnend cytoplasma en kleine, excentrische nuclei. Deze worden zowel in benigne als maligne aspiraten waargenomen.
40x
Afbeelding 1
Borst FNA, Vet.
Vetcellen of adipocyten zijn grote, sferische cellen met doorschijnend cytoplasma en kleine, excentrische nuclei. Deze worden zowel in benigne als maligne aspiraten waargenomen.
40x
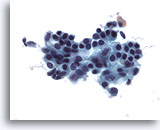
Afbeelding 2
Borst FNA – Goedaardige ductale cellen.
Nomale aspiraten van de borst leveren goedaardige ductale cellen, vaak vergezeld van myoepitheelcellen.
40x
Afbeelding 2
Borst FNA – Goedaardige ductale cellen.
Nomale aspiraten van de borst leveren goedaardige ductale cellen, vaak vergezeld van myoepitheelcellen.
40x
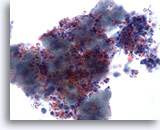
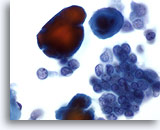
Afbeelding 3
Borst FNA, Abces.
Fijne-naald aspiraten van borstabcessen laten gewoonlijk geen epitheelcellen zien. Cellulair materiaal, gelyseerde rode cellen en neutrofielen zijn voorkomende kenmerken.
40x
Afbeelding 3
Borst FNA, Abces.
Fijne-naald aspiraten van borstabcessen laten gewoonlijk geen epitheelcellen zien. Cellulair materiaal, gelyseerde rode cellen en neutrofielen zijn voorkomende kenmerken.
40x
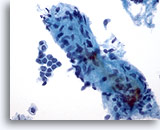
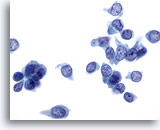
Afbeelding 4:
Borst FNA, Fibroadenoom.
Er is een groot, stromaal fragment aanwezig, dat een paar kleine spoelvormige kernen bevat. Stromale fragmenten kunnen worden waargenomen in aspiraten van zowel goedaardig boorstweefsel als in fibroepithele laesies, zoals fibroadenoom. Stromale fragmenten van fyllodium tumoren zijn veel meer cellulair. Let op de kleine groep goedaardige ductale cellen die ook aanwezig is.
40x
Afbeelding 4
Borst FNA, Fibroadenoom.
Er is een groot, stromaal fragment aanwezig, dat een paar kleine spoelvormige kernen bevat. Stromale fragmenten kunnen worden waargenomen in aspiraten van zowel goedaardig boorstweefsel als in fibroepithele laesies, zoals fibroadenoom. Stromale fragmenten van fyllodium tumoren zijn veel meer cellulair. Let op de kleine groep goedaardige ductale cellen die ook aanwezig is.
40x
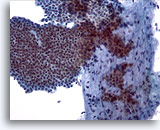
Afbeelding 5
Borst FNA, Fibroadenoom.
Een grote vertakkingslaag van cohesieve, uniforme goedaardige ductale cellen is te zien bovenop een stromaal fragment. Let op de kleine, ietwat uitgelopen stromale celkern in het stromale fragment.
20x
Afbeelding 5
Borst FNA, Fibroadenoom.
Een grote vertakkingslaag van cohesieve, uniforme goedaardige ductale cellen is te zien bovenop een stromaal fragment. Let op de kleine, ietwat uitgelopen stromale celkern in het stromale fragment.
20x
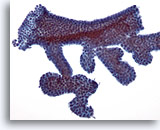
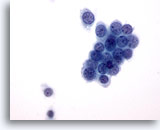
Afbeelding 6
Borst FNA, Fibroadenoom.
Typisch voor aspiraten van fibroadenoom is dat ze grote vertakkingslagen bevatten met goedaardige ductale cellen, zoals te zien is op de afbeelding.
20x
Afbeelding 6
Borst FNA, Fibroadenoom.
Typisch voor aspiraten van fibroadenoom is dat ze grote vertakkingslagen bevatten met goedaardige ductale cellen, zoals te zien is op de afbeelding.
20x
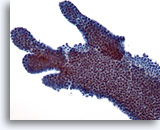
Afbeelding 7
Borst FNA, Fibroadenoom.
Dit is een ander voorbeeld van het vertakkingsuiterlijk van ductale cellen in fibroadenoom.
20x
Afbeelding 7
Borst FNA, Fibroadenoom.
Dit is een ander voorbeeld van het vertakkingsuiterlijk van ductale cellen in fibroadenoom.
20x
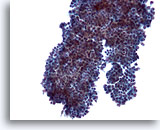
Afbeelding 8
Borst FNA, Fibroadenoom.
In sommige gevallen hebben de ductale groepen eerder kleine ronde projecties, zoals hier te zien is, dan de lange vertakkingen die we in de twee eerdere afbeeldingen zagen.
20x
Afbeelding 8
Borst FNA, Fibroadenoom.
In sommige gevallen hebben de ductale groepen eerder kleine ronde projecties, zoals hier te zien is, dan de lange vertakkingen die we in de twee eerdere afbeeldingen zagen.
20x
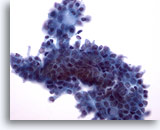
Afbeelding 9:
Borst FNA, Fibroadenoom.
In dit veld zijn de randen van de ductale groep niet zo glad als bij de twee afbeeldingen hierboven, waarschijnlijk door de vloeistofverwerking. Binnen de groep ductale cellen, en op de bovenste rand, zijn een aantal myoepitheelcellen zichtbaar. Door de ThinPrep verwerking, worden myoepitheelcellen vaker gezien naast de ductale groepen dan verspreid op de achtergrond, zoals vaak te zien is op conventionele uitstrijkjes.
40x
Afbeelding 9
Borst FNA, Fibroadenoom.
In dit veld zijn de randen van de ductale groep niet zo glad als bij de twee afbeeldingen hierboven, waarschijnlijk door de vloeistofverwerking. Binnen de groep ductale cellen, en op de bovenste rand, zijn een aantal myoepitheelcellen zichtbaar. Door de ThinPrep verwerking, worden myoepitheelcellen vaker gezien naast de ductale groepen dan verspreid op de achtergrond, zoals vaak te zien is op conventionele uitstrijkjes.
40x
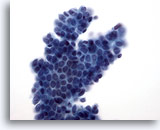
Afbeelding 10
Borst FNA, Fibroadenoom.
Een laag met vertakkingen van goedaardige ductale cellen met overliggende myoepitheelcellen, produceert het typerende ‘sesamzaadje op een bolletje’-uiterlijk.
40x
Afbeelding 10
Borst FNA, Fibroadenoom.
Een laag met vertakkingen van goedaardige ductale cellen met overliggende myoepitheelcellen, produceert het typerende ‘sesamzaadje op een bolletje’-uiterlijk.
40x
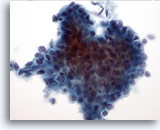
Afbeelding 11:
Borst FNA, Laaggradige fyllodium tumor.
Fyllodium tumoren zijn fibroepitheliale laesies, net als fibroadenomen. Maar zelfs de laaggradige laesies hebben het vermogen om terug te keren indien niet goed weggesneden met een ruime marge. De glandulaire component is gelijk aan die we zien in het fibroadenoom, hoewel het een meer cellulair en hyperplastisch uiterlijk kan hebben. Deze afbeelding toont een driedimensionale groep ductale cellen, die nucleaire overlap en opeenstapeling vertonen, suggestief voor hyperplastische veranderingen.
40x
Afbeelding 11
Borst FNA, Laaggradige fyllodium tumor.
Fyllodium tumoren zijn fibroepitheliale laesies, net als fibroadenomen. Maar zelfs de laaggradige laesies hebben het vermogen om terug te keren indien niet goed weggesneden met een ruime marge. De glandulaire component is gelijk aan die we zien in het fibroadenoom, hoewel het een meer cellulair en hyperplastisch uiterlijk kan hebben. Deze afbeelding toont een driedimensionale groep ductale cellen, die nucleaire overlap en opeenstapeling vertonen, suggestief voor hyperplastische veranderingen.
40x
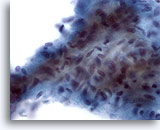
Afbeelding 12
Borst FNA, Laaggradige fyllodium tumor.
Dit stromale fragment is hypercellulair en bevat opeengepakte stevige spoelcellen. Veel losse stromale spoelcellen kunnen ook worden waargenomen op de achtergrond van deze laesie.
60x
Afbeelding 12
Borst FNA, Laaggradige fyllodium tumor.
Dit stromale fragment is hypercellulair en bevat opeengepakte stevige spoelcellen. Veel losse stromale spoelcellen kunnen ook worden waargenomen op de achtergrond van deze laesie.
60x
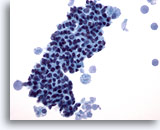
Afbeelding 13
Borst FNA, Fybrocystische veranderingen.
Dit veld toont een strak cluster goedaardige ductale cellen, met schuimachtige macrofagen aan beide uiteinden, met secretoir materiaal op de achtergrond.
40x
Afbeelding 13
Borst FNA, Fybrocystische veranderingen.
Dit veld toont een strak cluster goedaardige ductale cellen, met schuimachtige macrofagen aan beide uiteinden, met secretoir materiaal op de achtergrond.
40x
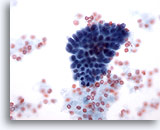
Afbeelding 14
Borst FNA, Fybrocystische veranderingen.
Deze kleine groep goedaardige ductale cellen is afkomstig van een aspiraat met fibrocystische veranderingen.
40x
Afbeelding 14
Borst FNA, Fybrocystische veranderingen.
Deze kleine groep goedaardige ductale cellen is afkomstig van een aspiraat met fibrocystische veranderingen.
40x
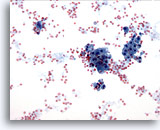
Afbeelding 15
Borst FNA, Fybrocystische veranderingen.
Achterggrond secretie, bloed en apocriene, metaplastische cellen zijn te zien in fibrocystische veranderingen.
20x
Afbeelding 15
Borst FNA, Fybrocystische veranderingen.
Achterggrond secretie, bloed en apocriene, metaplastische cellen zijn te zien in fibrocystische veranderingen.
20x
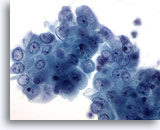
Afbeelding 16
Borst FNA, Borstcyste.
Dit cluster van goedaardige ductale cellen vertonen atypie in de vorm van zichtbare nucleoli en lichte kernvergroting. Dergelijke minimale veranderingen worden vaak aangetroffen in vocht van borstcyste.
60x
Afbeelding 16
Borst FNA, Borstcyste.
Dit cluster van goedaardige ductale cellen vertonen atypie in de vorm van zichtbare nucleoli en lichte kernvergroting. Dergelijke minimale veranderingen worden vaak aangetroffen in vocht van borstcyste.
60x
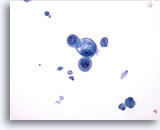
Afbeelding 17
Borst FNA, Borstcyste.
Dit veld vertoont een kleine groep goedaardige epitheelcellen, een ervan gevavuoliseerd, met cystenmateriaal op de achtergrond.
40x
Afbeelding 17
Borst FNA, Borstcyste.
Dit veld vertoont een kleine groep goedaardige epitheelcellen, een ervan gevavuoliseerd, met cystenmateriaal op de achtergrond.
40x
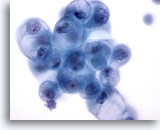
Afbeelding 18
Borst FNA, Borstcyste.
Goedaardige ductale cellen in cystenvocht kan degeneratieve vacuolisatie vertonen, zoals hier afgebeeld. Deze veranderingen moeten niet worden geïnterpreteerd als diagnostisch voor carcinoom.
60x
Afbeelding 18
Borst FNA, Borstcyste.
Goedaardige ductale cellen in cystenvocht kan degeneratieve vacuolisatie vertonen, zoals hier afgebeeld. Deze veranderingen moeten niet worden geïnterpreteerd als diagnostisch voor carcinoom.
60x
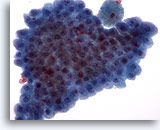
Afbeelding 19
Borst FNA, Apocriene metaplasie.
Goedaardige apocriene cellen worden vaak aangetroffen in vlakke lagen. Ze worden vaak gezien in vocht van borstcysten en in fijna-naald aspiraties uit gebieden met fibrocystische verandering.
40x
Afbeelding 19
Borst FNA, Apocriene metaplasie.
Goedaardige apocriene cellen worden vaak aangetroffen in vlakke lagen. Ze worden vaak gezien in vocht van borstcysten en in fijna-naald aspiraties uit gebieden met fibrocystische verandering.
40x
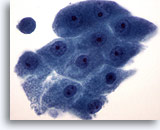
Afbeelding 20
Borst FNA, Apocriene metaplasie.
Apocriene cellen vertonen overvloedig granulair cytoplasma en ronde kernen met prominente nucleoli. Hun cytoplasmische grenzen zijn gewoonlijk duidelijk afgebakend.
60x
Afbeelding 20
Borst FNA, Apocriene metaplasie.
Apocriene cellen vertonen overvloedig granulair cytoplasma en ronde kernen met prominente nucleoli. Hun cytoplasmische grenzen zijn gewoonlijk duidelijk afgebakend.
60x
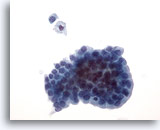
Afbeelding 21:
Borst FNA, Cystisch papillaire laesie.
Aspiraties van cystisch papillaire laesies bevatten zowel epitheelcellen als schuimachtige macrofagen. De goedaardige ductale cellen in deze groep zijn uniform van grootte en vorm en vertonen staketsel langs een rand. Let op de schuimachtige macrofaag en losse goedaardige cel boven de groep. Als er milde cellulaire atypie aanwezig is, kan het moeilijk zijn om een goedaardige laesie van een maligne papillaire laesie te onderscheiden.
40x
Afbeelding 21
Borst FNA, Cystisch papillaire laesie.
Aspiraties van cystisch papillaire laesies bevatten zowel epitheelcellen als schuimachtige macrofagen. De goedaardige ductale cellen in deze groep zijn uniform van grootte en vorm en vertonen staketsel langs een rand. Let op de schuimachtige macrofaag en losse goedaardige cel boven de groep. Als er milde cellulaire atypie aanwezig is, kan het moeilijk zijn om een goedaardige laesie van een maligne papillaire laesie te onderscheiden.
40x
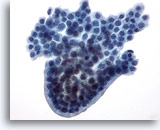
Afbeelding 22
Borst FNA, Cystisch papillaire laesie.
r>
Deze groep van goedaardige ductale cellen heeft een ronde staketselvormige rand, lijkend op een papillaire structuur, hoewel geen fibrovasculaire kern te zien is.
40x
Afbeelding 22
Borst FNA, Cystisch papillaire laesie.
Deze groep van goedaardige ductale cellen heeft een ronde staketselvormige rand, lijkend op een papillaire structuur, hoewel geen fibrovasculaire kern te zien is.
40x
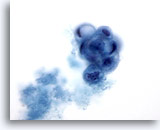
Afbeelding 23:
Borst FNA, Cystisch papillaire laesie.
In dit veld is een rond papillair cluster van degenererende, gevacuoliseerde ductale cellen te zien, vergezeld van secretiemateriaal. Dit uiterlijk kan het best worden gerapporteerd als atypisch, omdat het niet altijd mogelijk is om onderscheid te maken tussen goedaardige en maligne papillaire laesies. De aanwezigheid van apocriene metaplastische cellen is vaak een aanwijzing voor een goedaardig proces.
60x
Afbeelding 23
Borst FNA, Cystisch papillaire laesie.
In dit veld is een rond papillair cluster van degenererende, gevacuoliseerde ductale cellen te zien, vergezeld van secretiemateriaal. Dit uiterlijk kan het best worden gerapporteerd als atypisch, omdat het niet altijd mogelijk is om onderscheid te maken tussen goedaardige en maligne papillaire laesies. De aanwezigheid van apocriene metaplastische cellen is vaak een aanwijzing voor een goedaardig proces.
60x
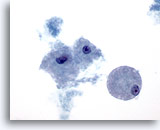
Afbeelding 24
Borst FNA, Cystisch papillaire laesie.
Schuimachtige macrofagen, zoals hier weergegeven, worden aangetroffen in zowel kwaadaardige als maligne cystische laesies, of ze nou papillair zijn of niet.
60x
Afbeelding 24
Borst FNA, Cystisch papillaire laesie.
Schuimachtige macrofagen, zoals hier weergegeven, worden aangetroffen in zowel kwaadaardige als maligne cystische laesies, of ze nou papillair zijn of niet.
60x
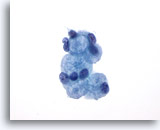
Afbeelding 25:
Borst FNA, Collageen sferulose.
Dit is een goedaardige laesie, die normaal gesproken incidenteel gevonden wordt in een biopsie van de borst. Het vormt zelden een palpabele massa. De aspiratie bevat sporen van goedaardige ductale hyperplasie, goedaardige ductale en apocriene metaplastische cellen, myoepitheelcellen, en globulen van extracellulair materiaal, omringd door kleine goedaardige epitheelcellen. Een gelijk beeld is te zien in aspiraties van adenoïde cystisch carcinoom van de borst.
60x
Afbeelding 25
Borst FNA, Collageen sferulose.
Dit is een goedaardige laesie, die normaal gesproken incidenteel gevonden wordt in een biopsie van de borst. Het vormt zelden een palpabele massa. De aspiratie bevat sporen van goedaardige ductale hyperplasie, goedaardige ductale en apocriene metaplastische cellen, myoepitheelcellen, en globulen van extracellulair materiaal, omringd door kleine goedaardige epitheelcellen. Een gelijk beeld is te zien in aspiraties van adenoïde cystisch carcinoom van de borst.
60x
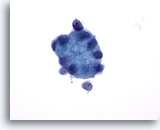
Afbeelding 26
Borst FNA, Collageen sferulose.
Deze grote globule van hyaline materiaal wordt omringd door kleine epitheelcellen.
60x
Afbeelding 26
Borst FNA, Collageen sferulose.
Deze grote globule van hyaline materiaal wordt omringd door kleine epitheelcellen.
60x
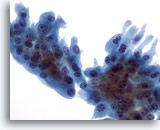
Afbeelding 27
Borst FNA, Collageensferulose/apocriene metaplasie.
Een laag van apocriene metaplastische cellen met relatief overvloedig cytoplasma was aanwezig in de aspiratie van de casus die hierboven afgebeeld is, en die collageensferulose laat zien.
40x
Afbeelding 27
Borst FNA, Collageensferulose/apocriene metaplasie.
Een laag van apocriene metaplastische cellen met relatief overvloedig cytoplasma was aanwezig in de aspiratie van de casus die hierboven afgebeeld is, en die collageensferulose laat zien.
40x
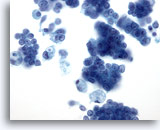
Afbeelding 28:
Borst FNA, Ductaal carcinoom in situ.
Dit is een cellulaire aspiratie die clusters van tumorcellen, losse maligne cellen en schuimachtige macrofagen vertoont. Ductaal carcinoom in situ (DCIS) vertoont vaak myoepitheelcellen bovenop de maligne celclusters. Tumorcellen hebben eerder de neiging te clusteren dan los voor te komen in een invasieve tumor. Bovendien worden tubulaire structuren niet in verband gebracht met DCIS. Comedo DCIS wordt kenmerkend in verband gebracht met necrose en calcium.
40x
Afbeelding 28
Borst FNA, Ductaal carcinoom in situ.
Dit is een cellulaire aspiratie die clusters van tumorcellen, losse maligne cellen en schuimachtige macrofagen vertoont. Ductaal carcinoom in situ (DCIS) vertoont vaak myoepitheelcellen bovenop de maligne celclusters. Tumorcellen hebben eerder de neiging te clusteren dan los voor te komen in een invasieve tumor. Bovendien worden tubulaire structuren niet in verband gebracht met DCIS. Comedo DCIS wordt kenmerkend in verband gebracht met necrose en calcium.
40x
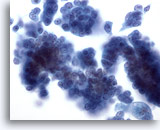
Afbeelding 29
Borst FNA, Ductaal carcinoom in situ.
Er zijn clusters van nogal ongedetailleerde tumorcellen te zien. Een vage impressie van een fibrovasculaire kern is te zien in de celgroep aan de rechterkant.
40x
Afbeelding 29
Borst FNA, Ductaal carcinoom in situ.
Er zijn clusters van nogal ongedetailleerde tumorcellen te zien. Een vage impressie van een fibrovasculaire kern is te zien in de celgroep aan de rechterkant.
40x
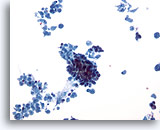
Afbeelding 30
Borst FNA, Ductaal carcinoom.
Dit laag vermogen veld vertoont overvloedig cellulaire necrose met een strak cluster van cellen in het midden, afkomstig van een invasief ductaal carcinoom.
20x
Afbeelding 30
Borst FNA, Ductaal carcinoom.
Dit laag vermogen veld vertoont overvloedig cellulaire necrose met een strak cluster van cellen in het midden, afkomstig van een invasief ductaal carcinoom.
20x
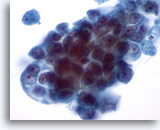
Afbeelding 31
Borst FNA, Ductaal carcinoom.
Bij een sterke vergroting vertonen de neoplastische cellen samenscholing en prominente nucleoli. De chromatine is abnormaal maar bleek.
60x
Afbeelding 31
Borst FNA, Ductaal carcinoom.
Bij een sterke vergroting vertonen de neoplastische cellen samenscholing en prominente nucleoli. De chromatine is abnormaal maar bleek.
60x
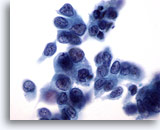
Afbeelding 32
Borst FNA, Ductaal carcinoom.
De tumorcellen in dit veld vertonen enige scheiding, pleomorfisme, kernonregelmatigheid, hyperchromasie en nucleoli.
60x
Afbeelding 32
Borst FNA, Ductaal carcinoom.
De tumorcellen in dit veld vertonen enige scheiding, pleomorfisme, kernonregelmatigheid, hyperchromasie en nucleoli.
60x
Afbeelding 33
Borst FNA, Ductaal carcinoom.
Op deze afbeelding worden necrose, kannibalisme in tumorcellen en celscheiding weergegeven.
60x
Afbeelding 33
Borst FNA, Ductaal carcinoom.
Op deze afbeelding worden necrose, kannibalisme in tumorcellen en celscheiding weergegeven.
60x
Afbeelding 34
Borst FNA, Ductaal carcinoom, laaggradig.
Hier zijn carcinoomcellen te zien, in clusters en los, vergezeld door calciumdeeltjes, die rood kleuren door de Papanicoloau kleuring. De cellen lijken monomorf, met gladde kernranden en micrnucleoli, wat een laaggradig ductaal carcinoom suggereert.
60x
Afbeelding 34
Borst FNA, Ductaal carcinoom, laaggradig.
Hier zijn carcinoomcellen te zien, in clusters en los, vergezeld door calciumdeeltjes, die rood kleuren door de Papanicoloau kleuring. De cellen lijken monomorf, met gladde kernranden en micrnucleoli, wat een laaggradig ductaal carcinoom suggereert.
60x
Afbeelding 35
Borst FNA, Ductaal carcinoom, laaggradig.
Er zijn veel losse carcinoomcellen te zien in dit veld. De kernen zijn bleek, maar het chhromatinepatroon is duidelijk abnormaal. Nucleoli zijn in dit voorbeeld niet vergroot.
60x
Afbeelding 35
Borst FNA, Ductaal carcinoom, laaggradig.
Er zijn veel losse carcinoomcellen te zien in dit veld. De kernen zijn bleek, maar het chhromatinepatroon is duidelijk abnormaal. Nucleoli zijn in dit voorbeeld niet vergroot.
60x
Afbeelding 36
Borst FNA, Ductaal carcinoom, laaggradig.
Dit is een voorbeeld van een laaggradig ductaal carcinoom. Enkele tumorcellen bevinden zich in een cluster met een paar losse cellen. Let op de ronde nucleaire randen.
60x
Afbeelding 36
Borst FNA, Ductaal carcinoom, laaggradig.
Dit is een voorbeeld van een laaggradig ductaal carcinoom. Enkele tumorcellen bevinden zich in een cluster met een paar losse cellen. Let op de ronde nucleaire randen.
60x
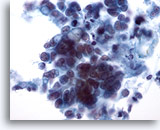
Afbeelding 37
Borst FNA, Ductaal carcinoom.
Dit veld toont tumorcellen die los liggen en in kleine clusters. Sommige cellen lijken intracytoplasmische vacuolen te bevatten De kerngrootte is variabel in clusters of cellen.
40x
Afbeelding 37
Borst FNA, Ductaal carcinoom.
Dit veld toont tumorcellen die los liggen en in kleine clusters. Sommige cellen lijken intracytoplasmische vacuolen te bevatten De kerngrootte is variabel in clusters of cellen.
40x
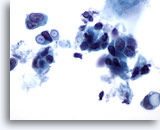
Afbeelding 38
Borst FNA, Ductaal carcinoom.
Deze maligne cellen laten duidelijk gedefiniëerde intracytoplasmatische vacuolen zien, waarvan sommige met targetoïd aspect. Hoewel dit kenmerk gewoonlijk wordt omschreven als een kenmerk van lobulair carcinoom, kan het ook aangetroffen worden in ductale carcinomen.
60x
Afbeelding 38
Borst FNA, Ductaal carcinoom.
Deze maligne cellen laten duidelijk gedefiniëerde intracytoplasmatische vacuolen zien, waarvan sommige met targetoïd aspect. Hoewel dit kenmerk gewoonlijk wordt omschreven als een kenmerk van lobulair carcinoom, kan het ook aangetroffen worden in ductale carcinomen.
60x
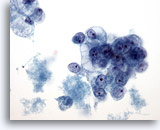
Afbeelding 39
Borst FNA, Ductaal carcinoom, stadium 2.
Hier zijn clusters van gevacuoliseerde maligne cellen te zien, met ronde kernen en prominente nucleoli. Merk de necrotische achtergrond op.
40x
Afbeelding 39
Borst FNA, Ductaal carcinoom, stadium 2.
Hier zijn clusters van gevacuoliseerde maligne cellen te zien, met ronde kernen en prominente nucleoli. Merk de necrotische achtergrond op.
40x
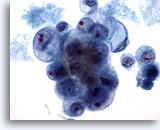
Afbeelding 40
Borst FNA, Ductaal carcinoom, stadium 2.
Dit is van dezelfde casus als afbeelding 39 hierboven. De tumorcellen vertonen duidelijke variatie in kern en grootte van nucleoli. Necrose is aanwezig. De biopsie werg gerapporteerd als matig gedifferentieerd ductaal carcinoom.
60x
Afbeelding 40
Borst FNA, Ductaal carcinoom, stadium 2.
Dit is van dezelfde casus als afbeelding 39 hierboven. De tumorcellen vertonen duidelijke variatie in kern en grootte van nucleoli. Necrose is aanwezig. De biopsie werg gerapporteerd als matig gedifferentieerd ductaal carcinoom.
60x
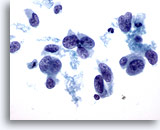
Afbeelding 41
Borst FNA, Ductaal carcinoom, hooggradig.
Dit veld geeft de variabiliteit weer in kernvorm, te zien bij ductaal carcinoom. Sommige kernen zijn bijna spoelvormig. De meeste kernen zijn veel groter dan de aangrenzende neutrofielen en lymfocyten. Het chromatinepatroon vertoont klontering en kleuring.
60x
Afbeelding 41
Borst FNA, Ductaal carcinoom, hooggradig.
Dit veld geeft de variabiliteit weer in kernvorm, te zien bij ductaal carcinoom. Sommige kernen zijn bijna spoelvormig. De meeste kernen zijn veel groter dan de aangrenzende neutrofielen en lymfocyten. Het chromatinepatroon vertoont klontering en kleuring.
60x
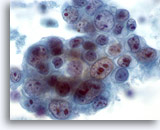
Afbeelding 42
Borst FNA, Ductaal carcinoom, hooggradig.
Dit is nog een voorbeeld van pleomorfisme in ductaal carcinoom. Dit cluster met tumorcellen bevat kernen van verschillende grootten. Sommige kernen hebben multipele grote nucleoli. Er is necrose te zien op de achtergrond. 60x
Afbeelding 42
Borst FNA, Ductaal carcinoom, hooggradig.
Dit is nog een voorbeeld van pleomorfisme in ductaal carcinoom. Dit cluster met tumorcellen bevat kernen van verschillende grootten. Sommige kernen hebben multipele grote nucleoli. Er is necrose te zien op de achtergrond.
60x
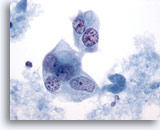
Afbeelding 43
Borst FNA, Ductaal carcinoom, hooggradig.
De maligne cellen in dit veld zijn meerkernig met bleke kernen, die klonterig en helder chromatine vertonen.
60x
Afbeelding 43
Borst FNA, Ductaal carcinoom, hooggradig.
De maligne cellen in dit veld zijn meerkernig met bleke kernen, die klonterig en helder chromatine vertonen.
60x
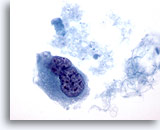
Afbeelding 44
Borst FNA, Ductaal carcinoom, hooggradig.
Dit is een beeld van dezelfde casus als in afbeelding 43 hierboven, en vertoont een tweekernige cel met hyperchromatische kernen en klonterig en helder chromatine.
60x
Afbeelding 44
Borst FNA, Ductaal carcinoom, hooggradig.
Dit is een beeld van dezelfde casus als in afbeelding 43 hierboven, en vertoont een tweekernige cel met hyperchromatische kernen en klonterig en helder chromatine.
60x
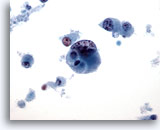
Afbeelding 45
Borst FNA, Ductaal carcinoom, hooggradig.
Dit is een voorbeeld van een hooggradig, slecht gedifferentieerd ductaal carcinoom. De cellen liggen los, er is abnormale chromatine en er zijn nucleoli zichtbaar en er is sprake van cellulaire necrose op de achtergrond.
40x
Afbeelding 45
Borst FNA, Ductaal carcinoom, hooggradig.
Dit is een voorbeeld van een hooggradig, slecht gedifferentieerd ductaal carcinoom. De cellen liggen los, er is abnormale chromatine en er zijn nucleoli zichtbaar en er is sprake van cellulaire necrose op de achtergrond.
40x
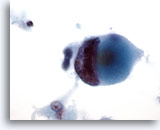
Afbeelding 46
Borst FNA, Ductaal carcinoom, hooggradig.
Let op de duidelijke klontering en clearing van chromatine in deze maligne cel, uit dezelfde casus als in afbeelding 45 hierboven.
60x
Afbeelding 46
Borst FNA, Ductaal carcinoom, hooggradig.
Let op de duidelijke klontering en clearing van chromatine in deze maligne cel, uit dezelfde casus als in afbeelding 45 hierboven.
60x
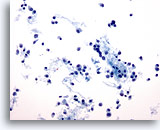
Afbeelding 47
Borst FNA, Lobulair carcinoom.
Aspiraties van lobulair carcinoom zijn vaak spaarzaam cellulair, maar kunnen soms veel cellen bevatten, zoals in dit voorbeeld. De tumorcellen liggen los, maar kunnen kleine aggregaten vormen, vaak met het uiterlijk van een losse rij.
20x
Afbeelding 47
Borst FNA, Lobulair carcinoom.
Aspiraties van lobulair carcinoom zijn vaak spaarzaam cellulair, maar kunnen soms veel cellen bevatten, zoals in dit voorbeeld. De tumorcellen liggen los, maar kunnen kleine aggregaten vormen, vaak met het uiterlijk van een losse rij.
20x
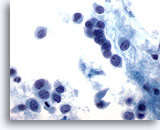
Afbeelding 48
Borst FNA, Lobulair carcinoom.
De neoplastische cellen zijn doorgaans klein, met ronde tot onregelmatige kernranden en excentrische kernen, en produceren een plasmacytoide uiterlijk, zoals in dit veld wordt afgebeeld.
60x
Afbeelding 48
Borst FNA, Lobulair carcinoom.
De neoplastische cellen zijn doorgaans klein, met ronde tot onregelmatige kernranden en excentrische kernen, en produceren een plasmacytoide uiterlijk, zoals in dit veld wordt afgebeeld.
60x
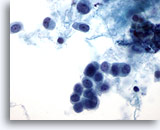
Afbeelding 49
Borst FNA, Lobulair carcinoom.
Hier zijn cellen met een plasmacytoïde uiterlijk en ronde kernen te zien. Het achtergrondmateriaal lijkt eerder proteineachtig van aard, dan necrotisch. Een kleine losse rij van 3 cellen is te zien in het midden van het veld.
60x
Afbeelding 49
Borst FNA, Lobulair carcinoom.
Hier zijn cellen met een plasmacytoïde uiterlijk en ronde kernen te zien. Het achtergrondmateriaal lijkt eerder proteineachtig van aard, dan necrotisch. Een kleine losse rij van 3 cellen is te zien in het midden van het veld.
60x
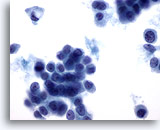
Afbeelding 50
Borst FNA, Lobulair carcinoom.
Intracytoplasmische kernen zijn vaak te zien in aspiraties van lobulair carcinoom, zoals te zien is in de losse cel, linksboven in het veld. Vacuolen komen niet uitsluitend voor in lobulair carcinoom, maar ze worden ook aangetroffen in carcinoom.
60x
Afbeelding 50
Borst FNA, Lobulair carcinoom.
Intracytoplasmische kernen zijn vaak te zien in aspiraties van lobulair carcinoom, zoals te zien is in de losse cel, linksboven in het veld. Vacuolen komen niet uitsluitend voor in lobulair carcinoom, maar ze worden ook aangetroffen in carcinoom.
60x
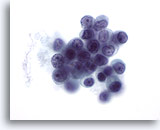
Afbeelding 51
Borst FNA, Lobulair carcinoom.
Hoewel nucleoli geen vaak voorkomende eigenschap is in lobulair carcinoom (behalve in pleomorf lobulair carcinoom), kunnen ze heel soms worden waargenomen.
60x
Afbeelding 51
Borst FNA, Lobulair carcinoom.
Hoewel nucleoli geen vaak voorkomende eigenschap is in lobulair carcinoom (behalve in pleomorf lobulair carcinoom), kunnen ze heel soms worden waargenomen.
60x
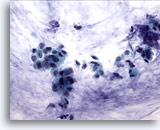
Afbeelding 52
Borst FNA, Colloïde (mucineus) carcinoom.
Clusters van kleine cellen en enkele losse cellen worden weergegeven in een achtergrond van mucine. Het heeft de voorkeur om dergelijke gevallen eerder aan te merken als ductaal carcinoom, dat mucineuze differentiatie vertoont, dan colloïde of mucineus carcinoom, omdat de diagnose afhangt van de hele tumor die mucinevorming vertoont.
40x
Afbeelding 52
Borst FNA, Colloïde (mucineus) carcinoom.
Clusters van kleine cellen en enkele losse cellen worden weergegeven in een achtergrond van mucine. Het heeft de voorkeur om dergelijke gevallen eerder aan te merken als ductaal carcinoom, dat mucineuze differentiatie vertoont, dan colloïde of mucineus carcinoom, omdat de diagnose afhangt van de hele tumor die mucinevorming vertoont.
40x
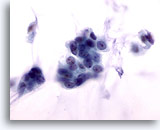
Afbeelding 53
Borst FNA, Colloïde carcinoom.
De maligne cellen in deze laesie zijn ongedetailleerd, met gladde kernranden, gelijkmatig verdeelde chromatine en geen waarneembare nucleoli. Als de mucine niet wordt opgemerkt, kunnen de cellen verkeerd geinterpreteerd worden als goedaardig.
60x
Afbeelding 53
Borst FNA, Colloïde carcinoom..
De maligne cellen in deze laesie zijn ongedetailleerd, met gladde kernranden, gelijkmatig verdeelde chromatine en geen waarneembare nucleoli. Als de mucine niet wordt opgemerkt, kunnen de cellen verkeerd geinterpreteerd worden als goedaardig.
60x
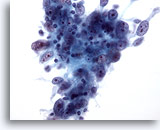
Afbeelding 54
Borst FNA, Medullair carcinoom.
Fijne naald aspiraties van deze tumoren vertonen kenmerkend clusters van grote pleomorfe tumorcellen, met prominente nucleoli, gemengd met lymfocyten, zoals hier te zien is. Er kunnen ook plasmacellen worden waargenomen. 40x
Afbeelding 54
Borst FNA, Medullair carcinoom.
Fijne naald aspiraties van deze tumoren vertonen kenmerkend clusters van grote pleomorfe tumorcellen, met prominente nucleoli, gemengd met lymfocyten, zoals hier te zien is. Er kunnen ook plasmacellen worden waargenomen.
40x
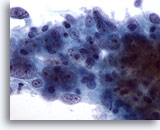
Afbeelding 55
Borst FNA, Medullair carcinoom.
Dit celcluster vertoont grote centrale nucleoli en abnormale chromatine. Er zijn ook lymfocyten te zien.
60x
Afbeelding 55
Borst FNA, Medullair carcinoom.
Dit celcluster vertoont grote centrale nucleoli en abnormale chromatine. Er zijn ook lymfocyten te zien.
60x
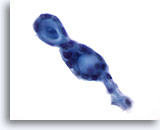
Afbeelding 56
Borst FNA, Adenoïde cystisch carcinoom
Deze tumoren bevatten kenmerkend extracellulair hyaline materiaal, in bolvormige of cilindrische/tubulaire vormen, omgeven door kleine, ongedetailleerde neoplastische cellen. In dit veld zijn twee aangrenzende bolvormige structuren waarneembaar.
60x
Afbeelding 56
Borst FNA, Adenoïde cystisch carcinoom
Deze tumoren bevatten kenmerkend extracellulair hyaline materiaal, in bolvormige of cilindrische/tubulaire vormen, omgeven door kleine, ongedetailleerde neoplastische cellen. In dit veld zijn twee aangrenzende bolvormige structuren waarneembaar.
60x
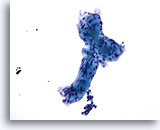
Afbeelding 57
Borst FNA, Adenoïde cystisch carcinoom
Hier is extracellulair hyaline materiaal mooi afgebeeld, terwijl het een vage tubulus vormt met twee aangehechte bolvormige structuren.
20x
Afbeelding 57
Borst FNA, Adenoïde cystisch carcinoom
Hier is extracellulair hyaline materiaal mooi afgebeeld, terwijl het een vage tubulus vormt met twee aangehechte bolvormige structuren.
20x

Afbeelding 58
Borst FNA, Adenoïde cystisch carcinoom
Dit veld laat een verzameling zien van hyaline globulen met bovenliggende kleine tumorcellen. De differentiële diagnose is collageensferulose, een goedaardige laesie waarin de hyaline globulen gepaard gaan met goedaardige of hyperplastische ductale cellen.
60x
Afbeelding 58
Borst FNA, Adenoïde cystisch carcinoom
Dit veld laat een verzameling zien van hyaline globulen met bovenliggende kleine tumorcellen. De differentiële diagnose is collageensferulose, een goedaardige laesie waarin de hyaline globulen gepaard gaan met goedaardige of hyperplastische ductale cellen.
60x
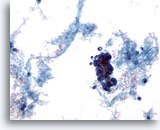
Afbeelding 59
Borst FNA, Maligne cyste.
Niet alle cysten zijn goedaardig. Sommige ductale carcinomen, kunnen er uitzien als een cystische laesie, zoals in dit voorbeeld. Het lage vermogen beeld laat proteïneachtig materiaal, bloed en een cluster van hyperchromatische cellen zien.
20x
Afbeelding 59
Borst FNA, Maligne cyste.
Niet alle cysten zijn goedaardig. Sommige ductale carcinomen, kunnen er uitzien als een cystische laesie, zoals in dit voorbeeld. Het lage vermogen beeld laat proteïneachtig materiaal, bloed en een cluster van hyperchromatische cellen zien.
20x
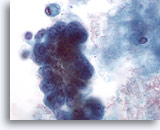
Afbeelding 60
Borst FNA, Maligne cyste.
Bij hoog vermogen vertoont het celcluster dat we eerder zagen in afbeelding 59, pleomorfisme, zichtbare nucleoli en vacuolisatie. De excisiebiopsie liet ductaal carcinoom zien.
60x
Afbeelding 60
Borst FNA, Maligne cyste.
Bij hoog vermogen vertoont het celcluster dat we eerder zagen in afbeelding 59, pleomorfisme, zichtbare nucleoli en vacuolisatie. De excisiebiopsie liet ductaal carcinoom zien.
60x
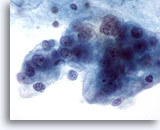
Afbeelding 61
Borst FNA, Maligne cyste.
Dit is een ander voorbeeld van ductaal carcinoom, dat vastgesteld werd op basis van een aspiratie van een cyste. Dit veld laat duidelijk pleomorfe, gevacuoliseerde maligne cellen zien, met nucleoli en abnormaal chromatine.
60x
Afbeelding 61
Borst FNA, Maligne cyste.
Dit is een ander voorbeeld van ductaal carcinoom, dat vastgesteld werd op basis van een aspiratie van een cyste. Dit veld laat duidelijk pleomorfe, gevacuoliseerde maligne cellen zien, met nucleoli en abnormaal chromatine.
60x
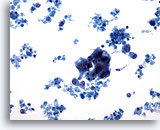
Afbeelding 62
Borst FNA, Maligne cyste.
Dit veld vertoont een hyperchromatisch cluster van epitheelcellen met veel cellulair materiaal op de achtergrond, verdenking van carcinoom.
20x
Afbeelding 62
Borst FNA, Maligne cyste.
Dit veld vertoont een hyperchromatisch cluster van epitheelcellen met veel cellulair materiaal op de achtergrond, verdenking van carcinoom.
20x
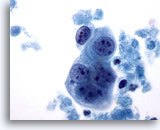
Afbeelding 63
Borst FNA, Maligne cyste.
Hier is een kleine groep tumorcellen te zien, met prominente nucleoli en redelijk gladde kernranden. Let op de omringende necrose.
60x
Afbeelding 63
Borst FNA, Maligne cyste.
Hier is een kleine groep tumorcellen te zien, met prominente nucleoli en redelijk gladde kernranden. Let op de omringende necrose.
60x
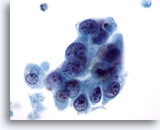
Afbeelding 64
Borst FNA, Maligne cyste.
Dit is dezelfde casus als afbeelding 63 hierboven. De cellen vertonen overlapping, maar ook een spoor van afscheiding, onregelmatige kernranden, abnormale chromatine en zichtbare nucleoli.
60x
Afbeelding 64
Borst FNA, Maligne cyste.
Dit is dezelfde casus als afbeelding 63 hierboven. De cellen vertonen overlapping, maar ook een spoor van afscheiding, onregelmatige kernranden, abnormale chromatine en zichtbare nucleoli.
60x
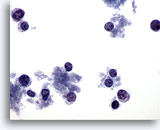
Afbeelding 65
Borst FNA, Lymfoom.
Dit veld laat verspreide cellen met heel weinig cytoplasma zien. Er zijn geen clusters aanwezig. De cellen hebben ronde kernen met een rand van cytoplasma aan een kant. De kenmerken lijken eerder lymfoïde dan epitheliaal.
40x
Afbeelding 65
Borst FNA, Lymfoom.
Dit veld laat verspreide cellen met heel weinig cytoplasma zien. Er zijn geen clusters aanwezig. De cellen hebben ronde kernen met een rand van cytoplasma aan een kant. De kenmerken lijken eerder lymfoïde dan epitheliaal.
40x
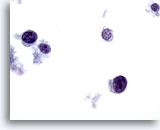
Afbeelding 66
Borst FNA, Lymfoom.
Borst FNA, Lymfoom.
Bij een sterke vergroting is te zien dat de cellen lymfoïde zijn, met een kenmerkend chromatinepatroon. Immuuncytochemische kleuringen, zoals Leukocyte Common Antigen (LCA), uitgevoerd op een ongekleurd ThinPrep objectglaasje, zou de diagnose bevestigen.
60x
Afbeelding 66
Borst FNA, Lymfoom.
Borst FNA, Lymfoom.
Bij een sterke vergroting is te zien dat de cellen lymfoïde zijn, met een kenmerkend chromatinepatroon. Immuuncytochemische kleuringen, zoals Leukocyte Common Antigen (LCA), uitgevoerd op een ongekleurd ThinPrep objectglaasje, zou de diagnose bevestigen.
60x


































































