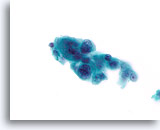
Cellient Atlas - Borst FNA
INLEIDING
Andrew H. Fischer, M.D
Let op: De celblokafbeeldingen zijn tot stand gekomen met behulp van een handmatige methode tijdens de ontwikkeling van het geautomatiseerde instrument.
FNA van de mamma is een effectief middel om mammacarcinoom te detecteren, zodat kan worden bepaald wat de beste behandeling is, terwijl maligniteit kan worden uitgesloten in de meeste benigne laesies. [1, 2] Vergeleken met een core biopsie is er minder morbiditeit, inclusief hematomen, infectie, pijn en risico locale uitbreiding in het biopsie gebied. Niettemin zijn er de afgelopen tien jaar minder FNA-biopsieën van de borst uitgevoerd ten gunste van agressievere core biopsie technieken (stereotactische biopten). Sommige pathologen geven de voorkeur aan de histologische evaluatie van de kernbiopsieën, omdat deze relatief snel en gemakkelijk kunnen worden geanalyseerd en immunohistochemische (IHC) analyses kunnen worden toegepast. Celblokken van borst FNA’s bieden dezelfde voordelen. Van een combinatie van FNA met een core biopt is aangetoond dat het de diagnostische nauwkeurigheid verbetert. [3] Onze recente ervaring suggereert dat een combinatie van een cytologisch preparaat van een borst FNA met een celblok ook de voordelen van beide benaderingen kan combineren. [4]
De huidige cytologische classificatie van cytologische monsters van borstweefsel [5] omvat 5 categorieën: Negatief voor maligniteit cellen (waartoe milde proliferatieve veranderingen kunnen horen), atypisch, verdacht, maligne en onvoldoende voor diagnose. De categorie Atypisch is een groot dilemma voor borst FNA. Van de criteria voor atypische laesies is aangetoond dat ze slecht reproduceerbaar zijn en atypische borst FNA’s blijken achteraf slechts in 1/3 van de gevallen te corresponderen met kanker.[2, 3, 6] Tengevolge van het hoge percentage kankergevallen na een ‘atypisch’ borst FNA-resultaat, wordt gewoonlijk een biopsie aanbevolen. [5] De categorie Verdacht is ook problematisch. Het besluit van de chirurg om in het begin chirurgisch in te grijpen (mastectomie of lumpectomie waarbij getracht wordt adequate resectiemarges tot stand te brengen, in combinatie met monsterafname van de lymfeklieren) is belangrijk om te voorkomen dat meerdere kostbare ingrepen worden uitgevoerd die tot een minder dan optimaal cosmetisch resultaat kunnen leiden. Om overbehandeling van benigne laesies te voorkomen en optimale cosmetische resultaten te bereiken, is het soms nodig dat de chirurg een tweede diagnostische biopsie verricht na een verdachte cytologische diagnose na FNA.
Het grootste probleem bij het classificeren van proliferatieve ductale laesies met behulp van cytologie is dat de mate van hyperplasie gedefinieerd wordt door veranderingen op weefselniveau en niet door cytologische veranderingen. [7] Hyperplasie is gedefinieerd als de stratificatie van ductale cellen weg van de micro-omgeving van het basaalmembraan. De mate van hyperplasie is histologisch gegradeerd in typische ductale hyperplasie en atypische ductale hyperplasie.
Bij typische ductale hyperplasie blijft de polariteit tussen aangrenzende cellen focaal in stand en is de lange as van de cellen in dezelfde richting uitgelijnd. [7] Door deze uitlijning ziet de gestratificeerde populatie er uit als een stroming of vage ‘school met vissen’. De lange as van de cellen heeft bij typische hyperplasie ook de neiging om zichzelf uit te lijnen met de residuele lumina in de melkgangen en de residuele lumina hebben vaak een langwerpige vorm met een onduidelijke rand. De spreiding van de kernen bij typische hyperplasie varieert vaak over de diameter van de melkgang. Typische hyperplasie toont vaak een bijmengsel van een duidelijk verschillende myoepitheliale celpopulatie met de ductale cellen. Merk op dat pagetoïde verspreiding van borstkanker in benigne gangen een mengsel van celtypen kan simuleren. [7] Bij typische hyperplasie kan ten slotte het algemene uiterlijk van de cellen voorspelbaar variëren afhankelijk van hoe ver de cellen weggestratificeerd zijn van het basaalmembraan. Gewoonlijk wordt de kern donkerder en het cytoplasma dichter opeengepakt als de cellen verder van de natieve zone van het basaalmembraan verwijderd zijn.[8]
Atypische ductale hyperplasie wordt gekenmerkt door een stratificerende populatie met een verlies aan gedeelde polariteit (geen stroming) tussen aangrenzende cellen, geen zichtbare bijmenging van myoepitheliale cellen, residuele lumina die gladder en ronder worden (‘uitgeslagen’ ) met de lange as van de kernen gerandomiseerd ten opzichte van de randen van de lumina, en geen duidelijke rijping van de cellen als ze verder van de zone van het basaalmembraan stratificeren. [8] In de meeste gevallen kunnen deze kenmerken gemakkelijk bij een kleine vergroting in histologische monsters worden opgemerkt. De diagnose Ductaal carcinoom in situ wordt gesteld als bovengenoemde kenmerken van atypische hyperplasie duidelijk ontwikkeld zijn en de celpopulatie zich uitstrekt over vele gangen.
Veel van deze diagnostische histologische kenmerken die de mate van hyperplasie definiëren, zijn in cytologische preparaten moeilijk of onmogelijk te onderscheiden, tenzij een sterke vergroting wordt gebruikt om van boven naar beneden door de stapels cellen te focussen. Aan de andere kant zijn er enkele kenmerken die cytologen kunnen gebruiken om ductale proliferaties te kenmerken en te herkennen die chirurgische pathologen niet kunnen gebruiken. Discohesie van de ductale cellen in een belangrijk kenmerk. In celblokken worden afzonderlijke discohesieve cellen gevangen, waardoor dit belangrijke kenmerk kan worden opgemerkt.
Het is belangrijk op te merken dat atypische kernen niet kernmerkend zijn voor een laaggradig ductaal carcinoom in situ of atypische hyperplasie. Atypische kernen zijn een kenmerk van hooggradige ductale carcinomen. In celblokken worden de kenmerken van de kern duidelijk bewaard, vergelijkbaar met cytologische preparaten, waardoor zowel de laaggradige veranderingen in de architectuur als de hooggradige veranderingen in de cytologie kunnen worden opgemerkt.
Een moeilijke differentiële diagnose in mamma FNA is het onderscheid tussen een fibroadenoom. papilloom en papillair carcinoom. Het onderscheid is belangrijk omdat fibroadenomen niet hoeven worden weggenomen, als ze juist gediagnosticeerd zijn. Centrale papillomen hoeven niet noodzakelijkerwijs te worden weggesneden of behoeven slechts een grove excisie. Papillaire carcinomen moeten aan de andere kant zorgvuldig en volledig worden weggesneden met duidelijke marges. Het onderscheid tussen een papilloom en een papillair carcinoom wordt gedefinieerd door de afwezigheid van een myoepitheliale celpopulatie bij papillaire carcinomen of de aanwezigheid van stratificatie die voldoet aan de architecturele criteria voor een in-situ carcinoom. Myoepitheliale cellen kunnen moeilijk of niet onderscheiden worden in eenlagige cytologische preparaten en papillomen kunnen aanzienlijke stratificatie en atypische kernen vertonen. Men is het er algemeen over eens dat het onderscheid tussen een papillair carcinoom en een papilloom bijna onmogelijk is op basis van cytologische preparaten alleen. Terwijl sommige residuele myoepitheliale cellen vaak bewaard blijven naast het basaalmembraan bij een ductaal carcinoom in situ, vertoont een niet-invasief papillair carcinoom zelden residuele myoepitheliale cellen. [7] Immunohistochemische kleuring voor myoepitheliale cellen (calponine, p63 en gladde spier-actine) in celblokcoupes kunnen erg nuttig zijn om papillomen te onderscheiden van papillaire carcinomen. [9, 10, 11, 12]
Een lobulair carcinoom is moeilijk te onderscheiden van een ductaal carcinoom met behulp van cytopathologie. Het onderscheid kan soms belangrijk zijn. Aangezien lobulaire carcinomen in situ soms niet chirurgisch worden behandeld, kan het zeldzame optreden van een lobulair carcinoom in situ als incidentele vondst (bijv. bij het koloniseren van een fibroadenoom) tot een uitgebreide chirurgische ingreep leiden. Op cytologische FNA-preparaten zijn lobulaire carcinomen meestal erg weinig cellulair en worden gemakkelijk ondergediagnosticeerd. Niet alleen zijn er gewoonlijk weinig cellen, de cellen kunnen ook erg onbeduidend zijn. Gebrek aan polariteit in de spaarzame cellen en de aanwezigheid van mucine vacuolen zijn nuttige diagnostische kernmerken van een lobulair carcinoom. Intracellulair mucine komt erg zelden voor in normale ductale cellen en de aanwezigheid ervan kan in celblokken worden aangetoond. Een lobulair carcinoom wordt gekenmerkt door verlies van E-cadherine expressie dat in histologische coupes met behulp van immunohistochemie kan worden gedetecteerd [12]. Het is ons opgevallen dat de stromale weefselfragmenten die door FNA worden verkregen vaak lobulaire carcinoomcellen bevatten die in celblokken zichtbaar zijn; dit suggereert dat de toevoeging van een celblok aan borst FNA de detectie en specifieke diagnose van lobulair carcinoom kan helpen verbeteren.
Met cytologische preparaten kan de aanwezigheid van invasiviteit niet gediagnosticeerd worden. [13] Aangezien voor in situ carcinomen misschien geen monsterverzameling van de lymfeklier nodig is, is dit een belangrijke beperking van borst FNA voor het plannen van de behandeling. Door het gebruik van celblokken hebben we onlangs gevonden dat invasiviteit kan worden gediagnosticeerd in een aanzienlijk percentage borstkanker FNA’s. [4]
In dit hoofdstuk zullen we aantonen dat de combinatie van cytologische preparaten met celblokken een combinatie is van de voordelen van beide technieken: met de microbiopten die met behulp FNA worden verkregen kunnen zowel cytologische als histologische criteria worden toegepast.
voor een uitvergroot beeld.
Benigne
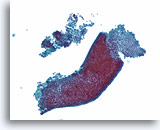
Benigne ductale cellen, Borst FNA, ThinPrep®.
Normale ductale cellen vormen een enkele cellaag die bevestigd is aan het basaalmembraan. De 2-dimensionaal geordende ductale cellen zijn onderling cohesief, maar kunnen in fijne naaldaspiraties gemakkelijke van het basaalmembraan worden gestript. In een eenlagig preparaat liggen de ductale cellen gewoonlijk als een platte laag parallel aan het oppervalk van het objectglaasje (rechts). Ze kunnen zich ook voordoen als een intacte melkgang van één cel dik (onderste deel). Kleinere melkgangen (linksboven) kunnen complexere vormen hebben en zonder van boven naar beneden te focussen kan het moeilijker zijn om in te zien dat de cellen slechts één laag dik zijn.
20X
Benigne ductale cellen, Borst FNA, ThinPrep®.
Normale ductale cellen vormen een enkele cellaag die bevestigd is aan het basaalmembraan. De 2-dimensionaal geordende ductale cellen zijn onderling cohesief, maar kunnen in fijne naaldaspiraties gemakkelijke van het basaalmembraan worden gestript. In een eenlagig preparaat liggen de ductale cellen gewoonlijk als een platte laag parallel aan het oppervalk van het objectglaasje (rechts). Ze kunnen zich ook voordoen als een intacte melkgang van één cel dik (onderste deel). Kleinere melkgangen (linksboven) kunnen complexere vormen hebben en zonder van boven naar beneden te focussen kan het moeilijker zijn om in te zien dat de cellen slechts één laag dik zijn.
20X
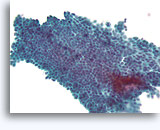
Benigne ductale cellen, Borst FNA, ThinPrep®.
Myoepitheliale cellen zijn een ander celtype dat zich gewoonlijk tussen het basaalmembraan en de ductale cellen bevindt. Zij hebben gewoonlijk een enigszins donkerder kern en lichter fragiel cytoplasma dat kan scheuren als de ductale cellen van het basaalmembraan worden gestript.
40X
Benigne ductale cellen, Borst FNA, ThinPrep®.
Myoepitheliale cellen zijn een ander celtype dat zich gewoonlijk tussen het basaalmembraan en de ductale cellen bevindt. Zij hebben gewoonlijk een enigszins donkerder kern en lichter fragiel cytoplasma dat kan scheuren als de ductale cellen van het basaalmembraan worden gestript.
40X
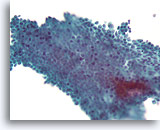
Benigne ductale cellen, Borst FNA, ThinPrep®.
Door van boven naar beneden te focussen kan men zien dat de myoepitheliale cellen van een normale melkgang losjes maar voorspelbaar in een vlak liggen dat parallel is aan de ductale cellen.
40X
Benigne ductale cellen, Borst FNA, ThinPrep®.
Door van boven naar beneden te focussen kan men zien dat de myoepitheliale cellen van een normale melkgang losjes maar voorspelbaar in een vlak liggen dat parallel is aan de ductale cellen.
40X
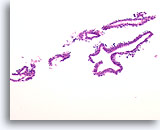
Benigne ductale cellen, Borst FNA, Celblok.
Wat er met ThinPrep® uitzag als een platte laag, ziet er nu uit als een lijn van cellen. U kunt gemakkelijk bij een kleine vergroting zien dat de benigne ductale cellen slechts een dikte van één cel hebben. Let op de licht klevende myoepitheliale cellen aan de buitenkant van de melkgang.
20X
Benigne ductale cellen, Borst FNA, Celblok.
Wat er met ThinPrep® uitzag als een platte laag, ziet er nu uit als een lijn van cellen. U kunt gemakkelijk bij een kleine vergroting zien dat de benigne ductale cellen slechts een dikte van één cel hebben. Let op de licht klevende myoepitheliale cellen aan de buitenkant van de melkgang.
20X
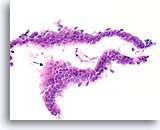
Benigne ductale cellen, Borst FNA, Celblok.
U kunt zien dat de cellen niet echt op elkaar zijn gestapeld weg van het basaalmembraan en de myoepitheliale zone door op te merken dat het cytoplasma aan de rand van het tangentiële gebied (pijl) voorspelbaar overvloediger wordt.
40X
Benigne ductale cellen, Borst FNA, Celblok.
U kunt zien dat de cellen niet echt op elkaar zijn gestapeld weg van het basaalmembraan en de myoepitheliale zone door op te merken dat het cytoplasma aan de rand van het tangentiële gebied (pijl) voorspelbaar overvloediger wordt.
40X
Normale ductale hyperplasie
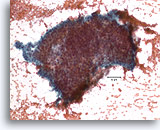
Proliferatieve ductale laesie, Borst FNA, Directe uitstrijk.
Stratificatie van de ductale cellen staat bekend als hyperplasie of proliferatieve veranderingen. Storend bloed en de dikte van de fragmenten maken het moeilijk om in te schatten hoe veel hyperplasie aanwezig is.
20X
Proliferatieve ductale laesie, Borst FNA, Directe uitstrijk.
Stratificatie van de ductale cellen staat bekend als hyperplasie of proliferatieve veranderingen. Storend bloed en de dikte van de fragmenten maken het moeilijk om in te schatten hoe veel hyperplasie aanwezig is.
20X
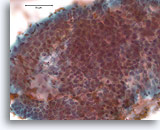
Proliferatieve ductale laesie, Borst FNA, Directe uitstrijk.
Bij een sterkere vergroting kan men door van boven naar beneden te focussen enkele vermoedelijke myoepitheliale cellen zien die vermengd zijn met de ductale cellen en vermoedelijke spleetachtige ruimten. Deze twee kenmerken zijn kenmerkend voor ductale hyperplasie van het gewone type, een laesie die ruwweg een tweevoudige toename in het relatieve risico van borstkanker vertegenwoordigt.[14].
40X
Proliferatieve ductale laesie, Borst FNA, Directe uitstrijk.
Bij een sterkere vergroting kan men door van boven naar beneden te focussen enkele vermoedelijke myoepitheliale cellen zien die vermengd zijn met de ductale cellen en vermoedelijke spleetachtige ruimten. Deze twee kenmerken zijn kenmerkend voor ductale hyperplasie van het gewone type, een laesie die ruwweg een tweevoudige toename in het relatieve risico van borstkanker vertegenwoordigt.[14].
40X
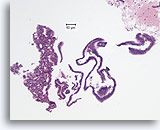
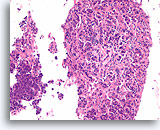
Typische ductale cellen, Borst FNA, Celblok.
Deze naaldspoeling van de patiënt in afbeelding 5 toont benigne ductale cellen als eenlagige epitheelstroken aan de rechterkant van de afbeelding. Aan de linkerkant ziet u een gebied met typische hyperplasie. De stratificatie van de cellen in dit gebied kan niet worden verklaard door tangentieel snijden. Met deze kleine vergroting kunt u de spleetachtige ruimten tussen de stratificerende ductale cellen zien, Ook kenmerkend voor typische ductale hyperplasie is de aanwezigheid van een mengsel van cellen met verschillende cytologische kenmerken (myoepitheliale cellen) in de stratificerende populatie.
10X
Typische ductale cellen, Borst FNA, Celblok.
Deze naaldspoeling van de patiënt in afbeelding 5 toont benigne ductale cellen als eenlagige epitheelstroken aan de rechterkant van de afbeelding. Aan de linkerkant ziet u een gebied met typische hyperplasie. De stratificatie van de cellen in dit gebied kan niet worden verklaard door tangentieel snijden. Met deze kleine vergroting kunt u de spleetachtige ruimten tussen de stratificerende ductale cellen zien, Ook kenmerkend voor typische ductale hyperplasie is de aanwezigheid van een mengsel van cellen met verschillende cytologische kenmerken (myoepitheliale cellen) in de stratificerende populatie.
10X
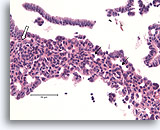
Typische ductale cellen, Borst FNA, Celblok.
Let op het mengsel van donkerder en lichterkleurende kernen en op de langwerpige ruimten. Bij typische ductale hyperplasie hebben de cellen de neiging om zich langs de as van de ruimten te groeperen (pijlen). Een andere nuttig diagnostisch kenmerk is de uitlijning van de lange as van de kernen van aangrenzende cellen, met een stromings- of vaag patroon van een ‘school vissen’ (open pijl). Deze kenmerken die duidelijk zichtbaar zijn bij een relatie kleine vergroting in histologische coupes, kunnen moeilijk of helemaal niet zichtbaar zijn in cytologische preparaten.
40X
Typische ductale cellen, Borst FNA, Celblok.
Let op het mengsel van donkerder en lichterkleurende kernen en op de langwerpige ruimten. Bij typische ductale hyperplasie hebben de cellen de neiging om zich langs de as van de ruimten te groeperen (pijlen). Een andere nuttig diagnostisch kenmerk is de uitlijning van de lange as van de kernen van aangrenzende cellen, met een stromings- of vaag patroon van een ‘school vissen’ (open pijl). Deze kenmerken die duidelijk zichtbaar zijn bij een relatie kleine vergroting in histologische coupes, kunnen moeilijk of helemaal niet zichtbaar zijn in cytologische preparaten.
40X
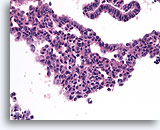
Typische ductale cellen, Borst FNA, Celblok.
Benigne ductale cellen met milde cilindervormige veranderingen (boven) contrasteren met het gebied met typische ductale hyperplasie (onder). Let op de duidelijk afwijkende celtypen in het midden; sommige met grote, bleke kernen en anderen met kleine, donkere kernen.
40X
Typische ductale cellen, Borst FNA, Celblok.
Benigne ductale cellen met milde cilindervormige veranderingen (boven) contrasteren met het gebied met typische ductale hyperplasie (onder). Let op de duidelijk afwijkende celtypen in het midden; sommige met grote, bleke kernen en anderen met kleine, donkere kernen.
40X
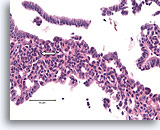
Typische ductale cellen, Borst FNA, Celblok.
Let op de stroming van kernen in het gebied links, dat doet denken aan een ‘school vissen’ (pijl).
40X
Typische ductale cellen, Borst FNA, Celblok.
Let op de stroming van kernen in het gebied links, dat doet denken aan een ‘school vissen’ (pijl).
40X
Atypische ductale hyperplasie
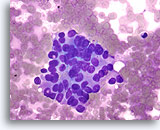
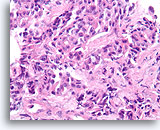
Atypische proliferatieve ductale laesie, Borst FNA, Diff-Quick gekleurde uitstrijk.
De ductale cellen zijn in drie dimensies opgestapeld. Er is geen duidelijke populatie myoepitheliale cellen en linksonder is er slechts focaal mogelijk gedeelde polariteit van aangrenzende ductale cellen.
60X
Atypische proliferatieve ductale laesie, Borst FNA, Diff-Quick gekleurde uitstrijk.
De ductale cellen zijn in drie dimensies opgestapeld. Er is geen duidelijke populatie myoepitheliale cellen en linksonder is er slechts focaal mogelijk gedeelde polariteit van aangrenzende ductale cellen.
60X
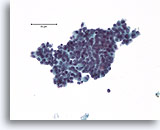
Atypische proliferatieve ductale laesie, Borst FNA, ThinPrep®.
Let op de duidelijke celstratificatie. In het midden is duidelijk een vaag stromingspatroon zichtbaar, wat pleit voor benigne ductale hyperplasie, maar als de architecturele ordening van de cellen niet gekarakteriseerd kan worden, kan atypische ductale hyperplasie niet worden uitgesloten.
40X
Atypische proliferatieve ductale laesie, Borst FNA, ThinPrep®.
Let op de duidelijke celstratificatie. In het midden is duidelijk een vaag stromingspatroon zichtbaar, wat pleit voor benigne ductale hyperplasie, maar als de architecturele ordening van de cellen niet gekarakteriseerd kan worden, kan atypische ductale hyperplasie niet worden uitgesloten.
40X
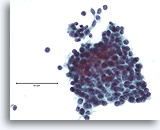
Atypische proliferatieve ductale laesie, Borst FNA, ThinPrep®.
Atypische kenmerken omvatten de licht discohesieve ductale populatie (let op afzonderlijke ductale cellen), de aanwezigheid van een stratificerende populatie ductale cellen zonder een duidelijke bijmenging met myoepitheliale cellen en de nagenoeg afwezigheid van gedeelde polariteit tussen de ductale cellen.
60X
Atypische proliferatieve ductale laesie, Borst FNA, ThinPrep®.
Atypische kenmerken omvatten de licht discohesieve ductale populatie (let op afzonderlijke ductale cellen), de aanwezigheid van een stratificerende populatie ductale cellen zonder een duidelijke bijmenging met myoepitheliale cellen en de nagenoeg afwezigheid van gedeelde polariteit tussen de ductale cellen.
60X
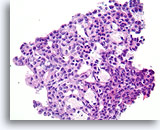
Typische ductale cellen, Borst FNA, Celblok.
Merk op hoe de cytoplasmische kenmerken voorspelbaar veranderen in de richting van het rechter ondergedeelte van het veld. Dit kenmerk van typische hyperplasie is moeilijk waar te nemen in cytologische preparaten. Er is ook enige uitlijning van de lange as van de ductale celkernen met een subtiele, maar duidelijk benigne stromingspatroon; dit is vooral zichtbaar rechts onderin. Let ook op de ductale celkernen die parallel met de langwerpige ruimten zijn uitgelijnd.
40X
Typische ductale cellen, Borst FNA, Celblok.
Merk op hoe de cytoplasmische kenmerken voorspelbaar veranderen in de richting van het rechter ondergedeelte van het veld. Dit kenmerk van typische hyperplasie is moeilijk waar te nemen in cytologische preparaten. Er is ook enige uitlijning van de lange as van de ductale celkernen met een subtiele, maar duidelijk benigne stromingspatroon; dit is vooral zichtbaar rechts onderin. Let ook op de ductale celkernen die parallel met de langwerpige ruimten zijn uitgelijnd.
40X
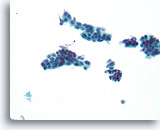
Verdachte proliferatieve ductale laesie, Borst FNA, ThinPrep®.
Met uitzondering van sommige mogelijk gedeelde polariteit in de ductale celgroep net links van het midden, zijn de bevindingen verontrustend door de aanwezigheid van een eenvormige celpopulatie die stratificeren en discohesie vertonen.
40X
Verdachte proliferatieve ductale laesie, Borst FNA, ThinPrep®.
Met uitzondering van sommige mogelijk gedeelde polariteit in de ductale celgroep net links van het midden, zijn de bevindingen verontrustend door de aanwezigheid van een eenvormige celpopulatie die stratificeren en discohesie vertonen.
40X
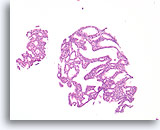
Atypische ductale hyperplasie, Borst FNA, Celblok.
Dit plaatje van de naaldspoeling van de patiënt in afbeelding 15 toont een uniforme populatie van vrijelijk stratificerende ductale cellen met een uniforme spreiding van kernen, afwezigheid van een stromingspatroon en de aanwezigheid van uniformere ronde ruimten in het kleinere fragment.
10X
Atypische ductale hyperplasie, Borst FNA, Celblok.
Dit plaatje van de naaldspoeling van de patiënt in afbeelding 15 toont een uniforme populatie van vrijelijk stratificerende ductale cellen met een uniforme spreiding van kernen, afwezigheid van een stromingspatroon en de aanwezigheid van uniformere ronde ruimten in het kleinere fragment.
10X
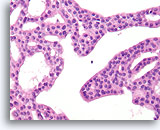
Atypische ductale hyperplasie, Borst FNA, Celblok.
Let op de gelijkvormigheid van de cellen (dit duidt op een afwezigheid van myoepitheliale cellen) en de uniforme spreiding van cellen zonder gedeelde polariteit.
40X
Atypische ductale hyperplasie, Borst FNA, Celblok.
Let op de gelijkvormigheid van de cellen (dit duidt op een afwezigheid van myoepitheliale cellen) en de uniforme spreiding van cellen zonder gedeelde polariteit.
40X
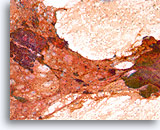
Proliferatieve ductale laesie, Papillair neoplasma vs fibroadenoom, Borst FNA, Directe uitstrijk.
De cellulaire details worden gedeeltelijk geblokkeerd door bloed, maar een grote groep proliferatieve ductale cellen kunnen aan de linkerkant worden waargenomen. Aan de rechterkant bevindt zich een stromaal fragment met ronde randen.
10X
Proliferatieve ductale laesie, Papillair neoplasma vs fibroadenoom, Borst FNA, Directe uitstrijk.
De cellulaire details worden gedeeltelijk geblokkeerd door bloed, maar een grote groep proliferatieve ductale cellen kunnen aan de linkerkant worden waargenomen. Aan de rechterkant bevindt zich een stromaal fragment met ronde randen.
10X
PAPILLOOM
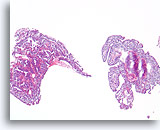
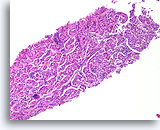
Papilloom, Borst FNA, Celblok.
Deze afbeelding van dezelfde FNA als in afbeelding 18 bevat een duidelijk papillaire architectuur.
10X
Papilloom, Borst FNA, Celblok.
Deze afbeelding van dezelfde FNA als in afbeelding 18 bevat een duidelijk papillaire architectuur.
10X
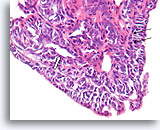
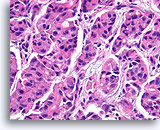
Papilloom, Borst FNA, Celblok.
Met een sterkere vergroting kan een gemengde celpopulatie gezien worden die het oppervlak en de onderliggende melkgangen bekleden. Een rij myoepitheliale cellen is zichtbaar tussen de ductale cellen en het onderliggende stroma (pijl). Let op de spleetachtige ruimte die kenmerkend is voor typische hyperplasie (open pijl).
40X
Papilloom, Borst FNA, Celblok.
Met een sterkere vergroting kan een gemengde celpopulatie gezien worden die het oppervlak en de onderliggende melkgangen bekleden. Een rij myoepitheliale cellen is zichtbaar tussen de ductale cellen en het onderliggende stroma (pijl). Let op de spleetachtige ruimte die kenmerkend is voor typische hyperplasie (open pijl).
40X
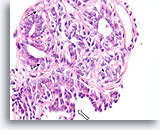
Papilloom, Borst FNA, Celblok.
Let op de bijmenging van bleke myoepitheliale cellen (pijlen) en de rijping van de ductale cellen wanneer zij zich verder van het basaalmembraan stratificeren (open pijl).
40X
Papilloom, Borst FNA, Celblok.
Let op de bijmenging van bleke myoepitheliale cellen (pijlen) en de rijping van de ductale cellen wanneer zij zich verder van het basaalmembraan stratificeren (open pijl).
40X

Papilloom, Borst FNA, ThinPrep®.
Wanneer fibrovasculaire kernen van ductale cellen worden ontdaan, is de papillaire aard van de laesie duidelijk zichtbaar. Let op het gladde oppervlak van de stromale kernen; dit duidt erop dat het stromale collageen is neergelegd in samenwerking met een overliggende populatie van epitheelcellen. Als de stromale oppervlakken ruw zijn, is het soms niet mogelijk om een papillair neoplasma met zekerheid in een cytologisch preparaat te diagnosticeren.
40X
Papilloom, Borst FNA, ThinPrep®.
Wanneer fibrovasculaire kernen van ductale cellen worden ontdaan, is de papillaire aard van de laesie duidelijk zichtbaar. Let op het gladde oppervlak van de stromale kernen; dit duidt erop dat het stromale collageen is neergelegd in samenwerking met een overliggende populatie van epitheelcellen. Als de stromale oppervlakken ruw zijn, is het soms niet mogelijk om een papillair neoplasma met zekerheid in een cytologisch preparaat te diagnosticeren.
40X
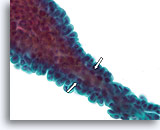
Papilloom, Borst FNA, ThinPrep®.
Als de papillen dun zijn, kunnen fibrovasculaire kernen worden geïdentificeerd in cytologische preparaten. Als de overliggende ductale cellen niet te gestratificeerd zijn, kunnen myoepitheliale cellen mogelijk onder de ductale cellen worden geïdentificeerd (open pijlen), hetgeen pleit voor de diagnose van een papilloom in plaats van een papillair carcinoom.
60X
Papilloom, Borst FNA, ThinPrep®.
Als de papillen dun zijn, kunnen fibrovasculaire kernen worden geïdentificeerd in cytologische preparaten. Als de overliggende ductale cellen niet te gestratificeerd zijn, kunnen myoepitheliale cellen mogelijk onder de ductale cellen worden geïdentificeerd (open pijlen), hetgeen pleit voor de diagnose van een papilloom in plaats van een papillair carcinoom.
60X
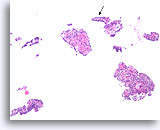
Papilloom, Borst FNA, Celblok.
Dit plaatje van de patiënt in afbeelding 23 vertoont een duidelijke papillaire architectuur. De dunne papillaire bladeren bij de pijl hebben ongeveer dezelfde afmeting als het blad in de vorige afbeelding.
10X
Papilloom, Borst FNA, Celblok.
Dit plaatje van de patiënt in afbeelding 23 vertoont een duidelijke papillaire architectuur. De dunne papillaire bladeren bij de pijl hebben ongeveer dezelfde afmeting als het blad in de vorige afbeelding.
10X
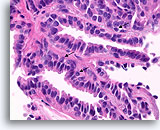
Papilloom, Borst FNA, Celblok.
Door histologische coupes te maken, kunnen de samenstelling, architectuur en cytologische kenmerken van de grotere papillaire fragmenten bestudeerd worden. Myoepitheliale cellen zijn duidelijk aanwezig (pijlen) en en wordt geen stratificatie van de ductale cellen waargenomen.
60X
Papilloom, Borst FNA, Celblok.
Door histologische coupes te maken, kunnen de samenstelling, architectuur en cytologische kenmerken van de grotere papillaire fragmenten bestudeerd worden. Myoepitheliale cellen zijn duidelijk aanwezig (pijlen) en en wordt geen stratificatie van de ductale cellen waargenomen.
60X
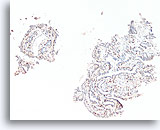
Papilloom, Borst FNA, Celblok.
Immunokleuring met p63 van de coupes van de patiënt in afbeelding 23-25 helpt de myoepitheliale cellen te markeren die door deze papilloom verstrooid zijn.
10X
Papilloom, Borst FNA, Celblok.
Immunokleuring met p63 van de coupes van de patiënt in afbeelding 23-25 helpt de myoepitheliale cellen te markeren die door deze papilloom verstrooid zijn.
10X
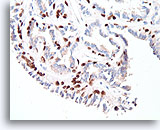
Papilloom, Borst FNA, Celblok.
De myoepitheliale cellen vormen nagenoeg continue rijen onder de ductale cellen (immunokleuring met p63).
40X
Papilloom, Borst FNA, Celblok.
De myoepitheliale cellen vormen nagenoeg continue rijen onder de ductale cellen (immunokleuring met p63).
40X
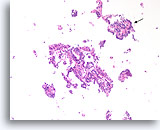
Papilloom, Borst FNA, Celblok.
Discohesieve losse cellen zijn aanwezig in de achtergrond; dit kan een zorgwekkend kenmerk zijn van papillaire neoplasmen. Een kenmerk dat bij deze kleine vergroting pleit voor papilloom in plaats van een papillair carcinoom is het afwijkende uiterlijk van de ductale cellen in verschillende gebieden. Let op de compacte donkere ductale cellen in het bovenste fragment (pijl) vergeleken met de enigszins blekere ductale cellen in het grotere fragment. Papillaire carcinomen zien er vaak veel uniformer uit.
10X
Papilloom, Borst FNA, Celblok.
Discohesieve losse cellen zijn aanwezig in de achtergrond; dit kan een zorgwekkend kenmerk zijn van papillaire neoplasmen. Een kenmerk dat bij deze kleine vergroting pleit voor papilloom in plaats van een papillair carcinoom is het afwijkende uiterlijk van de ductale cellen in verschillende gebieden. Let op de compacte donkere ductale cellen in het bovenste fragment (pijl) vergeleken met de enigszins blekere ductale cellen in het grotere fragment. Papillaire carcinomen zien er vaak veel uniformer uit.
10X
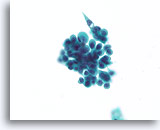
Proliferatieve veranderingen in papilloom, Borst FNA, ThinPrep®.
Naast discohesie vertonen papillomen vaak een zorgwekkende stratificatie. In dit geval is het wasachtige plaveiselachtige cytoplasma een aanwijzing om de diagnose papilloom te stellen (niet zoals het korrelige apocriene metaplastische cytoplasma).
60X
Proliferatieve veranderingen in papilloom, Borst FNA, ThinPrep®.
Naast discohesie vertonen papillomen vaak een zorgwekkende stratificatie. In dit geval is het wasachtige plaveiselachtige cytoplasma een aanwijzing om de diagnose papilloom te stellen (niet zoals het korrelige apocriene metaplastische cytoplasma).
60X
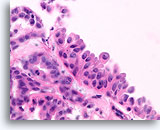
Papilloom, Borst FNA, Celblok.
Een histologische coupe van een groter fragment toont de oorsprong van de stratificerende ductale cellen met squameuze veranderingen.
60X
Papilloom, Borst FNA, Celblok.
Een histologische coupe van een groter fragment toont de oorsprong van de stratificerende ductale cellen met squameuze veranderingen.
60X
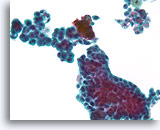
Proliferatieve veranderingen in papilloom, Borst FNA, ThinPrep®.
De stratificatie, verlies aan polariteit en enigszins atypische kernen kunnen in sommige papillomen duidelijk waarneembaar zijn. Voor de diagnose is het belangrijk dat u de grootschalige architectuur van de fragmenten ziet, maar dit is moeilijk in cytologische preparaten.
40X
Proliferatieve veranderingen in papilloom, Borst FNA, ThinPrep®.
De stratificatie, verlies aan polariteit en enigszins atypische kernen kunnen in sommige papillomen duidelijk waarneembaar zijn. Voor de diagnose is het belangrijk dat u de grootschalige architectuur van de fragmenten ziet, maar dit is moeilijk in cytologische preparaten.
40X
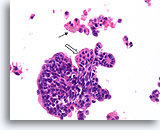
Papilloom, Borst FNA, Celblok.
Een histologische coupe van de FNA van afbeelding 31 toont een vergelijkbaar fragment met discohesieve cellen in de achtergrond. De aanwezigheid van hemosiderine in macrofagen (pijl) is een belangrijke aanwijzing voor de papillaire aard van deze laesie. Let op het benigne stromingspatroon van de ductale cellen. Er is spraken van een focale squameuze verandering (open pijl).
40X
Papilloom, Borst FNA, Celblok.
Een histologische coupe van de FNA van afbeelding 31 toont een vergelijkbaar fragment met discohesieve cellen in de achtergrond. De aanwezigheid van hemosiderine in macrofagen (pijl) is een belangrijke aanwijzing voor de papillaire aard van deze laesie. Let op het benigne stromingspatroon van de ductale cellen. Er is spraken van een focale squameuze verandering (open pijl).
40X
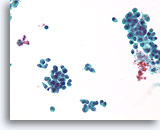
Proliferatieve veranderingen in een papilloom, Borst FNA, ThinPrep®.
De discohesie van de ductale cellen in een papilloom kunnen alarmerend zijn.
40X
Proliferatieve veranderingen in een papilloom, Borst FNA, ThinPrep®.
De discohesie van de ductale cellen in een papilloom kunnen alarmerend zijn.
40X
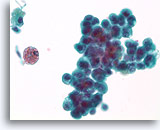
Proliferatieve veranderingen en cytologische atypie in papilloom, Borst FNA, ThinPrep®.
Atypische kernen kunnen tamelijk opvallend zijn bij papillomen, met name in gebieden met squameuze veranderingen. Atypische kernen zijn op zichzelf geen betrouwbaar middel om papillomen te onderscheiden van papillaire carcinomen. Een belangrijke aanwijzing voor de papillaire aard van deze proliferatie is de hemosiderine en het squameuze cytoplasma.
60X
Proliferatieve veranderingen en cytologische atypie in papilloom, Borst FNA, ThinPrep ®.
Atypische kernen kunnen tamelijk opvallend zijn bij papillomen, met name in gebieden met squameuze veranderingen. Atypische kernen zijn op zichzelf geen betrouwbaar middel om papillomen te onderscheiden van papillaire carcinomen. Een belangrijke aanwijzing voor de papillaire aard van deze proliferatie is de hemosiderine en het squameuze cytoplasma.
60X
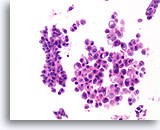
Papilloom, Borst FNA, Celblok.
De discohesieve en cytologisch atypische aard van de populatie in afbeelding 34 kan worden waargenomen in de overeenkomstige celblokcoupe. De variabiliteit tussen de twee grootste groepen ductale cellen pleit voor een benigne diagnose.
40X
Papilloom, Borst FNA, Celblok.
De discohesieve en cytologisch atypische aard van de populatie in afbeelding 34 kan worden waargenomen in de overeenkomstige celblokcoupe. De variabiliteit tussen de twee grootste groepen ductale cellen pleit voor een benigne diagnose.
40X
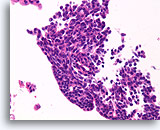
Papilloom, Borst FNA, Celblok.
Papilloom, borst FNA, celblok.
Het stromingspatroon dat duidelijk aanwezig is in andere gebieden van de FNA in afbeelding 35, pleit sterk voor een papilloom in plaats van een papillair carcinoom.
40X
Papilloom, Borst FNA, Celblok.
Papilloom, borst FNA, celblok.
Het stromingspatroon dat duidelijk aanwezig is in andere gebieden van de FNA in afbeelding 35, pleit sterk voor een papilloom in plaats van een papillair carcinoom.
40X
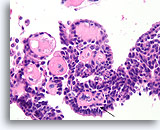
Papilloom, Borst FNA, Celblok.
Fibrovasculaire kernen kunnen gemakkelijk worden waargenomen in dit gebied van het celblok van dezelfde patiënt die in afbeelding 33-36 wordt getoond. Let op de lijn van myoepitheliale cellen (pijl).
40X
Papilloom, Borst FNA, Celblok.
Fibrovasculaire kernen kunnen gemakkelijk worden waargenomen in dit gebied van het celblok van dezelfde patiënt die in afbeelding 33-36 wordt getoond. Let op de lijn van myoepitheliale cellen (pijl).
40X
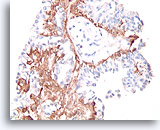
Papilloom, Borst FNA, Celblok.
Met een immunokleuring met calponine kunt u de myoepitheliale celpopulatie onder de ductale cellen gemakkelijk zien.
40X
Papilloom, Borst FNA, Celblok.
Met een immunokleuring met calponine kunt u de myoepitheliale celpopulatie onder de ductale cellen gemakkelijk zien.
40X
Papillair carcinoom
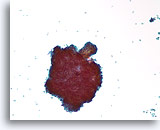
Papillair neoplasma, Borst FNA, ThinPrep®.
Verspreide losse ductale cellen en een grote cluster met een fibrovasculaire steel zijn zichtbaar.
10X
Papillair neoplasma, Borst FNA, ThinPrep®.
Verspreide losse ductale cellen en een grote cluster met een fibrovasculaire steel zijn zichtbaar.
10X
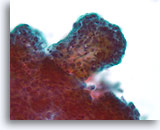
Papillair neoplasma, Borst FNA, ThinPrep®.
Een sterkere vergroting toont de fibrovasculaire steel, maar het is moeilijk om de architecturele kenmerken van de ductale cellen links onderin dit dikke fragment te zien.
40X
Papillair neoplasma, Borst FNA, ThinPrep®.
Een sterkere vergroting toont de fibrovasculaire steel, maar het is moeilijk om de architecturele kenmerken van de ductale cellen links onderin dit dikke fragment te zien.
40X
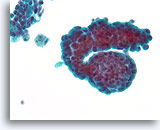
Papillair neoplasma, Borst FNA, ThinPrep®.
Deze groep ductale cellen vertoont duidelijke proliferatieve veranderingen met stratificatie. Twee macrofagen met een spoor van hemosiderine zijn een aanwijzing voor de aanwezigheid van een papillair neoplasma.
40X
Papillair neoplasma, Borst FNA, ThinPrep®.
Deze groep ductale cellen vertoont duidelijke proliferatieve veranderingen met stratificatie. Twee macrofagen met een spoor van hemosiderine zijn een aanwijzing voor de aanwezigheid van een papillair neoplasma.
40X
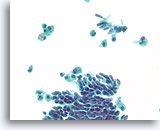
Papillair neoplasma, Borst FNA, ThinPrep®.
Cilindervormige veranderingen en macrofagen met hemosiderine zijn een aanwijzing voor de diagnose van een papillair neoplasma/ Cilindervormige veranderingen kunnen de foutieve indruk geven van een benigne stromingspatroon.
40X
Papillair neoplasma, Borst FNA, ThinPrep®.
Cilindervormige veranderingen en macrofagen met hemosiderine zijn een aanwijzing voor de diagnose van een papillair neoplasma/ Cilindervormige veranderingen kunnen de foutieve indruk geven van een benigne stromingspatroon.
40X
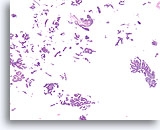
Papillair neoplasma, Borst FNA, Celblok.
Een kleine vergroting van de residuele naaldspoeling van de patiënt in afbeelding 39-42 toont een duidelijk papillaire architectuur. Let op de gelijksoortigheid van de ductale populatie in dit hele veld. Dit monotone patroon duidt meer op een papillair carcinoom dan een papilloom.
40X
Papillair neoplasma, Borst FNA, Celblok.
Een kleine vergroting van de residuele naaldspoeling van de patiënt in afbeelding 39-42 toont een duidelijk papillaire architectuur. Let op de gelijksoortigheid van de ductale populatie in dit hele veld. Dit monotone patroon duidt meer op een papillair carcinoom dan een papilloom.
40X
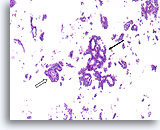
Papillair carcinoom, Borst FNA, Celblok.
Sterkere vergroting van de patiënt uit afbeelding 39-43 toont een fibrovasculaire kern (open pijl) en een cribriform gebied dat consistent is met een papillair carcinoom (pijl).
10X
Papillair carcinoom, Borst FNA, Celblok.
Sterkere vergroting van de patiënt uit afbeelding 39-43 toont een fibrovasculaire kern (open pijl) en een cribriform gebied dat consistent is met een papillair carcinoom (pijl).
10X
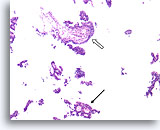
Papillair carcinoom, Borst FNA, Celblok.
Een ander cribriform gebied (pijl) en een fibrovasculaire kern (open pijl) kunnen gemakkelijk worden onderscheiden.
10X
Papillair carcinoom, Borst FNA, Celblok.
Een ander cribriform gebied (pijl) en een fibrovasculaire kern (open pijl) kunnen gemakkelijk worden onderscheiden.
10X
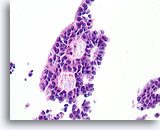
Papillair carcinoom, Borst FNA, Celblok.
Een sterkere vergroting van het diagnostische cribriforme patroon in afbeelding 45 toont een monotone celpopulatie met gerandomiseerde polariteit die gladde, ronde ruimten vormt. Necrotisch materiaal is focaal aanwezig in één lumen.
40X
Papillair carcinoom, Borst FNA, Celblok.
Een sterkere vergroting van het diagnostische cribriforme patroon in afbeelding 45 toont een monotone celpopulatie met gerandomiseerde polariteit die gladde, ronde ruimten vormt. Necrotisch materiaal is focaal aanwezig in één lumen.
40X
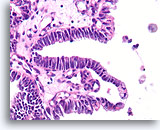
Papillair carcinoom, Borst FNA, Celblok.
In sommige gebieden vertoont het papillaire carcinoom geen stratificatie met een afwezigheid van myoepitheliale cellen.
40X
Papillair carcinoom, Borst FNA, Celblok.
In sommige gebieden vertoont het papillaire carcinoom geen stratificatie met een afwezigheid van myoepitheliale cellen.
40X
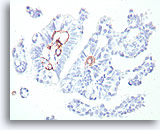
Papillair carcinoom, Borst FNA, Celblok.
Deze kleuring met gladde spier-actine toont enige stromale myofibroblasten, maar geen myoepitheliale cellen buiten de grenzen van het basaalmembraan van de fibrovasculaire kernen in het papillaire carcinoom dat wordt afgebeeld in afbeelding 39-47.
40X
Papillair carcinoom, Borst FNA, Celblok.
Deze kleuring met gladde spier-actine toont enige stromale myofibroblasten, maar geen myoepitheliale cellen buiten de grenzen van het basaalmembraan van de fibrovasculaire kernen in het papillaire carcinoom dat wordt afgebeeld in afbeelding 39-47.
40X
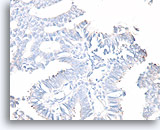
Papillair carcinoom, Borst FNA, Celblok.
Een kleuring met calponine voor myoepitheliale cellen is vaak gemakkelijker te interpreteren dat een immunokleuring met gladde spier-actine. Dezelfde patiënt als in afbeelding 48 toont geen myoepitheliale cellen.
40X
Papillair carcinoom, Borst FNA, Celblok.
Een kleuring met calponine voor myoepitheliale cellen is vaak gemakkelijker te interpreteren dat een immunokleuring met gladde spier-actine. Dezelfde patiënt als in afbeelding 48 toont geen myoepitheliale cellen.
40X
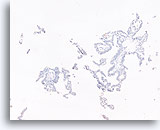
Papillair carcinoom, Borst FNA, Celblok.
Een immunokleuring met p63 voor myoepitheliale cellen is ook negatief bij de patiënt die in voorgaande afbeeldingen getoond is; dit steunt de diagnose van papillair carcinoom.
10X
Papillair carcinoom, Borst FNA, Celblok.
Een immunokleuring met p63 voor myoepitheliale cellen is ook negatief bij de patiënt die in voorgaande afbeeldingen getoond is; dit steunt de diagnose van papillair carcinoom.
10X
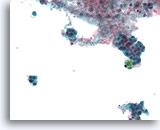
Papillair neoplasma, Borst FNA, ThinPrep®.
Een andere FNA uit de vorige serie toont discohesieve ductale cellen met proliferatieve veranderingen en hemosiderine.
40X
Papillair neoplasma, Borst FNA, ThinPrep®.
Een andere FNA uit de vorige serie toont discohesieve ductale cellen met proliferatieve veranderingen en hemosiderine.
40X
Papillair neoplasma, Borst FNA, ThinPrep®.
Er zijn duidelijke proliferatieve veranderingen aanwezig. Een fibrovasculaire kern kan met moeite worden onderscheiden.
40X
Papillair neoplasma, Borst FNA, ThinPrep®.
Er zijn duidelijke proliferatieve veranderingen aanwezig. Een fibrovasculaire kern kan met moeite worden onderscheiden.
40X
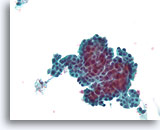
Papillair carcinoom, Borst FNA, Celblok.
Een kleine versterking van het ThinPrep® in afbeelding 51-52 toont een duidelijke papillaire configuratie met een monotone stratificerende populatie.
10X
Papillair carcinoom, Borst FNA, Celblok.
Een kleine versterking van het ThinPrep® in afbeelding 51-52 toont een duidelijke papillaire configuratie met een monotone stratificerende populatie.
10X
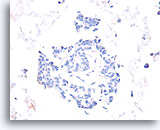
Papillair carcinoom, Borst FNA, Celblok.
De afwezigheid van een immunokleuring met calponine duidt op een diagnose van een papillair carcinoom.
40X
Papillair carcinoom, Borst FNA, Celblok.
De afwezigheid van een immunokleuring met calponine duidt op een diagnose van een papillair carcinoom.
40X
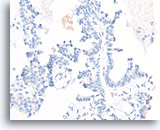
Papillair carcinoom, Borst FNA, Celblok.
De afwezigheid van kleuring met p63 helpt een papilloom uit te sluiten.
40X
Papillair carcinoom, Borst FNA, Celblok.
De afwezigheid van kleuring met p63 helpt een papilloom uit te sluiten.
40X
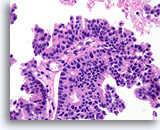
Papillair carcinoom, Borst FNA, Celblok.
De papillaire kern is bekleed met vrij stratificerende ductale cellen en er zijn geen myoepitheliale cellen.
40X
Papillair carcinoom, Borst FNA, Celblok.
De papillaire kern is bekleed met vrij stratificerende ductale cellen en er zijn geen myoepitheliale cellen.
40X
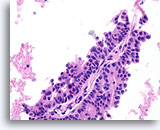
Papillair carcinoom, Borst FNA, Celblok.
Let op de afwezigheid van myoepitheliale cellen in het epitheel dat de fibrovasculaire kern bedekt.
40X
Papillair carcinoom, Borst FNA, Celblok.
Let op de afwezigheid van myoepitheliale cellen in het epitheel dat de fibrovasculaire kern bedekt.
40X
Fibroadenoom
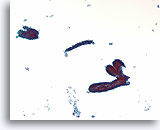
Fibroadenoom, Borst FNA, ThinPrep®.
De ductale cellen zijn geordend in een ‘hertshoornvaren’ of een configuratie van stompe, vertakte gangen. Verspreide naakte myoepitheliale cellen kunnen net in de achtergrond worden onderscheiden.
10X
Fibroadenoom, Borst FNA, ThinPrep®.
De ductale cellen zijn geordend in een ‘hertshoornvaren’ of een configuratie van stompe, vertakte gangen. Verspreide naakte myoepitheliale cellen kunnen net in de achtergrond worden onderscheiden.
10X
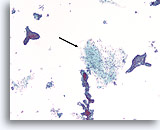
Fibroadenoom, Borst FNA, ThinPrep®.
Identificatie van stromale weefselfragmenten is belangrijk voor een definitieve diagnose van fibroadenoom (pijl).
10X
Fibroadenoom, Borst FNA, ThinPrep®.
Identificatie van stromale weefselfragmenten is belangrijk voor een definitieve diagnose van fibroadenoom (pijl).
10X
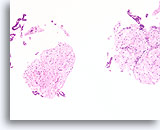
Fibroadenoom, Borst FNA, celblok.
Kenmerkende fibromyxoïde stroma is aanwezig met benigne ductale cellen.
10X
Fibroadenoom, Borst FNA, celblok.
Kenmerkende fibromyxoïde stroma is aanwezig met benigne ductale cellen.
10X
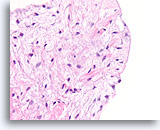
Fibroadenoom, Borst FNA, celblok.
Let op het gladde oppervlak van dit naakte fibromxyoïde stromale fragment en de eentonige morfologie van de mesenchymale kernen.
40X
Fibroadenoom, Borst FNA, celblok.
Let op het gladde oppervlak van dit naakte fibromxyoïde stromale fragment en de eentonige morfologie van de mesenchymale kernen.
40X
Phyllodes tumor
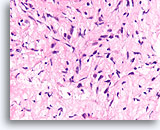
Phyllodes tumor, Borst FNA, Celblok.
Vergelijk de cellulariteit en variabele hyperchromasie van de fibroblasten in deze laesie met de uniforme fibroblasten van het fibroadenoom. Aangezien phyllodes tumoren stromale overgroei hebben, komt het minder vaak voor dat gladde oppervlakken worden gevormd door de relatief spaarzame epitheliale component van dit tumortype.
40X
Phyllodes tumor, Borst FNA, Celblok.
Vergelijk de cellulariteit en variabele hyperchromasie van de fibroblasten in deze laesie met de uniforme fibroblasten van het fibroadenoom. Aangezien phyllodes tumoren stromale overgroei hebben, komt het minder vaak voor dat gladde oppervlakken worden gevormd door de relatief spaarzame epitheliale component van dit tumortype.
40X
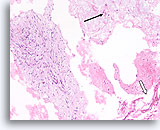
Phyllodes tumor, Borst FNA, Celblok.
Deze coupe toont een dunne mucoide achtergrond met afzonderlijke mesenchymale cellen (pijl), grote stukken losgescheurd atypisch stromaal weefsel (links) en enkele brede stroken afgeplatte ductale cellen (open pijl).
10X
Phyllodes tumor, Borst FNA, Celblok.
Deze coupe toont een dunne mucoide achtergrond met afzonderlijke mesenchymale cellen (pijl), grote stukken losgescheurd atypisch stromaal weefsel (links) en enkele brede stroken afgeplatte ductale cellen (open pijl).
10X
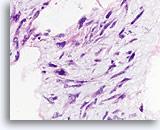
Phyllodes tumor, Borst FNA, Celblok.
Atypische kernen zijn duidelijk aanwezig in dit losgescheurde fibromyxoïde gebied.
60X
Phyllodes tumor, Borst FNA, Celblok.
Atypische kernen zijn duidelijk aanwezig in dit losgescheurde fibromyxoïde gebied.
60X
Ductaal carcinoom
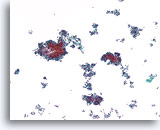
Ductaal carcinoom, Borst FNA, ThinPrep®.
Een cellulaire, discohesieve, monotone ductale celpopulatie met stratificatie van de kernen is aanwezig.
10X
Ductaal carcinoom, Borst FNA, ThinPrep®.
Een cellulaire, discohesieve, monotone ductale celpopulatie met stratificatie van de kernen is aanwezig.
10X
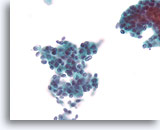
Ductaal carcinoom, Borst FNA, ThinPrep®.
Bij een sterkere vergroting kunnen gerandomiseerde polariteit en mild nucleair pleomorfisme duidelijk worden waargenomen.
40X
Ductaal carcinoom, Borst FNA, ThinPrep®.
Bij een sterkere vergroting kunnen gerandomiseerde polariteit en mild nucleair pleomorfisme duidelijk worden waargenomen.
40X
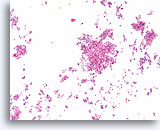
Ductaal carcinoom, Borst FNA, Celblok.
Kleine vergroting van de patiënt in afbeelding 65-66 toont de discohesieve monotone ductale celpopulatie met gerandomiseerde polariteit en een solide groeipatroon.
10X
Ductaal carcinoom, Borst FNA, Celblok.
Kleine vergroting van de patiënt in afbeelding 65-66 toont de discohesieve monotone ductale celpopulatie met gerandomiseerde polariteit en een solide groeipatroon.
10X
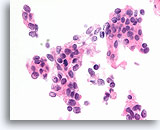
Ductaal carcinoom, Borst FNA, Celblok.
Er is duidelijk gerandomiseerde polariteit van een cytologisch atypische en vrijelijk stratificerende populatie ductale cellen aanwezig.
60X
Ductaal carcinoom, Borst FNA, Celblok.
Er is duidelijk gerandomiseerde polariteit van een cytologisch atypische en vrijelijk stratificerende populatie ductale cellen aanwezig.
60X
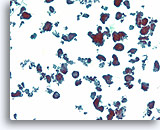
Ductaal carcinoom, Borst FNA, ThinPrep®.
Ductale cellen vormen een verscheidenheid aan losgekomen micropapillaire en holle clusters.
10X
Ductaal carcinoom, Borst FNA, ThinPrep®.
Ductale cellen vormen een verscheidenheid aan losgekomen micropapillaire en holle clusters.
10X
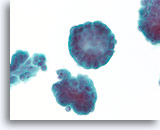
Ductaal carcinoom, Borst FNA, ThinPrep®.
Bij een sterkere vergroting kunnen de stratificatie van de ductale cellen, random polariteit, milde nucleaire atypie en afwezigheid van een duidelijke myoepitheliale populatie worden waargenomen.
60X
Ductaal carcinoom, Borst FNA, ThinPrep®.
Bij een sterkere vergroting kunnen de stratificatie van de ductale cellen, random polariteit, milde nucleaire atypie en afwezigheid van een duidelijke myoepitheliale populatie worden waargenomen.
60X
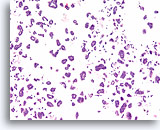
Ductaal carcinoom, Borst FNA, Celblok.
Een overeenkomstige weefselcoupe toont de micropapillaire (solide) en holle glandulaire groepen, met afzonderlijke cellen in de achtergrond.
10X
Ductaal carcinoom, Borst FNA, Celblok.
Een overeenkomstige weefselcoupe toont de micropapillaire (solide) en holle glandulaire groepen, met afzonderlijke cellen in de achtergrond.
10X
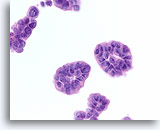
Ductaal carcinoom, Borst FNA, Celblok.
De weefselcoupe van een soortgelijk veld als het veld in afbeelding 70 wordt afgebeeld.
60X
Ductaal carcinoom, Borst FNA, Celblok.
De weefselcoupe van een soortgelijk veld als het veld in afbeelding 70 wordt afgebeeld.
60X
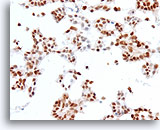
Ductaal carcinoom, Borst FNA, Celblok.
Positieve oestrogeenreceptoren zijn aanwezig in ongeveer 90% van de tumorcellen.
40X
Ductaal carcinoom, Borst FNA, Celblok.
Positieve oestrogeenreceptoren zijn aanwezig in ongeveer 90% van de tumorcellen.
40X
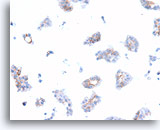
Ductaal carcinoom, Borst FNA, Celblok.
Dako HerceptTest-immunokleuring voor Her2/Neu toont 1+ positiviteit in de patiënt in afbeelding 69-73.
40X
Ductaal carcinoom, Borst FNA, Celblok.
Dako HerceptTest-immunokleuring voor Her2/Neu toont 1+ positiviteit in de patiënt in afbeelding 69-73.
40X
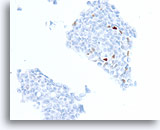
Ductaal carcinoom, Borst FNA, Celblok.
In een andere patiënt heeft ongeveer 3% van de cellen positieve kleuring voor progesteronreceptors.
40X
Ductaal carcinoom, Borst FNA, Celblok.
In een andere patiënt heeft ongeveer 3% van de cellen positieve kleuring voor progesteronreceptors.
40X
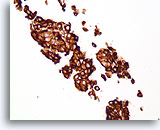
Ductaal carcinoom, Borst FNA, Celblok.
Dako HerceptTest-immunokleuring voor Her2/Neu toont 3+ kleuring. Verdere kleuring met behulp van fluorescentie in situ hybridisatie toont geamplificeerde Her2/neu.
40X
Ductaal carcinoom, Borst FNA, Celblok.
Dako HerceptTest-immunokleuring voor Her2/Neu toont 3+ kleuring. Verdere kleuring met behulp van fluorescentie in situ hybridisatie toont geamplificeerde Her2/neu.
40X
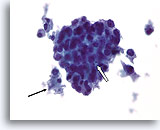
Ductaal carcinoom, Mannenborst FNA, ThinPrep®.
Hoewel gynecomastie uitgebreide proliferatieve veranderingen kan vertonen, zijn de aanwezigheid van focale necrose (pijl) en apoptotische cellen (open pijl), beduidende atypie en discohesie zeer verontrustend.
60X
Ductaal carcinoom, Mannenborst FNA, ThinPrep®.
Hoewel gynecomastie uitgebreide proliferatieve veranderingen kan vertonen, zijn de aanwezigheid van focale necrose (pijl) en apoptotische cellen (open pijl), beduidende atypie en discohesie zeer verontrustend.
60X
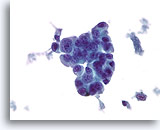
Ductaal carcinoom, Mannenborst FNA, ThinPrep®.
Beduidende atypie en stratificatie is meer dan in gynecomastie wordt verwacht.
60x
Ductaal carcinoom, Mannenborst FNA, ThinPrep®.
Beduidende atypie en stratificatie is meer dan in gynecomastie wordt verwacht.
60x
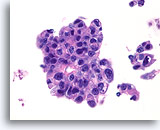
Ductaal carcinoom, Mannenborst FNA, celblok.
Hooggradige nucleaire atypie, necrotisch materiaal, discohesie en vrije stratificatie kunnen worden waargenomen.
60X
Ductaal carcinoom, Mannenborst FNA, celblok.
Hooggradige nucleaire atypie, necrotisch materiaal, discohesie en vrije stratificatie kunnen worden waargenomen.
60X
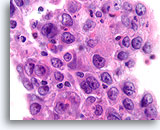
Ductaal carcinoom, Mannenborst FNA, celblok.
Apoptotische fragmenten, necrotisch materiaal, discohesie, vrije stratificatie en hooggradige nucleaire atypie kunnen duidelijk worden waargenomen.
60X
Ductaal carcinoom, Mannenborst FNA, celblok.
Apoptotische fragmenten, necrotisch materiaal, discohesie, vrije stratificatie en hooggradige nucleaire atypie kunnen duidelijk worden waargenomen.
60X
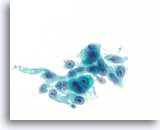
Ductaal carcinoom, Borst FNA, ThinPrep®.
Aanzienolijke nucleaire atypie, stratificatie en verstoorde polariteit zijn aanwezig.
60X
Ductaal carcinoom, Borst FNA, ThinPrep®.
Aanzienolijke nucleaire atypie, stratificatie en verstoorde polariteit zijn aanwezig.
60X
Ductaal carcinoom, Borst FNA, ThinPrep®.
Er is duidelijk sprake van pleomorfisme.
60X
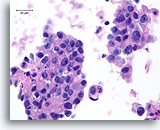
Ductaal carcinoom, Borst FNA, Celblok.
Deze coupe van dezelfde patiënt als in afbeelding 81-82 toont discohesieve ductale populatie met kernen van hoge kwaliteit.
100X
Ductaal carcinoom, Borst FNA, Celblok.
Deze coupe van dezelfde patiënt als in afbeelding 81-82 toont discohesieve ductale populatie met kernen van hoge kwaliteit.
100X
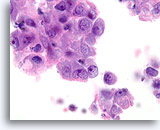
Ductaal carcinoom, Borst FNA, Celblok.
Lymfocyten zijn in dit hooggradige ductale carcinoom bijgemengd.
100X
Ductaal carcinoom, Borst FNA, Celblok.
Lymfocyten zijn in dit hooggradige ductale carcinoom bijgemengd.
100X
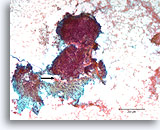
Borstcarcinoom, Borst FNA, Directe uitstrijk.
In het onderste deel is een gebied met desmoplastisch uitziend stroma aanwezig met een onregelmatige contour van overliggende maligne cellen (pijl). Hoewel verdacht voor invasiviteit kan dit vaak in cytologische preparaten niet met zekerheid worden gediagnosticeerd.
10X
Borstcarcinoom, Borst FNA, Directe uitstrijk.
In het onderste deel is een gebied met desmoplastisch uitziend stroma aanwezig met een onregelmatige contour van overliggende maligne cellen (pijl). Hoewel verdacht voor invasiviteit kan dit vaak in cytologische preparaten niet met zekerheid worden gediagnosticeerd.
10X
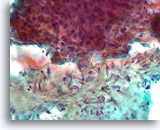
Borstcarcinoom, Borst FNA, Directe uitstrijk.
U ziet een sterkere vergroting van het onregelmatige raakvlak tussen de ductale cellen en het geactiveerde stromaweefsel. Het is niet duidelijk of de ductale cellen eenvoudig tegen het stromaweefsel zijn opgeduwd.
40X
Borstcarcinoom, Borst FNA, Directe uitstrijk.
U ziet een sterkere vergroting van het onregelmatige raakvlak tussen de ductale cellen en het geactiveerde stromaweefsel. Het is niet duidelijk of de ductale cellen eenvoudig tegen het stromaweefsel zijn opgeduwd.
40X
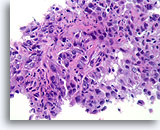
Invasief Ductaal carcinoom, Borst FNA, Celblok.
Met behulp van histologische coupes kunnen in sommige ductale carcinomen invasieve patronen geïdentificeerd worden [4]. Het invasieve patroon bestaat uit ductale cellen die binnen een actieve stroma groeien zonder lobulaire of ductale architectuur. De maligne cellen vertonen geen voorspelbare relatie met stromale referentiepunten en lijken het stroma onder willekeurige hoeken binnen te dringen. De kenmerken van invasiviteit worden in de volgende afbeeldingen geïllustreerd.
40X
Invasief Ductaal carcinoom, Borst FNA, Celblok.
Met behulp van histologische coupes kunnen in sommige ductale carcinomen invasieve patronen geïdentificeerd worden [4]. Het invasieve patroon bestaat uit ductale cellen die binnen een actieve stroma groeien zonder lobulaire of ductale architectuur. De maligne cellen vertonen geen voorspelbare relatie met stromale referentiepunten en lijken het stroma onder willekeurige hoeken binnen te dringen. De kenmerken van invasiviteit worden in de volgende afbeeldingen geïllustreerd.
40X
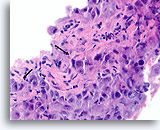
Ductaal carcinoom, Borst FNA, Celblok.
Let op de onregelmatige contour van de solide, smalle strengen met infiltratieve cellen (pijlen).
60X
Ductaal carcinoom, Borst FNA, Celblok.
Let op de onregelmatige contour van de solide, smalle strengen met infiltratieve cellen (pijlen).
60X
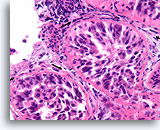
Ductaal carcinoom in situ, Borst FNA, Celblok.
Vergeleken met de onregelmatige, infiltratieve groepen zijn in deze afbeelding de vier profielen van maligne ductale cellen alle omgeven door een glad, dicht, helderroze collageen basaalmembraan. Merk op hoe de fibroblasten net buiten het basaalmembraan zijn georganiseerd met hun lange as parallel aan het basaalmembraan (pijlen). Net als bij kernbiopten van de borst sluit de afwezigheid van invasiviteit in dit ene plaatje geen invasiviteit uit in andere gebieden.
40X
Ductaal carcinoom in situ, Borst FNA, Celblok.
Vergeleken met de onregelmatige, infiltratieve groepen zijn in deze afbeelding de vier profielen van maligne ductale cellen alle omgeven door een glad, dicht, helderroze collageen basaalmembraan. Merk op hoe de fibroblasten net buiten het basaalmembraan zijn georganiseerd met hun lange as parallel aan het basaalmembraan (pijlen). Net als bij kernbiopten van de borst sluit de afwezigheid van invasiviteit in dit ene plaatje geen invasiviteit uit in andere gebieden.
40X
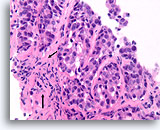
Ductaal carcinoom, Borst FNA, Celblok.
Dit plaatje toont geen normale lobulaire architectuur en de stromale fibroblasten zijn niet goed uitgelijnd met de ductale cellen (pijl). Invasiviteit kan echter niet met zekerheid worden gediagnosticeerd omdat de maligne ductale cellen in dit gebied ronde aggregaten vormen met een gladde, dichte, collagene laag die hen van het stroma scheiden. Soortgelijke patronen kunnen worden waargenomen als een ductaal carcinoom in situ zich uitbreidt tot sceloserende adenose. Een afwezigheid van myoepitheliale cellen volgens IHC kan helpen aantonen dat deze focus invasief is [12].
40x
Ductaal carcinoom, Borst FNA, Celblok.
Dit plaatje toont geen normale lobulaire architectuur en de stromale fibroblasten zijn niet goed uitgelijnd met de ductale cellen (pijl). Invasiviteit kan echter niet met zekerheid worden gediagnosticeerd omdat de maligne ductale cellen in dit gebied ronde aggregaten vormen met een gladde, dichte, collagene laag die hen van het stroma scheiden. Soortgelijke patronen kunnen worden waargenomen als een ductaal carcinoom in situ zich uitbreidt tot sceloserende adenose. Een afwezigheid van myoepitheliale cellen volgens IHC kan helpen aantonen dat deze focus invasief is [12].
40x
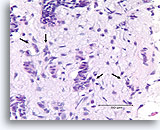
Invasief Ductaal carcinoom, Borst FNA, Celblok.
Eén residuele, vermoedelijk niet-invasieve melkgang kan worden waargenomen uiterst rechtsboven in de afbeelding (open pijl). Invasiviteit kan worden gediagnosticeerd in de andere onregelmatige, solide, dunne clusters met maligne ductale cellen die het geactiveerde stromaweefsel willekeurig doorsnijden (pijlen).
40x
Invasief Ductaal carcinoom, Borst FNA, Celblok.
Eén residuele, vermoedelijk niet-invasieve melkgang kan worden waargenomen uiterst rechtsboven in de afbeelding (open pijl). Invasiviteit kan worden gediagnosticeerd in de andere onregelmatige, solide, dunne clusters met maligne ductale cellen die het geactiveerde stromaweefsel willekeurig doorsnijden (pijlen).
40x
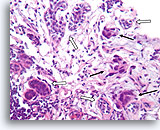
Invasief Ductaal carcinoom, Borst FNA, Celblok.
In dit gebied infiltreren borstkankercellen (pijlen) in enkele natieve melkgangen (open pijlen).
40X
Invasief Ductaal carcinoom, Borst FNA, Celblok.
In dit gebied infiltreren borstkankercellen (pijlen) in enkele natieve melkgangen (open pijlen).
40X
Invasief Ductaal carcinoom, Borst FNA, Celblok.
In deze coupe wordt bijna de hele diameter van een 22 gauge FNA-naald weergegeven. Bij kleine vergroting is een duidelijk infiltratief patroon zichtbaar.
20X
Invasief Ductaal carcinoom, Borst FNA, Celblok.
In deze coupe wordt bijna de hele diameter van een 22 gauge FNA-naald weergegeven. Bij kleine vergroting is een duidelijk infiltratief patroon zichtbaar.
20X
Invasief Ductaal carcinoom, Borst FNA, Celblok.
Onregelmatige strengen ductale cellen penetreren op willekeurige wijze het stromaweefsel.
40X
Invasief Ductaal carcinoom, Borst FNA, Celblok.
Onregelmatige strengen ductale cellen penetreren op willekeurige wijze het stromaweefsel.
40X
Invasief Ductaal carcinoom, Borst FNA, Celblok.
Haarden met ductale cellen zijn tamelijk rond, maar het patroon doet niet denken aan de organisatie van normale, natieve kwabben, zelfs als deze verstoord zijn door scleroserende adenose.
10X
Invasief Ductaal carcinoom, Borst FNA, Celblok.
Haarden met ductale cellen zijn tamelijk rond, maar het patroon doet niet denken aan de organisatie van normale, natieve kwabben, zelfs als deze verstoord zijn door scleroserende adenose.
10X
Invasief Ductaal carcinoom, Borst FNA, Celblok.
Bij een sterkere vergroting wordt geen myoepitheliale populatie waargenomen, hetgeen helpt kolonisatie van scleroserende adenose.uit te sluiten.
40x
Invasief Ductaal carcinoom, Borst FNA, Celblok.
Bij een sterkere vergroting wordt geen myoepitheliale populatie waargenomen, hetgeen helpt kolonisatie van scleroserende adenose.uit te sluiten.
40x
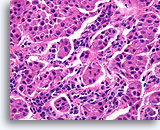
Invasief Ductaal carcinoom, Borst FNA, Celblok.
In andere gebieden van de patiënt in afbeelding 95-99 varieert de vorm van de nesten van brede tot kleine, hoekige aggregaten. Het patroon is te willekeurig voor kolonisatie van scleroserende adenose en er zijn geen basaalmembraan of myoepitheliale cellen waarneembaar.
40x
Invasief Ductaal carcinoom, Borst FNA, Celblok.
In andere gebieden van de patiënt in afbeelding 95-99 varieert de vorm van de nesten van brede tot kleine, hoekige aggregaten. Het patroon is te willekeurig voor kolonisatie van scleroserende adenose en er zijn geen basaalmembraan of myoepitheliale cellen waarneembaar.
40x
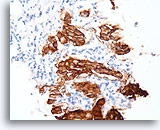
Invasief Ductaal carcinoom, Borst FNA, Celblok.
Dako HercepTest 3+ kleuring voor Her2/Neu wordt waargenomen in de invasieve tumor. Voor sommige toepassingen kan het nodig zijn om positiviteit voor Her2/neu van de invasieve tumor te onderscheiden van die van een in situ component.
40x
Invasief Ductaal carcinoom, Borst FNA, Celblok.
Dako HercepTest 3+ kleuring voor Her2/Neu wordt waargenomen in de invasieve tumor. Voor sommige toepassingen kan het nodig zijn om positiviteit voor Her2/neu van de invasieve tumor te onderscheiden van die van een in situ component.
40x
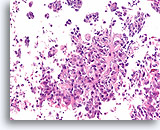
Invasief Ductaal carcinoom, Borst FNA, Celblok.
Invasiviteit is duidelijk in dit hooggradige ductale carcinoom aanwezig.
20X
Invasief Ductaal carcinoom, Borst FNA, Celblok.
Invasiviteit is duidelijk in dit hooggradige ductale carcinoom aanwezig.
20X
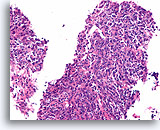
Invasief slecht gedifferentieerd carcinoom, Borst FNA, Celblok.
Dit infiltrerende hooggradige carcinoom heeft een hoge mate van bijmenging van lymfocyten.
20X
Invasief slecht gedifferentieerd carcinoom, Borst FNA, Celblok.
Dit infiltrerende hooggradige carcinoom heeft een hoge mate van bijmenging van lymfocyten.
20X
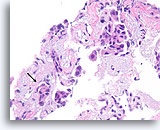
Ductaal carcinoom, Borst FNA, Celblok.
Hoewel gefragmenteerd, kan ten minste één onregelmatig nest met ductale cellen worden waargenomen zonder een duidelijke myoepitheliale laag binnen desmoplastisch stromaweefsel (pijl), hetgeen zeer verdacht is voor invasiviteit.
40x
Ductaal carcinoom, Borst FNA, Celblok.
Hoewel gefragmenteerd, kan ten minste één onregelmatig nest met ductale cellen worden waargenomen zonder een duidelijke myoepitheliale laag binnen desmoplastisch stromaweefsel (pijl), hetgeen zeer verdacht is voor invasiviteit.
40x
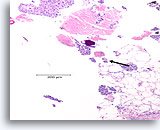
Ductaal carcinoom, Borst FNA, Celblok.
Necrotisch materiaal en microcalcificatie worden geobserveerd (pijl), met losgekomen solide massa’s hooggradige ductale carcinoomcellen. Dit patroon is typerend voor comedocarcinoom in situ. Een gebied met desmoplastisch stroma kan net linksonder worden waargenomen (afgebeeld in afbeelding 103).
10x
Ductaal carcinoom, Borst FNA, Celblok.
Necrotisch materiaal en microcalcificatie worden geobserveerd (pijl), met losgekomen solide massa’s hooggradige ductale carcinoomcellen. Dit patroon is typerend voor comedocarcinoom in situ. Een gebied met desmoplastisch stroma kan net linksonder worden waargenomen (afgebeeld in afbeelding 103).
10x
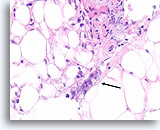
Ductaal carcinoom, Borst FNA, Celblok.
Aan de rand van het desmoplastische stroma in afbeelding102 bevindt zich een onregelmatige, solide lip van tumorcellen, die verdacht is voor invasiviteit (pijl).
40X
Ductaal carcinoom, Borst FNA, Celblok.
Aan de rand van het desmoplastische stroma in afbeelding102 bevindt zich een onregelmatige, solide lip van tumorcellen, die verdacht is voor invasiviteit (pijl).
40X
Lobulair carcinoom

Lobulair carcinoom, Borst FNA, celblok.
Lobulaire carcinoomcellen lijken in het stromaweefsel te zijn ingebed, zodat de indruk wordt gewekt van hypercellulariteit. Dit kan de reden zijn waarom cytologische preparaten van een lobulair carcinoom vaak weinig maligne cellen tonen.
20X
Lobulair carcinoom, Borst FNA, celblok.
Lobulaire carcinoomcellen lijken in het stromaweefsel te zijn ingebed, zodat de indruk wordt gewekt van hypercellulariteit. Dit kan de reden zijn waarom cytologische preparaten van een lobulair carcinoom vaak weinig maligne cellen tonen.
20X
Lobulair carcinoom, Borst FNA, celblok.
Een enkele rij minimaal atypische spaarzame cellen die op en in de stromale fragmenten vastzitten, kan worden waargenomen. Let op de kenmerkende targetoïde intracytoplasmische vacuolen van lobulaire neoplasie.
40X
Lobulair carcinoom, Borst FNA, celblok.
Een enkele rij minimaal atypische spaarzame cellen die op en in de stromale fragmenten vastzitten, kan worden waargenomen. Let op de kenmerkende targetoïde intracytoplasmische vacuolen van lobulaire neoplasie.
40X
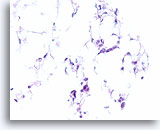
Invasief lobulair carcinoom, Borst FNA, Celblok.
Dunne strengen met lobulaire carcinoomcellen infiltreren het vetweefsel.
40X
Invasief lobulair carcinoom, Borst FNA, Celblok.
Dunne strengen met lobulaire carcinoomcellen infiltreren het vetweefsel.
40X
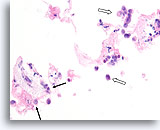
Invasief lobulair carcinoom, Borst FNA, Celblok.
Spaarzame losgemaakte lobulaire carcinoomcellen zijn aanwezig (open pijl). Focaal infiltreren ze het stromaweefsel (pijlen).
40x
Invasief lobulair carcinoom, Borst FNA, Celblok.
Spaarzame losgemaakte lobulaire carcinoomcellen zijn aanwezig (open pijl). Focaal infiltreren ze het stromaweefsel (pijlen).
40x
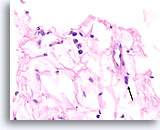
Lobulair carcinoom, Borst FNA, Celblok.
In dit veld worden enkele losgekomen lobulaire carcinoomcellen weergegeven die vermengd zijn met het vetweefsel. Twee andere cellen zijn verdacht voor invasiviteit in het weefsel (pijl).
40X
Lobulair carcinoom, Borst FNA, Celblok.
In dit veld worden enkele losgekomen lobulaire carcinoomcellen weergegeven die vermengd zijn met het vetweefsel. Twee andere cellen zijn verdacht voor invasiviteit in het weefsel (pijl).
40X
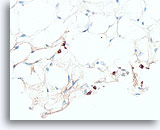
Lobulair carcinoom, Borst FNA, Celblok.
Een pankeratine immunokleuring kan nuttig zijn om de spaarzame, infiltrerende lobulaire cellen aan het licht te helpen brengen.
40X
Lobulair carcinoom, Borst FNA, Celblok.
Een pankeratine immunokleuring kan nuttig zijn om de spaarzame, infiltrerende lobulaire cellen aan het licht te helpen brengen.
40X
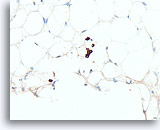
Lobulair carcinoom, Borst FNA, Celblok.
Een cluster van 4 lobulaire carcinoomcellen en enkele andere afzonderlijke lobulaire carcinoomcellen zijn gemarkeerd met een pankeratine immunokleuring.
40X
Lobulair carcinoom, Borst FNA, Celblok.
Een cluster van 4 lobulaire carcinoomcellen en enkele andere afzonderlijke lobulaire carcinoomcellen zijn gemarkeerd met een pankeratine immunokleuring.
40X
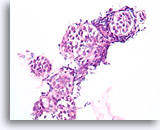
Lobulair neoplasie, Borst FNA, Celblok.
Een in-situ groeipatroon van lobulaire neoplasie is moeilijk of onmogelijk te identificeren in cytologische preparaten. Deze cluster van ongeveer 5 trossen is gedeeltelijk opgezet door het kenmerkende patroon van een losse ‘zak knikkers’ van lobulaire neoplasie zonder vorming van een glandulair lumen.
40X
Lobulair neoplasie, Borst FNA, Celblok.
Een in-situ groeipatroon van lobulaire neoplasie is moeilijk of onmogelijk te identificeren in cytologische preparaten. Deze cluster van ongeveer 5 trossen is gedeeltelijk opgezet door het kenmerkende patroon van een losse ‘zak knikkers’ van lobulaire neoplasie zonder vorming van een glandulair lumen.
40X
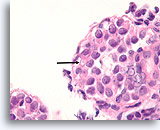
Lobulair neoplasie, Borst FNA, Celblok.
Een sterkere vergroting toont een kenmerkende targetoïde cytoplasmische vacuole (pijl)
100X
Lobulair neoplasie, Borst FNA, Celblok.
Een sterkere vergroting toont een kenmerkende targetoïde cytoplasmische vacuole (pijl)
100X
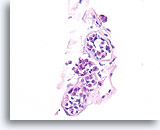
Lobulair neoplasie, Borst FNA, Celblok.
Lobulair neoplasie, borst FNA, celblok.
Bij deze patiënt kunnen drie trossen worden waargenomen die gedeeltelijk zijn opgezet door lobulaire neoplasie.
40X
Lobulair neoplasie, Borst FNA, Celblok.
Lobulair neoplasie, borst FNA, celblok.
Bij deze patiënt kunnen drie trossen worden waargenomen die gedeeltelijk zijn opgezet door lobulaire neoplasie.
40X
Referenties:
- Symmans WF, Weg N, Gross J, et al. A prospective comparison of stereotaxic fine-needle aspiration versus stereotaxic core needle biopsy for the diagnosis of mammographic abnormalities. Cancer 1999; 85:1119-32.
- Liao J, Davey DD, Warren G, Davis J, Moore AR, Samayoa LM. Ultrasound-guided fine-needle aspiration biopsy remains a valid approach in the evaluation of nonpalpable breast lesions. Diagnostic Cytopathology 2004; 30:325-31.
- Westenend PJ, Sever AR, Beekman-De Volder HJ, Liem SJ. A comparison of aspiration cytology and core needle biopsy in the evaluation of breast lesions. Cancer 2001; 93:146-50.
- Istvanic S, Fischer, A. H., Banner, B., Eaton, D., Larkin, A., Khan, A. Cell blocks of breast FNA’s frequently allow diagnosis of invasion or histological classification of proliferative changes. Submitted for publication.
- Anonymous. The uniform approach to breast fine-needle aspiration biopsy. National Cancer Institute Fine-Needle Aspiration of Breast Workshop Subcommittees. Diagnostic Cytopathology 1997; 16:295-311.
- Boerner S, Fornage BD, Singletary E, Sneige N. Ultrasound-guided fine-needle aspiration (FNA) of nonpalpable breast lesions: a review of 1885 FNA cases using the National Cancer Institute-supported recommendations on the uniform approach to breast FNA. Cancer 1999; 87:19-24.
- Rosen PP. Rosen’s Breast Pathology. Philadelphia: Lippincott Williams & Wilkins, 2001.
- Fischer AH, Zhao C, Li QK, Gustafson KS, Eltoum IE, Tambouret R., Benstein B, Savaloja LC, Kulesza P. The Cytologic Criteria of Malignancy. J Cellular Biochem 110:795-811, 2010
- Mosunjac MB, Lewis MM, Lawson D, Cohen C. Use of a novel marker, calponin, for myoepithelial cells in fine-needle aspirates of papillary breast lesions. Diagnostic Cytopathology 2000; 23:151-5.
- Collins LC, Carlo VP, Hwang H, Barry TS, Gown AM, Schnitt SJ. Intracystic papillary carcinomas of the breast: a reevaluation using a panel of myoepithelial cell markers. American Journal of Surgical Pathology 2006; 30:1002-7.
- Shah VI, Flowers CI, Douglas-Jones AG, Dallimore NS, Rashid M. Immunohistochemistry increases the accuracy of diagnosis of benign papillary lesions in breast core needle biopsy specimens. Histopathology 2006; 48:683-91.
- Moriya T, Kasajima A, Ishida K, et al. New trends of immunohistochemistry for making differential diagnosis of breast lesions. Medical Molecular Morphology 2006; 39:8-13.
- Silverman JF, Masood S, Ducatman BS, Wang HH, Sneige N. Can FNA biopsy separate atypical hyperplasia, carcinoma in situ, and Invasivecarcinoma of the breast? Cytomorphologic criteria and limitations in diagnosis. Diagnostic Cytopathology 1993; 9:713-28.
- Hartmann LC, Sellers TA, Frost MH, et al. Benign breast disease and the risk of breast cancer. New England Journal of Medicine 2005; 353:229-37.