La mama está compuesta de células grasas y de estroma que soporta el tejido glandular, un sistema ductal ramificado que llega a 6-10 conductos principales, que se abren al pezón. En la mama se desarrollan lesiones tanto benignas como malignas. En las mujeres jóvenes, los fibroadenomas son lesiones comunes pero, a medida que la edad de las mujeres avanza, los cambios fibroquísticos tienden a ser más habituales. Otras lesiones benignas son la necrosis grasa y los estados inflamatorios como el absceso mamario o mastitis. También pueden producirse otras lesiones benignas menos comunes como los hamartomas y la hiperplasia pseudoangiomatosa. La hiperplasia ductal forma parte de los cambios fibroquísticos. La hiperplasia ductal atípica puede ser difícil de diferenciar del carcinoma ductal in situ de bajo grado, y estas lesiones representan un espectro de enfermedades que pueden desembocar en un carcinoma mamario. Los cambios radiológicos pueden generar una masa, que puede mostrarse atípica en una citología por aspiración. De igual forma, los cambios debidos al embarazo y a la lactancia también pueden confundirse con una malignidad en los aspirados, por lo que una buena información clínica es esencial para realizar un diagnóstico citológico preciso.
Las malignidades que se producen en la mama pueden ser primarias o metastásicas. Las metastásicas incluyen el linfoma, el melanoma maligno y otros tumores secundarios como los carcinomas renales, bronquiales, ováricos o pulmonares. El más significativo desde el punto de vista diagnóstico es el carcinoma primario de mama, que será de tipo ductal si no está especificado de otra manera (NEOM). La segunda neoplasia primaria de mama más común es el carcinoma lobulillar. El carcinoma ductal in situ y el carcinoma lobulillar se diagnostican fácilmente a partir de biopsias por excisión, pero resulta más difícil realizar un diagnóstico fiable a partir de una citología.
La citología mamaria se emplea con fines diagnósticos y de screening. Cualquier lesión detectada en un screening mamográfico puede analizarse con una aguja fina, mediante aspiración directa si es palpable o mediante guía estereotáxica o de ultrasonido si no es palpable. Si el análisis de la citología es insatisfactorio o equívoco, se puede utilizar una biopsia con trócar o una sección congelada. Las masas mamarias palpables se pueden aspirar fácilmente y pueden procesarse rápidamente para dar un rápido diagnóstico.
La citología de la aspiración con aguja fina es una herramienta útil en el diagnóstico de lesiones mamarias, ya sean palpables o no. Se trata de un procedimiento seguro, rápido, barato (en comparación con las biopsias con trócar) y relativamente indoloro, y puede ser realizado tanto por los médicos como por los patólogos. En manos de los citopatólogos, el porcentaje de no adecuación es bajo, ya que se puede realizar una rápida tinción para evaluar la adecuación de la muestra y se puede repetir el procedimiento en caso necesario. En manos de un citopatólogo con experiencia, la correlación citohistológica es excelente. Una desventaja menor de los aspirados con aguja fina es que no siempre es posible diferenciar las lesiones infiltrantes de las lesiones in situ, pero las biopsias con trócar presentan el mismo tipo de problemas en algunos casos.
El material aspirado es extendido en un portaobjetos o introducido en una solución Cytolyt®, y la aguja es lavada con la misma solución para todos los pases realizados. El fluido se puede utilizar para preparar varios portaobjetos casi idénticos, permitiendo así que el laboratorio pueda guardar material para realizar tinciones especiales como son las tinciones con los receptores de estrógeno y progesterona y la sobre-expresión de la proteína HER2/neu.
Los aspirados de mastitis y abscesos mamarios contienen abundantes neutrófilos, histiocitos, histiocitos gigantes multinucleados, unas cuantas células epiteliales en degeneración y material proteináceo, el cual puede confundirse con necrosis. Estos hallazgos son bastante habituales en mujeres lactantes. La necrosis grasa se desarrolla tras un trauma, ya sea debido a un sangrado directo del pecho o derivado de la cirugía o radioterapia. Clínica y mamográficamente, la necrosis grasa se asemeja al carcinoma de mama, con una masa dura e irregular. Sin embargo, el aspirado es diagnóstico, al estar compuesto de adipocitos en degeneración con abundantes lipófagos.
El fibroadenoma se presenta como una masa mamaria firme, homogénea y móvil. Suele parecer elástico y se agarra a la punta de la aguja. Los aspirados suelen ser celulares con grandes placas ramificadas de células ductales benignas, con una salpicadura de ‘semillas de sésamo’ sobre la superficie (células mioepiteliales). En el extendido de ThinPrep, las células mioepiteliales sueltas del fondo tienden a acumularse adyacentes a las células ductales. A menudo, las células ductales muestran superposición, sugiriendo un elemento de hiperplasia ductal. Se observan fragmentos estromales de tamaño variable, conteniendo núcleos fusiformes.
Los tumores Filodes de bajo grado también tienen composición fibroepitelial, con un elemento glandular que se asemeja mucho al del fibroadenoma. Sin embargo, la hiperplasia ductal es mucho más común en los tumores Filodes. El componente estromal tiende a ser prominente, con grandes fragmentos estromales que son hipercelulares. También se pueden observar abundantes grupos celulares estromales. Los tumores Filodes malignos exhiben características inequívocas de malignidad.
El cambio fibroquístico es una lesión bastante común que incluye un cambio quístico con metaplasia apocrina, hiperplasia ductal de tipo normal, y otras formas de epiteliosis. El aspecto citológico incluye placas y grupos de células ductales benignas superpuestas con células mioepiteliales, metaplasia apocrina, macrófagos esponjosos y calcio. Las características son citológicamente similares a las del fibroadenoma, pero el hallazgo clínico típico es un engrosamiento o dentado no definido en lugar de la masa móvil homogénea que se observa en el fibroadenoma. Los cambios quísticos pueden progresar para formar quistes palpables que se aspiran fácilmente. El fluido puede ser claro e incoloro o turbio, pardo, verde o manchado de sangre. Los fluidos quísticos contienen material proteináceo, células ductales benignas que pueden aparecer degeneradas o ligeramente atípicas, células metaplásicas apocrinas y macrófagos esponjosos. El fluido quístico pardo o verde suele ser indicativo de un sangrado previo y este hecho puede confirmarse por la presencia en la diapositiva de macrófagos cargados de hemosiderina. Las células metaplásicas apocrinas presentan abundante citoplasma granular, núcleos redondos y nucleolos prominentes. Pueden ser binucleadas y pueden aparecer atípicas, ya que el tamaño nuclear es variable.
La esferulosis colágena es una lesión benigna que puede acompañar a la hiperplasia ductal o lobulillar. Los aspirados muestran glóbulos de material extracelular (que se tiñen de azul pálido con la tinción de Papanicolaou y de magenta con DiffQuik), metaplasia apocrina ductal benigna y células mioepiteliales. El diagnóstico diferencial incluye el carcinoma adenoide quístico.
El carcinoma ductal tiende a ser unilateral. Se presenta clínicamente como una masa dura e irregular con un aspecto mamográfico característico de una masa, una lesión espiculada o microcalcificaciones. Aunque se cree que el carcinoma ductal in situ precede al carcinoma ductal infiltrante, también puede acompañar al carcinoma lobulillar infiltrante. De igual forma, el carcinoma lobulillar in situ puede estar asociado al carcinoma ductal, así como al carcinoma lobulillar infiltrante. Los aspirados de carcinoma ductal in situ exhiben características de malignidad, pero también pueden mostrar células mioepiteliales que se colocan sobre los grupos celulares. El carcinoma ductal infiltrante (NOS) genera aspirados celulares compuestos por grandes células tumorales, a menudo pleomórficas. Los carcinomas ductales de bajo grado pueden ser difíciles de distinguir de las células ductales benignas. La invasión viene sugerida por la presencia de células tumorales infiltradas entre los adipocitos.
El carcinoma lobulillar suele ser bilateral. Clínicamente, el tumor no está definido y no presenta una apariencia mamográfica específica. El carcinoma lobulillar in situ se observa como grupos redondeados de pequeñas células malignas, algunas con vacuolas intracitoplasmáticas, a menudo con superposición de células mioepiteliales. Los aspirados de carcinoma lobulillar infiltrante son escasos, y a menudo generan un informe ‘insatisfactorio’ o ‘atípico’. Las células son más pequeñas que en el carcinoma ductal, a menudo aisladas con núcleos excéntricos y vacuolas intracitoplasmáticas. No se suelen observar la presencia de nucleolos. Las células suelen disponerse en fila india. En los aspirados de carcinoma lobulillar se pueden observar células en anillo de sello.
Existen también algunos tipos especiales de carcinomas ductales, como los tubulares, coloides (mucinosos), metaplásicos, medulares, apocrinos y escamosos. La definición de muchos de estos tipos especiales de tumores mamarios se basa en la evidencia de que más del 90% de la lesión muestre las características típicas de dicho tipo. Dado que las citologías sólo analizan una parte del tumor, no es correcto clasificar estos tumores como citológicamente tubulares o mucinosos. En el informe se puede sugerir la sospecha de esta clasificación mediante la inclusión de una descripción como “carcinoma ductal con características mucinosas o tubulares” en lugar de realizar una clasificación definitiva del tipo de tumor, que posiblemente diferiría de la de la muestra de excisión. Los carcinomas tubulares están compuestos de estructuras tubulares y acinares. Los aspirados de carcinoma mucinoso suelen ser enormemente mucoides y muestran abundante mucina en el frotis. También se pueden desarrollar algunas rarezas como el carcinoma adenoide quístico, idéntico al observado en la glándula salival. Este tumor se asemeja a la esferulosis colágena benigna, debido a que también contiene material hialino extracelular con las mismas características de tinción, pero en forma de glóbulos y estructuras tubulares o cilíndricas. Las células tumorales acompañantes son pequeñas y blandas con poco citoplasma, mientras que no se observan células ductales benignas, apocrinas ni metaplásicas.
Nota: Puede clicar en cualquier imagen del
Atlas para ver la imagen aumentada
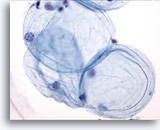
Figura 1
PAAF de mama, grasa.
Las células grasas, o adipocitos, son grandes células esféricas con citoplasma traslúcido y pequeños núcleos excéntricos. Se observan tanto en los aspirados benignos como en los malignos. 40x
Figura 1
PAAF de mama, grasa.
Las células grasas, o adipocitos, son grandes células esféricas con citoplasma traslúcido y pequeños núcleos excéntricos. Se observan tanto en los aspirados benignos como en los malignos.
40x
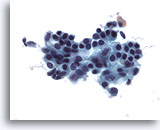
Figura 2
PAAF de mama, células ductales benignas.
Los aspirados de una mama normal producen células ductales benignas, a menudo acompañadas de células mioepiteliales. 40x
Figura 2
PAAF de mama, células ductales benignas.
Los aspirados de una mama normal producen células ductales benignas, a menudo acompañadas de células mioepiteliales.
40x
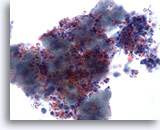
Figura 3
PAAF de mama, absceso.
Los aspirados con aguja fina de abscesos mamarios no suelen exhibir células epiteliales. Los restos celulares, los hematíes lisados y los neutrófilos son características comunes. 40x
Figura 3
PAAF de mama, absceso.
Los aspirados con aguja fina de abscesos mamarios no suelen exhibir células epiteliales. Los restos celulares, los hematíes lisados y los neutrófilos son características comunes.
40x
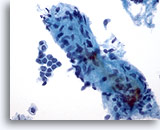
Figura 4: PAAF de mama, fibroadenoma.
Se observa la presencia de un gran fragmento estromal que contiene unos pocos núcleos pequeños fusiformes. Los fragmentos estromales se pueden observar en los aspirados de tejido mamario benigno, así como en lesiones fibroepiteliales como el fibroadenoma. Los fragmentos estromales de tumores Filodes son mucho más celulares. Observe el pequeño grupo de células ductales benignas también presentes. 40x
Figura 4
PAAF de mama, fibroadenoma.
Se observa la presencia de un gran fragmento estromal que contiene unos pocos núcleos pequeños fusiformes. Los fragmentos estromales se pueden observar en los aspirados de tejido mamario benigno, así como en lesiones fibroepiteliales como el fibroadenoma. Los fragmentos estromales de tumores Filodes son mucho más celulares. Observe el pequeño grupo de células ductales benignas también presentes.
40x
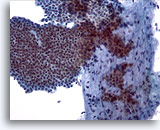
Figura 5
PAAF de mama, fibroadenoma.
Una gran placa ramificada de células ductales benignas cohesionadas y uniformes dispuesta sobre un fragmento estromal. Observe los pequeños núcleos de las células estromales algo fusiformes dentro del fragmento estromal. 20x
Figura 5
PAAF de mama, fibroadenoma.
Una gran placa ramificada de células ductales benignas cohesionadas y uniformes dispuesta sobre un fragmento estromal. Observe los pequeños núcleos de las células estromales algo fusiformes dentro del fragmento estromal.
20x
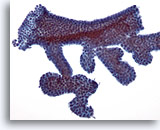
Figura 6
PAAF de mama, fibroadenoma.
Normalmente, los aspirados de fibroadenoma contienen grandes placas ramificadas de células ductales benignas como las mostradas en esta ilustración. 20x
Figura 6
PAAF de mama, fibroadenoma.
Normalmente, los aspirados de fibroadenoma contienen grandes placas ramificadas de células ductales benignas como las mostradas en esta ilustración.
20x
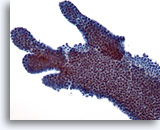
Figura 7
PAAF de mama, fibroadenoma.
Éste es otro ejemplo de la apariencia ramificada de las células ductales del fibroadenoma. 20x
Figura 7
PAAF de mama, fibroadenoma.
Éste es otro ejemplo de la apariencia ramificada de las células ductales del fibroadenoma.
20x
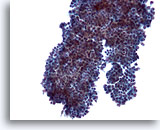
Figura 8
PAAF de mama, fibroadenoma.
En algunos ejemplos, los grupos de células ductales presentan pequeñas proyecciones redondeadas como las aquí observadas en lugar de las largas ramas observadas en las dos imágenes anteriores. 20x
Figura 8
PAAF de mama, fibroadenoma.
En algunos ejemplos, los grupos de células ductales presentan pequeñas proyecciones redondeadas como las aquí observadas en lugar de las largas ramas observadas en las dos imágenes anteriores.
20x
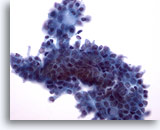
Figura 9: PAAF de mama, fibroadenoma.
En este campo de visión, los bordes del grupo ductal no son homogéneos como en las dos imágenes anteriores, posiblemente debido al procesado con líquido. Dentro del grupo de células ductales, y en el borde superior, se observan algunas células mioepiteliales. Con el procesado ThinPrep, las células mioepiteliales tienden a aparecer adyacentes a los grupos ductales, en lugar de encontrarse dispersas en el fondo como se observa en los extendidos convencionales. 40x
Figura 9
PAAF de mama, fibroadenoma.
En este campo de visión, los bordes del grupo ductal no son homogéneos como en las dos imágenes anteriores, posiblemente debido al procesado con líquido. Dentro del grupo de células ductales, y en el borde superior, se observan algunas células mioepiteliales. Con el procesado ThinPrep, las células mioepiteliales tienden a aparecer adyacentes a los grupos ductales, en lugar de encontrarse dispersas en el fondo como se observa en los extendidos convencionales.
40x
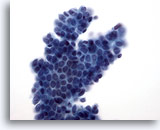
Figura 10
PAAF de mama, fibroadenoma.
Una placa ramificada de células ductales benignas con células mioepiteliales superpuestas genera la característica apariencia de ‘semillas de sésamo sobre un pastel’. 40x
Figura 10
PAAF de mama, fibroadenoma.
Una placa ramificada de células ductales benignas con células mioepiteliales superpuestas genera la característica apariencia de ‘semillas de sésamo sobre un pastel’.
40x
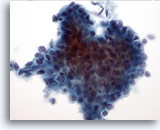
Figura 11: PAAF de mama, tumor Filodes de bajo grado.
Los tumores Filodes también son lesiones fibroepiteliales, al igual que los fibroadenomas. No obstante, incluso las lesiones de bajo grado son capaces de recurrir si no se eliminan con un amplio margen. El componente glandular es similar al observado en el fibroadenoma, aunque puede ser mucho más celular y aparecer hiperplásico. Esta ilustración muestra un grupo tridimensional de células ductales que muestra superposición y agrupamiento nuclear, sugiriendo que se trata de cambios hiperplásicos. 40x
Figura 11
PAAF de mama, tumor Filodes de bajo grado.
Los tumores Filodes también son lesiones fibroepiteliales, al igual que los fibroadenomas. No obstante, incluso las lesiones de bajo grado son capaces de recurrir si no se eliminan con un amplio margen. El componente glandular es similar al observado en el fibroadenoma, aunque puede ser mucho más celular y aparecer hiperplásico. Esta ilustración muestra un grupo tridimensional de células ductales que muestra superposición y agrupamiento nuclear, sugiriendo que se trata de cambios hiperplásicos.
40x
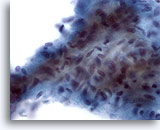
Figura 12
PAAF de mama, tumor Filodes de bajo grado.
Este fragmento estromal es hipercelular y contiene células fusiformes ovoides aglomeradas. También pueden observarse numerosas células estromales fusiformes aisladas en el fondo de esta lesión. 60x
Figura 12
PAAF de mama, tumor Filodes de bajo grado.
Este fragmento estromal es hipercelular y contiene células fusiformes ovoides aglomeradas. También pueden observarse numerosas células estromales fusiformes aisladas en el fondo de esta lesión.
60x
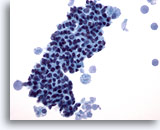
Figura 13
PAAF de mama, cambios fibroquísticos.
Este campo de visión muestra un grupo comprimido de células ductales benignas con macrófagos esponjosos en cada extremo y material secretado en el fondo. 40x
Figura 13
PAAF de mama, cambios fibroquísticos.
Este campo de visión muestra un grupo comprimido de células ductales benignas con macrófagos esponjosos en cada extremo y material secretado en el fondo.
40x
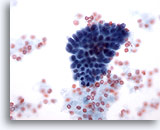
Figura 14
PAAF de mama, cambios fibroquísticos.
Este pequeño grupo de células ductales benignas proviene de un aspirado de cambios fibroquísticos. 40x
Figura 14
PAAF de mama, cambios fibroquísticos.
Este pequeño grupo de células ductales benignas proviene de un aspirado de cambios fibroquísticos.
40x
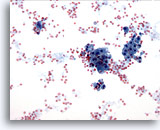
Figura 15
PAAF de mama, cambios fibroquísticos.
En los cambios fibroquísticos se observa secreción en el fondo, sangre y células de metaplasia apocrina. 20x
Figura 15
PAAF de mama, cambios fibroquísticos.
En los cambios fibroquísticos se observa secreción en el fondo, sangre y células de metaplasia apocrina.
20x
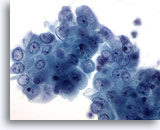
Figura 16
PAAF de mama, quiste mamario.
Este grupo de células ductales benignas muestra una suave atípia en cuanto a la forma de los nucleolos visibles y un ligero aumento del tamaño nuclear. Estos cambios mínimos se observan frecuentemente en los fluidos de los quistes mamarios. 60x
Figura 16
PAAF de mama, quiste mamario.
Este grupo de células ductales benignas muestra una suave atípia en cuanto a la forma de los nucleolos visibles y un ligero aumento del tamaño nuclear. Estos cambios mínimos se observan frecuentemente en los fluidos de los quistes mamarios.
60x
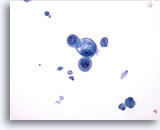
Figura 17
PAAF de mama, quiste mamario.
Este campo de visión muestra un pequeño grupo de células epiteliales benignas, una vacuolada, con restos quísticos en el fondo. 40x
Figura 17
PAAF de mama, quiste mamario.
Este campo de visión muestra un pequeño grupo de células epiteliales benignas, una vacuolada, con restos quísticos en el fondo.
40x
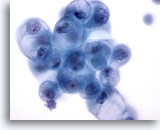
Figura 18
PAAF de mama, quiste mamario.
Las células ductales benignas del fluido quístico pueden mostrar una vacuolización degenerativa como la aquí ilustrada. Estos cambios no deberían interpretarse como diagnósticos de un carcinoma. 60x
Figura 18
PAAF de mama, quiste mamario.
Las células ductales benignas del fluido quístico pueden mostrar una vacuolización degenerativa como la aquí ilustrada. Estos cambios no deberían interpretarse como diagnósticos de un carcinoma.
60x
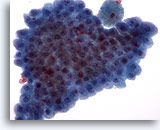
Figura 19
PAAF de mama, metaplasia apocrina.
Las células apocrinas benignas aparecen a menudo en placas planas. Se observan normalmente en los fluidos de los quistes mamarios y en los aspirados con aguja fina de áreas con cambios fibroquísticos. 40x
Figura 19
PAAF de mama, metaplasia apocrina.
Las células apocrinas benignas aparecen a menudo en placas planas. Se observan normalmente en los fluidos de los quistes mamarios y en los aspirados con aguja fina de áreas con cambios fibroquísticos.
40x
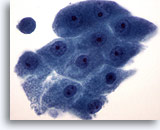
Figura 20
PAAF de mama, metaplasia apocrina.
Las células apocrinas exhiben abundante citoplasma granular y núcleos redondos con nucleolos prominentes. Su contorno citoplasmático suele estar claramente definido. 60x
Figura 20
PAAF de mama, metaplasia apocrina.
Las células apocrinas exhiben abundante citoplasma granular y núcleos redondos con nucleolos prominentes. Su contorno citoplasmático suele estar claramente definido.
60x
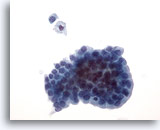
Figura 21: PAAF de mama, lesión quística papilar.
Los aspirados de las lesiones quísticas papilares contienen células epiteliales y macrófagos esponjosos. Las células ductales benignas de este grupo son uniformes en tamaño y forma y aparecen en empalizada a lo largo de un borde. Observe el macrófago esponjoso y la célula ductal benigna aislada que aparecen encima de este grupo. Si existe una atipia celular suave, puede resultar difícil diferenciar una lesión benigna de una lesión papilar maligna. 40x
Figura 21
PAAF de mama, lesión quística papilar.
Los aspirados de las lesiones quísticas papilares contienen células epiteliales y macrófagos esponjosos. Las células ductales benignas de este grupo son uniformes en tamaño y forma y aparecen en empalizada a lo largo de un borde. Observe el macrófago esponjoso y la célula ductal benigna aislada que aparecen encima de este grupo. Si existe una atipia celular suave, puede resultar difícil diferenciar una lesión benigna de una lesión papilar maligna.
40x
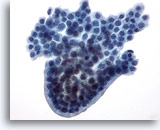
Figura 22
PAAF de mama, lesión quística papilar.
Este grupo de células ductales benignas presenta un borde redondeado en empalizada que proporciona una apariencia de estructura papilar, aunque no se observe un centro fibrovascular. 40x
Figura 22
PAAF de mama, lesión quística papilar.
Este grupo de células ductales benignas presenta un borde redondeado en empalizada que proporciona una apariencia de estructura papilar, aunque no se observe un centro fibrovascular.
40x
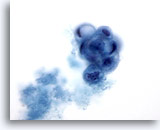
Figura 23: PAAF de mama, lesión quística papilar.
En este campo de visión se observa un grupo papilar redondeado de células ductales vacuoladas en degeneración, acompañado por material secretado. Esta apariencia se describe mejor como atípica, ya que no siempre es posible diferenciar las lesiones papilares benignas de las malignas. La presencia de células de metaplasia apocrina suele ser la clave para determinar que se trata de un proceso benigno. 60x
Figura 23
PAAF de mama, lesión quística papilar.
En este campo de visión se observa un grupo papilar redondeado de células ductales vacuoladas en degeneración, acompañado por material secretado. Esta apariencia se describe mejor como atípica, ya que no siempre es posible diferenciar las lesiones papilares benignas de las malignas. La presencia de células de metaplasia apocrina suele ser la clave para determinar que se trata de un proceso benigno.
60x
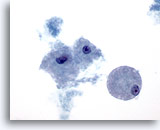
Figura 24
PAAF de mama, lesión quística papilar.
Los macrófagos esponjosos, como los aquí ilustrados, se observan tanto en las lesiones quísticas benignas como en las malignas, ya sean papilares o no. 60x
Figura 24
PAAF de mama, lesión quística papilar.
Los macrófagos esponjosos, como los aquí ilustrados, se observan tanto en las lesiones quísticas benignas como en las malignas, ya sean papilares o no.
60x
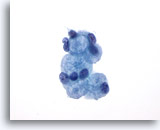
Figura 25: PAAF de mama, esferulosis colágena.
Se trata de una lesión benigna que suele ser un hallazgo accidental en las biopsias mamarias. Raramente forman una masa palpable. El aspirado contiene evidencias de hiperplasia ductal benigna, de células ductales benignas y de metaplásica apocrina, células epiteliales y glóbulos de material extracelular rodeado de pequeñas células epiteliales benignas. Una imagen similar se observa en los aspirados de carcinoma adenoide quístico de la mama. 60x
Figura 25
PAAF de mama, esferulosis colágena.
Se trata de una lesión benigna que suele ser un hallazgo accidental en las biopsias mamarias. Raramente forman una masa palpable. El aspirado contiene evidencias de hiperplasia ductal benigna, de células ductales benignas y de metaplásica apocrina, células epiteliales y glóbulos de material extracelular rodeado de pequeñas células epiteliales benignas. Una imagen similar se observa en los aspirados de carcinoma adenoide quístico de la mama.
60x
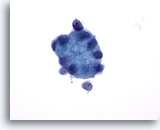
Figura 26
PAAF de mama, esferulosis colágena.
Este gran glóbulo de material hialino está rodeado de pequeñas células epiteliales. 60x
Figura 26
PAAF de mama, esferulosis colágena.
Este gran glóbulo de material hialino está rodeado de pequeñas células epiteliales.
60x
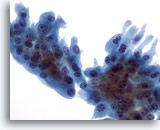
Figura 27
Una placa de células de metaplásia apocrina con citoplasma relativamente abundante fue observada en el aspirado del caso anterior que mostraba esferulosis colágena. 40x
Figura 27
PAAF de mama, esferulosis colágena/apocrine metaplasia.
Una placa de células de metaplásia apocrina con citoplasma relativamente abundante fue observada en el aspirado del caso anterior que mostraba esferulosis colágena.
40x
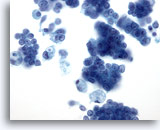
Figura 28: PAAF de mama, carcinoma ductal in situ.
Éste es un aspirado celular que muestra grupos de células tumorales, células malignas aisladas y macrófagos esponjosos. El carcinoma ductal in situ (CDIS) exhibe frecuentemente células mioepiteliales que se superponen a los grupos celulares malignos. Las células tumorales tienden a estar agrupadas en lugar de aisladas, al igual que en un tumor infiltrante. Además, las estructuras tubulares no están asociadas al CDIS. El CDIS de tipo comedo está asociado característicamente a la necrosis y al calcio. 40x
Figura 28
PAAF de mama, carcinoma ductal in situ.
Éste es un aspirado celular que muestra grupos de células tumorales, células malignas aisladas y macrófagos esponjosos. El carcinoma ductal in situ (CDIS) exhibe frecuentemente células mioepiteliales que se superponen a los grupos celulares malignos. Las células tumorales tienden a estar agrupadas en lugar de aisladas, al igual que en un tumor infiltrante. Además, las estructuras tubulares no están asociadas al CDIS. El CDIS de tipo comedo está asociado característicamente a la necrosis y al calcio.
40x
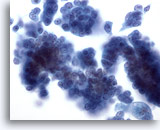
Figura 29
PAAF de mama, carcinoma ductal in situ.
Se observan grupos de células tumorales bastante blandas. En el grupo celular de la derecha aparece una vaga impresión de un centro fibrovascular. 40x
Figura 29
PAAF de mama, carcinoma ductal in situ.
Se observan grupos de células tumorales bastante blandas. En el grupo celular de la derecha aparece una vaga impresión de un centro fibrovascular.
40x
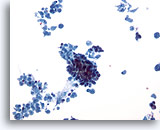
Figura 30
PAAF de mama, carcinoma ductal.
Este campo de visión a bajo aumento muestra abundante necrosis celular con un grupo comprimido de células provenientes de un caso de carcinoma ductal infiltrante. 20x
Figura 30
PAAF de mama, carcinoma ductal.
Este campo de visión a bajo aumento muestra abundante necrosis celular con un grupo comprimido de células provenientes de un caso de carcinoma ductal infiltrante.
20x
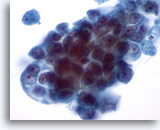
Figura 31
PAAF de mama, carcinoma ductal.
Con una mayor magnificación de la imagen, las células neoplasicas muestran agrupamiento y nucleolos prominentes. La cromatina es anormal aunque pálida. 60x
Figura 31
PAAF de mama, carcinoma ductal.
Con una mayor magnificación de la imagen, las células neoplasicas muestran agrupamiento y nucleolos prominentes. La cromatina es anormal aunque pálida.
60x
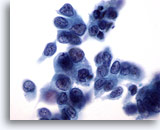
Figura 32
PAAF de mama, carcinoma ductal.
Las células tumorales de este campo de visión muestran una cierta disociación, pleomorfismo, irregularidad nuclear, hipercromasia y nucleolos. 60x
Figura 32
PAAF de mama, carcinoma ductal.
Las células tumorales de este campo de visión muestran una cierta disociación, pleomorfismo, irregularidad nuclear, hipercromasia y nucleolos.
60x
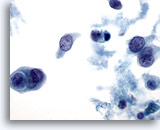
Figura 33
PAAF de mama, carcinoma ductal.
En esta imagen se ilustran la necrosis, el canibalismo entre las células tumorales y la disociación celular. 60x
Figura 33
PAAF de mama, carcinoma ductal.
En esta imagen se ilustran la necrosis, el canibalismo entre las células tumorales y la disociación celular.
60x
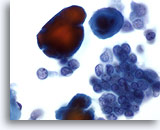
Figura 34
PAAF de mama, carcinoma ductal de bajo grado.
Las células del carcinoma se observan aquí en grupos y aisladas, acompañadas por partículas de calcio que se tiñen de rojo con la tinción de Papanicoloau. Las células aparecen monomórficas, con contornos nucleares homogéneos y macronucleolos, sugiriendo que se trata de un carcinoma ductal de bajo grado. 60x
Figura 34
PAAF de mama, carcinoma ductal de bajo grado.
Las células del carcinoma se observan aquí en grupos y aisladas, acompañadas por partículas de calcio que se tiñen de rojo con la tinción de Papanicoloau. Las células aparecen monomórficas, con contornos nucleares homogéneos y macronucleolos, sugiriendo que se trata de un carcinoma ductal de bajo grado.
60x
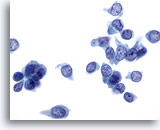
Figura 35
PAAF de mama, carcinoma ductal de bajo grado.
En este campo de visión se observan numerosas células de carcinoma. Los núcleos son pálidos, pero el patrón de cromatina es claramente anormal. En este ejemplo los nucleolos no presentan un tamaño aumentado. 60x
Figura 35
PAAF de mama, carcinoma ductal de bajo grado.
En este campo de visión se observan numerosas células de carcinoma. Los núcleos son pálidos, pero el patrón de cromatina es claramente anormal. En este ejemplo los nucleolos no presentan un tamaño aumentado.
60x
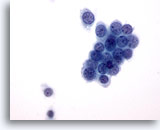
Figura 36
PAAF de mama, carcinoma ductal de bajo grado.
Éste es un ejemplo de carcinoma ductal de bajo grado. Algunas células tumorales aparecen en un grupo comprimido con unas pocas células aisladas. Observe el contorno nuclear redondeado. 60x
Figura 36
PAAF de mama, carcinoma ductal de bajo grado.
Éste es un ejemplo de carcinoma ductal de bajo grado. Algunas células tumorales aparecen en un grupo comprimido con unas pocas células aisladas. Observe el contorno nuclear redondeado.
60x
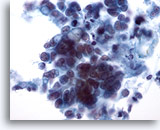
Figura 37
PAAF de mama, carcinoma ductal.
Este campo de visión muestra células tumorales que se disponen de forma aislada o en pequeños grupos. Algunas células parecen contener vacuolas intracitoplasmáticas. El tamaño de los núcleos es variable dentro de cada grupo de células. 40x
Figura 37
PAAF de mama, carcinoma ductal.
Este campo de visión muestra células tumorales que se disponen de forma aislada o en pequeños grupos. Algunas células parecen contener vacuolas intracitoplasmáticas. El tamaño de los núcleos es variable dentro de cada grupo de células.
40x
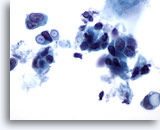
Figura 38
PAAF de mama, carcinoma ductal.
Estas células malignas exhiben vacuolas intracitoplsmáticas claramente definidas, algunas de las cuales tienen una apariencia de diana. Aunque esta característica suele describirse como propia del carcinoma lobulillar, también puede observarse en el carcinoma ductal. 60x
Figura 38
PAAF de mama, carcinoma ductal.
Estas células malignas exhiben vacuolas intracitoplsmáticas claramente definidas, algunas de las cuales tienen una apariencia de diana. Aunque esta característica suele describirse como propia del carcinoma lobulillar, también puede observarse en el carcinoma ductal.
60x
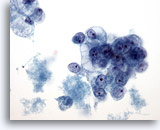
Figura 39
PAAF de mama, carcinoma ductal de grado 2.
Se observan grupos de células malignas vacuoladas, con núcleos redondos y nucleolos prominentes. Observe la necrosis en el fondo. 40x
Figura 39
PAAF de mama, carcinoma ductal de grado 2.
Se observan grupos de células malignas vacuoladas, con núcleos redondos y nucleolos prominentes. Observe la necrosis en el fondo.
40x
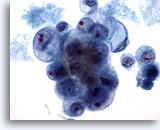
Figura 40
PAAF de mama, carcinoma ductal de grado 2.
Esta imagen proviene del mismo caso que la Figura 39 anterior. Las células tumorales exhiben una marcada variación en el tamaño nuclear y nucleolar. Presencia de necrosis. En la biopsia se describió como un carcinoma ductal moderadamente diferenciado. 60x
Figura 40
PAAF de mama, carcinoma ductal de grado 2.
Esta imagen proviene del mismo caso que la Figura 39 anterior. Las células tumorales exhiben una marcada variación en el tamaño nuclear y nucleolar. Presencia de necrosis. En la biopsia se describió como un carcinoma ductal moderadamente diferenciado.
60x
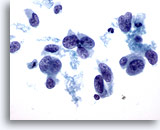
Figura 41
Este campo de visión ilustra la variabilidad en la forma nuclear que puede observarse en el carcinoma ductal. Algunos núcleos son casi fusiformes, mientras que la mayoría de ellos son mucho más grandes que el neutrófilo y el linfocito adyacentes (identificados con la fecha). El patrón de cromatina muestra agrupamiento y aclaramiento. 60x
Figura 41
PAAF de mama, carcinoma ductal de alto grado.
Este campo de visión ilustra la variabilidad en la forma nuclear que puede observarse en el carcinoma ductal. Algunos núcleos son casi fusiformes, mientras que la mayoría de ellos son mucho más grandes que el neutrófilo y el linfocito adyacentes. El patrón de cromatina muestra agrupamiento y aclaramiento. 60x
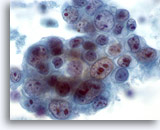
Figura 42
PAAF de mama, carcinoma ductal de alto grado.
Éste es otro ejemplo de pleomorfismo en el carcinoma ductal. Este grupo de células tumorales contiene núcleos de tamaño variable. Algunas células presentan múltiples nucleolos grandes. Se observa necrosis en el fondo. 60x
Figura 42
PAAF de mama, carcinoma ductal de alto grado.
Éste es otro ejemplo de pleomorfismo en el carcinoma ductal. Este grupo de células tumorales contiene núcleos de tamaño variable. Algunas células presentan múltiples nucleolos grandes. Se observa necrosis en el fondo.
60x
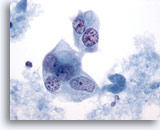
Figura 43
PAAF de mama, carcinoma ductal de alto grado.
Las células malignas de este campo de visión son multinucleadas con núcleos pálidos que muestran cromatina agrupada y aclarada. 60x
Figura 43
PAAF de mama, carcinoma ductal de alto grado.
Las células malignas de este campo de visión son multinucleadas con núcleos pálidos que muestran cromatina agrupada y aclarada.
60x
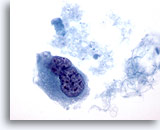
Figura 44
PAAF de mama, carcinoma ductal de alto grado.
Esta imagen proviene del mismo caso que la Figura 43 anterior y muestra una célula binucleada con núcleo hipercromático y cromatina agrupada y aclarada. 60x
Figura 44
PAAF de mama, carcinoma ductal de alto grado.
Esta imagen proviene del mismo caso que la Figura 43 anterior y muestra una célula binucleada con núcleo hipercromático y cromatina agrupada y aclarada.
60x
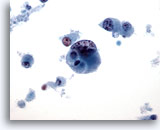
Figura 45
PAAF de mama, carcinoma ductal de alto grado.
Éste es un ejemplo de carcinoma ductal poco diferenciado de alto grado. las células están dispuestas de forma aislada, la cromatina es anormal y los nucleolos son visibles, y existe necrosis celular en el fondo. 40x
Figura 45
PAAF de mama, carcinoma ductal de alto grado.
Éste es un ejemplo de carcinoma ductal poco diferenciado de alto grado. las células están dispuestas de forma aislada, la cromatina es anormal y los nucleolos son visibles, y existe necrosis celular en el fondo.
40x
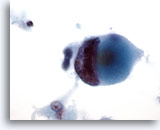
Figura 46
PAAF de mama, carcinoma ductal de alto grado.
Observe el marcado agrupamiento y aclaramiento de la cromatina en esta célula maligna procedente del mismo caso que el de la Figura 45 anterior. 60x
Figura 46
PAAF de mama, carcinoma ductal de alto grado.
Observe el marcado agrupamiento y aclaramiento de la cromatina en esta célula maligna procedente del mismo caso que el de la Figura 45 anterior. 60x
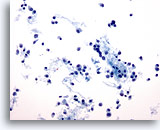
Figura 47
PAAF de mama, carcinoma lobulillar.
Los aspirados de carcinoma lobulillar tienden a ser escasamente celulares, aunque ocasionalmente contienen numerosas células como las de este ejemplo. Las células tumorales son aisladas, pero pueden formar pequeños agregados, a menudo con una apariencia de ‘fila india’. 20x
Figura 47
PAAF de mama, carcinoma lobulillar.
Los aspirados de carcinoma lobulillar tienden a ser escasamente celulares, aunque ocasionalmente contienen numerosas células como las de este ejemplo. Las células tumorales son aisladas, pero pueden formar pequeños agregados, a menudo con una apariencia de ‘fila india’.
20x
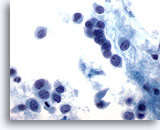
Figura 48
PAAF de mama, carcinoma lobulillar.
Las células neoplásicas suelen ser pequeñas, con contorno nuclear redondeado a irregular y núcleos excéntricos, produciendo una apariencia plasmacitoide como la ilustrada en esta imagen. 60x
Figura 48
PAAF de mama, carcinoma lobulillar.
Las células neoplásicas suelen ser pequeñas, con contorno nuclear redondeado a irregular y núcleos excéntricos, produciendo una apariencia plasmacitoide como la ilustrada en esta imagen.
60x
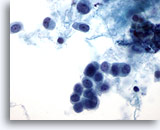
Figura 49
PAAF de mama, carcinoma lobulillar.
Aquí se muestran células con una apariencia plasmacitoide y núcleos redondos. El material de fondo parece tener naturaleza proteinácea, en lugar de necrótica. En el centro del campo de visión se observa una pequeña fila de 3 células. 60x
Figura 49
PAAF de mama, carcinoma lobulillar.
Aquí se muestran células con una apariencia plasmacitoide y núcleos redondos. El material de fondo parece tener naturaleza proteinácea, en lugar de necrótica. En el centro del campo de visión se observa una pequeña fila de 3 células.
60x
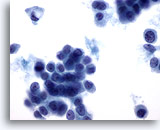
Figura 50
PAAF de mama, carcinoma lobulillar.
Las vacuolas intracitoplasmáticas se observan normalmente en los aspirados de carcinoma lobulillar, como en la célula aislada que aparece en la esquina superior izquierda. Las vacuolas no son exclusivas del carcinoma lobulillar, ya que también pueden observarse en el carcinoma ductal. 60x
Figura 50
PAAF de mama, carcinoma lobulillar.
Las vacuolas intracitoplasmáticas se observan normalmente en los aspirados de carcinoma lobulillar, como en la célula aislada que aparece en la esquina superior izquierda. Las vacuolas no son exclusivas del carcinoma lobulillar, ya que también pueden observarse en el carcinoma ductal.
60x
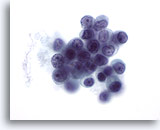
Figura 51
PAAF de mama, carcinoma lobulillar.
Aunque los nucleolos no se observan normalmente en el carcinoma lobulillar (excepto en el carcinoma lobulillar pleomórfico), pueden aparecer en algunas ocasiones. 60x
Figura 51
PAAF de mama, carcinoma lobulillar.
Aunque los nucleolos no se observan normalmente en el carcinoma lobulillar (excepto en el carcinoma lobulillar pleomórfico), pueden aparecer en algunas ocasiones.
60x
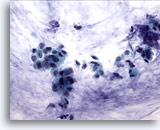
Figura 52
PAAF de mama, carcinoma coloide (mucinoso). Grupos de células pequeñas y algunas células aisladas aparecen en el fondo de mucina. Es preferible describir estos casos como carcinomas ductales que muestran una diferenciación mucinosa, que como carcinomas coloides o mucinosos, ya que el diagnóstico depende de la producción de mucina que muestre el tumor en su totalidad. 40x
Figura 52
PAAF de mama, carcinoma coloide (mucinoso).
Grupos de células pequeñas y algunas células aisladas aparecen en el fondo de mucina. Es preferible describir estos casos como carcinomas ductales que muestran una diferenciación mucinosa, que como carcinomas coloides o mucinosos, ya que el diagnóstico depende de la producción de mucina que muestre el tumor en su totalidad.
40x
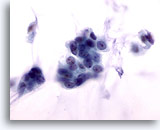
Figura 53
PAAF de mama, carcinoma coloide.
Las células malignas de esta lesión son blandas, con contorno nuclear homogéneo, cromatina uniformemente distribuida y nucleolos no visibles. Si no se observa la mucina, las células pueden considerarse erróneamente como benignas. 60x
Figura 53
PAAF de mama, carcinoma coloide..
Las células malignas de esta lesión son blandas, con contorno nuclear homogéneo, cromatina uniformemente distribuida y nucleolos no visibles. Si no se observa la mucina, las células pueden considerarse erróneamente como benignas.
60x
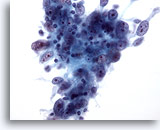
Figura 54
PAAF de mama, carcinoma medular.
Los aspirados con aguja fina de estos tumores presentan, normalmente, grupos de grandes células tumorales pleomórficas con nucleolos prominentes, mezclados con linfocitos como los aquí mostrados. También pueden observarse células plasmáticas. 40x
Figura 54
PAAF de mama, carcinoma medular.
Los aspirados con aguja fina de estos tumores presentan, normalmente, grupos de grandes células tumorales pleomórficas con nucleolos prominentes, mezclados con linfocitos como los aquí mostrados. También pueden observarse células plasmáticas.
40x
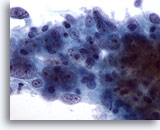
Figura 55
PAAF de mama, carcinoma medular.
Este grupo de células muestra grandes nucleolos centrales y una cromatina anormal. También se observan linfocitos. 60x
Figura 55
PAAF de mama, carcinoma medular.
Este grupo de células muestra grandes nucleolos centrales y una cromatina anormal. También se observan linfocitos.
60x
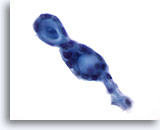
Figura 56
PAAF de mama, carcinoma adenoide quístico.
Estos tumores se caracterizan por contener material hialino extracelular en formas globulares o cilíndricas/tubulares, rodeado de pequeñas células neoplásicas blandas. En este campo de visión se observan dos estructuras globulares adyacentes. 60x
Figura 56
PAAF de mama, carcinoma adenoide quístico.
Estos tumores se caracterizan por contener material hialino extracelular en formas globulares o cilíndricas/tubulares, rodeado de pequeñas células neoplásicas blandas. En este campo de visión se observan dos estructuras globulares adyacentes.
60x
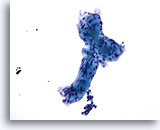
Figura 57
PAAF de mama, carcinoma adenoide quístico.
Aquí se ilustra perfectamente el material hialino extracelular, que forma un túbulo indistinto con dos estructuras globulares unidas. 20x
Figura 57
PAAF de mama, carcinoma adenoide quístico.
Aquí se ilustra perfectamente el material hialino extracelular, que forma un túbulo indistinto con dos estructuras globulares unidas.
20x

Figura 58
PAAF de mama, carcinoma adenoide quístico.
Este campo de visión ilustra una recogida de glóbulos hialinos con superposición de células tumorales pequeñas. El diagnóstico diferencial es esferulosis colágena, una lesión benigna en la que los glóbulos hialinos van acompañados de células ductales benignas o hiperplásicas. 60x
Figura 58
PAAF de mama, carcinoma adenoide quístico.
Este campo de visión ilustra una recogida de glóbulos hialinos con superposición de células tumorales pequeñas. El diagnóstico diferencial es esferulosis colágena, una lesión benigna en la que los glóbulos hialinos van acompañados de células ductales benignas o hiperplásicas.
60x
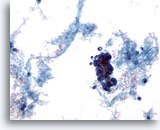
Figura 59
PAAF de mama, quiste maligno.
No todos los quistes son benignos. Algunos carcinomas ductales pueden presentarse como lesiones quísticas, como en este ejemplo. La imagen a bajo aumento muestra material proteináceo, sangre y un grupo de células hipercromáticas. 20x
Figura 59
PAAF de mama, quiste maligno.
No todos los quistes son benignos. Algunos carcinomas ductales pueden presentarse como lesiones quísticas, como en este ejemplo. La imagen a bajo aumento muestra material proteináceo, sangre y un grupo de células hipercromáticas.
20x
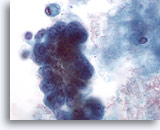
Figura 60
PAAF de mama, quiste maligno.
En la imagen a gran aumento, el grupo de células mostrado en le Figura 59 anterior muestra pleomorfismo, nucleolos visibles y vacuolización. La biopsia por escisión determinó que se trataba de un carcinoma ductal. 60x
Figura 60
PAAF de mama, quiste maligno.
En la imagen a gran aumento, el grupo de células mostrado en le Figura 59 anterior muestra pleomorfismo, nucleolos visibles y vacuolización. La biopsia por escisión determinó que se trataba de un carcinoma ductal.
60x
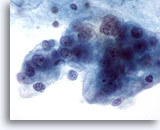
Figura 61
PAAF de mama, quiste maligno.
Éste es otro ejemplo de carcinoma ductal diagnosticado a partir de un aspirado quístico. Este campo de visión muestra células malignas vacuoladas marcadamente pleomórficas con nucleolos y cromatina anorma. 60x
Figura 61
PAAF de mama, quiste maligno.
Éste es otro ejemplo de carcinoma ductal diagnosticado a partir de un aspirado quístico. Este campo de visión muestra células malignas vacuoladas marcadamente pleomórficas con nucleolos y cromatina anorma.
60x
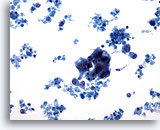
Figura 62
PAAF de mama, quiste maligno.
Este campo de visión muestra un grupo hipercromático de células epiteliales con muchos restos celulares en el fondo, sospechoso de ser un carcinoma. 20x
Figura 62
PAAF de mama, quiste maligno.
Este campo de visión muestra un grupo hipercromático de células epiteliales con muchos restos celulares en el fondo, sospechoso de ser un carcinoma.
20x
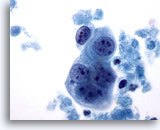
Figura 63
PAAF de mama, quiste maligno.
Aquí se observa un pequeño grupo de células tumorales, con nucleolos prominentes y contorno nuclear bastante homogéneo. Observe la necrosis circundante. 60x
Figura 63
PAAF de mama, quiste maligno.
Aquí se observa un pequeño grupo de células tumorales, con nucleolos prominentes y contorno nuclear bastante homogéneo. Observe la necrosis circundante.
60x
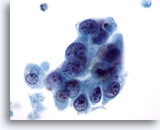
Figura 64
PAAF de mama, quiste maligno.
Esta imagen proviene del mismo caso que la Figura 63 anterior. Las células muestran superposición, pero también un indicio de separación, contorno nuclear irregular, cromatina anormal y nucleolos visibles. 60x
Figura 64
PAAF de mama, quiste maligno.
Esta imagen proviene del mismo caso que la Figura 63 anterior. Las células muestran superposición, pero también un indicio de separación, contorno nuclear irregular, cromatina anormal y nucleolos visibles.
60x
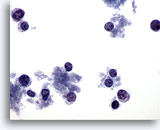
Figura 65
PAAF de mama, linfoma.
Este campo de visión muestra células dispersas con muy poco citoplasma. No hay presencia de grupos. Las células tienen núcleos redondos con un contorno de citoplasma a un lado. Las características mostradas lo hacen parecer linfoide más que epitelial. 40x
Figura 65
PAAF de mama, linfoma.
Este campo de visión muestra células dispersas con muy poco citoplasma. No hay presencia de grupos. Las células tienen núcleos redondos con un contorno de citoplasma a un lado. Las características mostradas lo hacen parecer linfoide más que epitelial.
40x
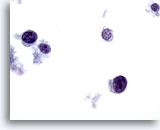
Figura 66
PAAF de mama, linfoma.
En la visión a gran aumento, las células se ven como linfoides con una patrón de cromatina característico. La tinción inmunocitoquímica como la realizada con Antígeno Leucocitario Común (LCA) en un portaobjetos ThinPrep no teñido confirmaría el diagnóstico. 60x
Figura 66
PAAF de mama, linfoma.
En la visión a gran aumento, las células se ven como linfoides con una patrón de cromatina característico. La tinción inmunocitoquímica como la realizada con Antígeno Leucocitario Común (LCA) en un portaobjetos ThinPrep no teñido confirmaría el diagnóstico.
60x


































































