Ocasionalmente, se puede aspirar un nódulo dominante en la cirrosis como parte de una evaluación de una masa 1, 2. Una característica citológica importante de un nódulo cirrótico es la apariencia variable, en lugar de uniforme, de las células hepáticas en las diapositivas ThinPrep. Características atípicas ocasionales incluyen un aumento del tamaño nuclear, y puede observarse binucleación y anisonucleosis, que son útiles a la hora de diagnosticar la cirrosis, ya que la apariencia polimorfa de la población de células hepáticas es una característica de benignidad, de hepatocitos reactivos frente a la atípia uniforme del carcinoma hepatocelular. Además de la celularidad variable de las células hepáticas con cirrosis, se muestran una trabécula fina y unas cuerdas que no midan más de dos células de grosor, y las células presentan baja relación núcleo/citoplasma. También pueden observarse los conductos biliares, junto con células inflamatorias ocasionales y tejido fibroso. 1, 2
Los aspirados de carcinoma hepatocelular preparados para ThinPrep muestran células con una relación núcleo/citoplasma uniformemente elevada y dispuestas en ramificaciones complejas, que anastomosan la trabécula gruesa y que presentan contornos periféricos finamente demarcados. La trabécula contiene más de cuatro células de grosor, y existe una envolvente endotelial periférica, así como las denominadas células endoteliales “transgresoras”. A menudo aparecen células aisladas dispersas y pequeños grupos, junto con núcleos hepatocíticos atípicos desnudos. De forma ocasional se puede observar el pigmento biliar 1, 2, 6, 7, 8, 9, 10, 11, 12, 13 .
Ocasionalmente, se pueden encontrar variantes de carcinoma hepatocelular, incluyendo el carcinoma hepatocelular fibrolamelar, los colangiocarcinomas y carcinomas hepatocelulares mezclados y de subtipos de células pequeñas y células aclaradas. Las características citológicas de estas variantes están perfectamente descritas en los libros de texto comunes. 1, 2
Los aspirados de tumores hepatocelulares benignos como el adenoma o la hiperplasia nodular focal están constituidos por células hepáticas indistintas de los hepatocitos del hígado circundante no destacable de las diapositivas ThinPrep. 1, 2 En la hiperplasia nodular focal existen fragmentos de tejido fibroso y conductos biliares, que no se aprecian en los adenomas.
Debido a la ausencia de hallazgos atípicos, no es posible realizar un diagnóstico específico de adenoma o de hiperplasia nodular focal a partir de las muestras de aspiración con aguja fina. Por ello, es necesario correlacionar los hallazgos citológicos con la colocación de la aguja.
Por último, los aspirados hepáticos de carcinoma metastásico son bastante comunes, ya que el hígado es la segunda zona abdominal más común para encontrar malignidades metastásicas, seguido de los nódulos linfáticos. Los adenomas metastásicos constituyen más del 90% de todas las neoplasias hepáticas malignas. Los adenocarcinomas de diferentes zonas son los principales tipos histológicos de carcinoma metastásico que afectan al hígado, siendo el carcinoma colorectal el que presenta un predominio especialmente elevado. Las características citomorfológicas del adenocarcinoma metastásico son bastante similares a las características citológicas observadas en el colangiocarcinoma primario. Las preparaciones PAAF de adenocarcinomas suelen estar constituidas por agregados cohesionados de células malignas en los que se puede observar la formación de glándulas. Las células con forma cuboidal a columnar tienen un citoplasma pálido delicado y núcleos redondos a irregulares colocados en la periferia con presencia de nucleolos prominentes. El carcinoma colorectal suele llevar asociado una “necrosis sucia” en el fondo, en contraste con el fondo limpio de los colangiocarcinomas. Además, se pueden encontrar cánceres de otros tipos de células, incluyendo el carcinoma metastásico de célula pequeña, melanoma, linfoma maligno y tumores mesenquimales. 1, 2
Las biopsias por PAAF percutáneas, intraoperatorias y endoscópicas guiadas por ultrasonido (EUS) se están utilizando cada vez más para evaluar las masas quísticas y sólidas del páncreas 1, 2, 14, 15. La aspiración con aguja fina presenta claras ventajas con respecto a las biopsias con trocar y a las resecciones en cuña del páncreas, ya que estos últimos procedimientos pueden producir, potencialmente, pancreatitis y/o peritonitis debidas al vertido de enzimas exocrinas y bilis 16. La PAAF del páncreas también puede ser útil en el diagnóstico de una lesión pancreática inflamatoria, obviando la necesidad de un proceso quirúrgico. Por ello, el citopatólogo debe conocer las características citológicas y el espectro de cambios observados en el epitelio pancreático acinar y ductal benigno 1, 2, 17. De modo característico, las células pancreáticas ductales están dispuestas en placas planas en panal de abeja con núcleos redondos a ovalados espaciados uniformemente y con contornos celulares bien definidos. Las células acinares tienden a disponerse en pequeños agregados cohesionados, formados por células con pequeños núcleos uniformes situados basalmente y con cromatina finamente granular a agrupada con nucleolos discretos rodeados por una cantidad moderada de citoplasma granular. En los aspirados no suelen apreciarse células de islote 1, 2, 14, 18.
Los aspirados de los pseudoquistes pancreáticos presentan, en general, escasa celularidad con pocas o ninguna célula epitelial, aunque pueden presentar células inflamatorias agudas y crónicas, histiocitos, restos celulares del fondo y tejido de granulación con fragmentos de calcificación 1, 2. Las características citomorfológicas de la pancreatitis aguda incluyen una celularidad moderada a elevada constituida fundamentalmente por neutrófilos del frotis junto con un fondo “sucio”1, 2. Las células ductales y/o acinares pueden mostrar una atípia reparativa y/o inflamatoria, y se puede apreciar necrosis grasa. En contraposición, los aspirados de pancreatitis crónica presentan, en general, una celularidad relativamente baja con tan solo unas pocas células ductales que no tienden a mostrar el grado de características atípicas y/o reactivas observadas en la pancreatitis aguda 1, 2. Aparecerán también células inflamatorias crónicas.
Es necesario apreciar las características citomorfológicas del adenocarcinoma pancreático, ya que se trata de una malignidad común, que constituye aproximadamente el 3% de todos los cánceres y el 5% de la mortalidad por cáncer. 18, 19. Casi las ¾ partes de todos los adenocarcinomas pancreáticos son de tipo ductal. Las características citomorfológicas de los adenocarcinomas ductales de las preparaciones ThinPrep incluyen una elevada celularidad con células atípicas dispuestas de forma aislada y en grupos. 1, 2 Dentro de los grupos celulares se observa una disposición sincitial de las células junto con la pérdida de polaridad nuclear. Se puede observar tanto el aumento nuclear como el citoplasmático. Los núcleos tienden a ser hipercromáticos con cromatina y contornos nucleares irregulares, junto con surcos nucleares ocasionales. Se puede observar una variación considerable del tamaño nuclear, así como nucleolos prominentes. El fondo suele contener una diátesis tumoral.
Entre las variantes poco comunes del adenocarcinoma pancreático se incluyen el carcinoma anaplásico (carcinoma pleomórfico de células gigantes), que presenta una población marcadamente pleomórfica, incluyendo las células malignas gigantes y/o fusiformes, y el tumor pancreático de células gigantes dispersas de tipo osteoclástico, que está formado por células gigantes de tipo osteoclástico dispersas y multinucleadas con núcleos agrupados centralmente y con una cantidad moderada de citoplasma circundante, así como una aparición similar de células mononucleadas. 1, 2
Los aspirados de neoplasias de células de islote tienden a ser celulares, constituidos por una población monomórfica de células pequeñas uniformes dispuestas predominantemente en un patrón no cohesionado. Las células tumorales son pequeñas, con núcleos redondos a ovalados con cromatina granular fina a gruesa distribuida de forma uniforme y nucleolos discretos. Los núcleos se colocan excéntricamente dentro de estas células. En contraste, los aspirados de los muy poco comunes carcinomas de células acinares presentan células dispuestas de forma lobular y tienen núcleos hipercromáticos con cromatina agrupada y nucleolos prominentes. 1, 2. Tanto las células de islote como las acinares presentan citoplasma granular. Las características citomorfológicas del tumor quístico-papilar incluyen la formación de estructuras papilares con ejes fibrovasculares alineados por una o más capas de células epiteliales con cromatina pálida, delicadas membranas nucleares y surcos nucleares longitudinales ocasionales. 1, 2 Por el contrario, las neoplasias quísticas mucinosas presentan núcleos que varían desde blandos, hasta atípicos y/o francamente malignos 1, 2. Las células pueden estar dispuestas de forma aislada, en grupos planos en panal de abeja o en grupos tridimensionales asociados con abundante material mucinoso intracelular y/o extracelular. Otras lesiones poco comunes que han sido descritas en la literatura sobre PAAF incluyen los aspirados de cistadenomas serosos y pancreatoblastomas. 1, 2, 20 Por último, pueden describirse PAAF de malignidades metastáticas que afectan al páncreas 21
Nota: Puede clicar en cualquier imagen del
Atlas para ver la imagen aumentada
Hígado
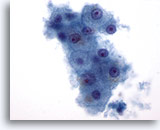
Figura 1: PAAF de hígado, hepatocitos benignos.
Un pequeño grupo de hepatocitos benignos formado por células poligonales a redondas con contornos celulares bien definidos y núcleos situados centralmente con citoplasma granular circundante. También existe pigmentación intracitoplásmica. Aunque se observan pequeños nucleolos, no existe evidencia de atípia ni de aumento de la relación núcleo/citoplasma. 60x
Figura 1
PAAF de hígado, hepatocitos benignos
Un pequeño grupo de hepatocitos benignos formado por células poligonales a redondas con contornos celulares bien definidos y núcleos situados centralmente con citoplasma granular circundante. También existe pigmentación intracitoplásmica. Aunque se observan pequeños nucleolos, no existe evidencia de atípia ni de aumento de la relación núcleo/citoplasma.
60x
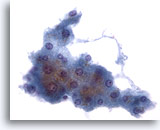
Figura 2: PAAF de hígado, hepatocitos benignos.
Grupo de hepatocitos reactivos benignos formado por células con forma cuboidal con contornos celulares bien definidos y citoplasma opaco vacuolado y algo granular. Observe los bordes desflecados de este grupo. Los núcleos muestran una pequeña variación de tamaño y aparece una célula binucleada ocasional. También se observan pequeños nucleolos. 40x
Figura 2
PAAF de hígado, hepatocitos benignos
Grupo de hepatocitos reactivos benignos formado por células con forma cuboidal con contornos celulares bien definidos y citoplasma opaco vacuolado y algo granular. Observe los bordes desflecados de este grupo. Los núcleos muestran una pequeña variación de tamaño y aparece una célula binucleada ocasional. También se observan pequeños nucleolos.
40x
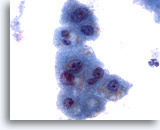
Figura 3
PAAF de hígado, hepatocitos benignos
Observe las ligeras variaciones en el tamaño nuclear, así como la baja relación núcleo/citoplasma, que son típicas de los hepatocitos reactivos. También existe evidencia de vacuolización citoplasmática fina y de pigmento intracitoplasmático. 60x
Figura 3
PAAF de hígado, hepatocitos benignos
Observe las ligeras variaciones en el tamaño nuclear, así como la baja relación núcleo/citoplasma, que son típicas de los hepatocitos reactivos. También existe evidencia de vacuolización citoplasmática fina y de pigmento intracitoplasmático.
60x
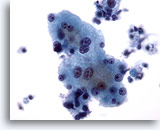
Figura 4
PAAF de hígado, hepatocitos benignos
Hepatocitos reactivos que muestran variaciones en el tamaño nuclear, así como binucleación. 40x
Figura 4
PAAF de hígado, hepatocitos benignos
Hepatocitos reactivos que muestran variaciones en el tamaño nuclear, así como binucleación.
40x
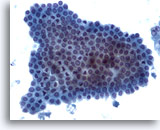
Figura 5
PAAF de hígado, células ductales benignas
Un grupo de células ductales biliares benignas que presenta una disposición en panal de abeja con pequeños núcleos uniformes. 20x
Figura 5
PAAF de hígado, células ductales benignas
Un grupo de células ductales biliares benignas que presenta una disposición en panal de abeja con pequeños núcleos uniformes.
20x
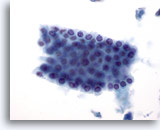
Figura 6
PAAF de hígado, células ductales benignas.
Grupo de células ductales biliares benignas dispuestas en forma de panal de abeja. Las células son cuboidales con núcleos pequeños uniformemente espaciados. Las células ductales presentan mayor relación núcleo/citoplasma que los hepatocitos y también se observa la ausencia de granularidad citoplasmática, de vacuolización y/o de pigmento. 40x
Figura 6
PAAF de hígado, células ductales benignas
Grupo de células ductales biliares benignas dispuestas en forma de panal de abeja. Las células son cuboidales con núcleos pequeños uniformemente espaciados. Las células ductales presentan mayor relación núcleo/citoplasma que los hepatocitos y también se observa la ausencia de granularidad citoplasmática, de vacuolización y/o de pigmento.
40x
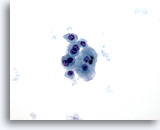
Figura 7
PAAF de hígado, cirrosis
Grupo poco rígido de hepatocitos benignos que muestran binucleación, con baja relación núcleo/citoplasma. 40x
Figura 7
PAAF de hígado, cirrosis
Grupo poco rígido de hepatocitos benignos que muestran binucleación, con baja relación núcleo/citoplasma.
40x
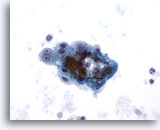
Figura 8
PAAF de hígado, cirrosis
Grupo poco rígido de hepatocitos reactivos benignos procedente de un nódulo cirrótico. Observe la binucleación con nucleolos prominentes, pero con relaciones núcleo/citoplasma que siguen siendo bajas. 40x
Figura 8
PAAF de hígado, cirrosis
Grupo poco rígido de hepatocitos reactivos benignos procedente de un nódulo cirrótico. Observe la binucleación con nucleolos prominentes, pero con relaciones núcleo/citoplasma que siguen siendo bajas.
40x
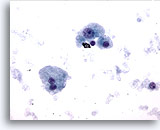
Figura 9
PAAF de hígado, cirrosis
Hepatocitos benignos asilados dispersos procedentes de un nódulo cirrótico. Existe variación en el tamaño nuclear pero no irregularidad nuclear. Aparece un hepatocito binucleado. La relación núcleo/citoplasma sigue siendo baja. 40x
Figura 9
PAAF de hígado, cirrosis
Hepatocitos benignos asilados dispersos procedentes de un nódulo cirrótico. Existe variación en el tamaño nuclear pero no irregularidad nuclear. Aparece un hepatocito binucleado. La relación núcleo/citoplasma sigue siendo baja.
40x
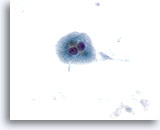
Figura 10
PAAF de hígado, cirrosis
Hepatocitos benignos binucleados aislados y dispersos procedentes de un nódulo cirrótico. 40x
Figura 10
PAAF de hígado, cirrosis
Hepatocitos benignos binucleados aislados y dispersos procedentes de un nódulo cirrótico.
40x
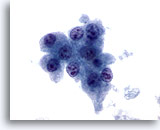
Figura 11
PAAF de hígado, carcinoma hepatocelular.
Hepatocitos procedentes de un carcinoma hepatocelular que muestran atípia uniforme, incluyendo una mayor relación núcleo/citoplasma y unos núcleos que poseen múltiples nucleolos irregulares. 60x
Figura 11
PAAF de hígado, carcinoma hepatocelular.
Hepatocitos procedentes de un carcinoma hepatocelular que muestran atípia uniforme, incluyendo una mayor relación núcleo/citoplasma y unos núcleos que poseen múltiples nucleolos irregulares.
60x
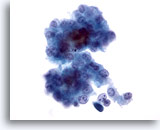
Figura 12
PAAF de hígado, carcinoma hepatocelular.
Grupo poco rígido de hepatocitos malignos procedentes de un aspirado de carcinoma hepatocelular. Existe atípia uniforme con una mayor relación núcleo/citoplasma. Se observan algunos pigmentos biliares entre los hepatocitos. 40x
Figura 12
PAAF de hígado, carcinoma hepatocelular.
Grupo poco rígido de hepatocitos malignos procedentes de un aspirado de carcinoma hepatocelular. Existe atípia uniforme con una mayor relación núcleo/citoplasma. Se observan algunos pigmentos biliares entre los hepatocitos.
40x
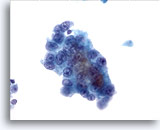
Figura 13
PAAF de hígado, carcinoma hepatocelular.
Carcinoma hepatocelular bien diferenciado en el que las células hepáticas muestran mayor relación núcleo/citoplasma y una atípia uniforme. 40x
Figura 13
PAAF de hígado, carcinoma hepatocelular.
Carcinoma hepatocelular bien diferenciado en el que las células hepáticas muestran mayor relación núcleo/citoplasma y una atípia uniforme.
40x
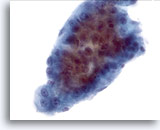
Figura 14
PAAF de hígado, carcinoma hepatocelular.
Un grupo de células de carcinoma hepatocelular formado por trabéculas gruesas con contornos periféricos finamente demarcados, típicos del carcinoma hepatocelular. También existe atípia uniforme de los hepatocitos. 40x
Figura 14
PAAF de hígado, carcinoma hepatocelular.
Un grupo de células de carcinoma hepatocelular formado por trabéculas gruesas con contornos periféricos finamente demarcados, típicos del carcinoma hepatocelular. También existe atípia uniforme de los hepatocitos.
40x
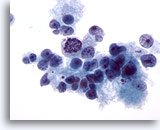
Figura 15
PAAF de hígado, carcinoma hepatocelular.
Carcinoma hepatocelular poco diferenciado en el que se muestran hepatocitos malignos poco cohesionados, así como variaciones considerables del tamaño y de la forma nucleares. 40x
Figura 15
PAAF de hígado, carcinoma hepatocelular.
Carcinoma hepatocelular poco diferenciado en el que se muestran hepatocitos malignos poco cohesionados, así como variaciones considerables del tamaño y de la forma nucleares.
40x
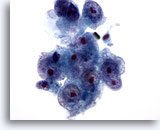
Figura 16
PAAF de hígado, carcinoma hepatocelular.
Carcinoma hepatocelular poco diferenciado que muestra hepatocitos con elevada relación núcleo/citoplasma e irregularidad nuclear. También se muestran múltiples nucleolos prominentes. 60x
Figura 16
PAAF de hígado, carcinoma hepatocelular.
Carcinoma hepatocelular poco diferenciado que muestra hepatocitos con elevada relación núcleo/citoplasma e irregularidad nuclear. También se muestran múltiples nucleolos prominentes.
60x
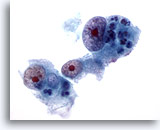
Figura 17
PAAF de hígado, carcinoma hepatocelular.
Carcinoma hepatocelular poco diferenciado en el que los hepatocitos muestran un marcado aumento del tamaño nuclear con irregularidad nuclear y nucleolos muy prominentes. 60x
Figura 17
PAAF de hígado, carcinoma hepatocelular.
Carcinoma hepatocelular poco diferenciado en el que los hepatocitos muestran un marcado aumento del tamaño nuclear con irregularidad nuclear y nucleolos muy prominentes.
60x
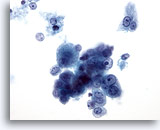
Figura 18: PAAF de hígado, carcinoma hepatocelular.
Grupo poco rígido de hepatocitos malignos aislados y dispersos que muestran una atípia uniforme. Las células hepáticas retienen sus propiedades hepatocíticas caracterizadas por una forma más cuboidal con nucleolos situados centralmente. Se observan células tumorales binucleadas. Se ha detectado una incremento en la relación núcleo/citoplasma. 40x
Figura 18
PAAF de hígado, carcinoma hepatocelular.
Grupo poco rígido de hepatocitos malignos aislados y dispersos que muestran una atípia uniforme. Las células hepáticas retienen sus propiedades hepatocíticas caracterizadas por una forma más cuboidal con nucleolos situados centralmente. Se observan células tumorales binucleadas. Se ha detectado una incremento en la relación núcleo/citoplasma.
40x
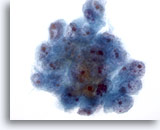
Figura 19
PAAF de hígado, carcinoma hepatocelular.
Grupo de células malignas de un aspirado de carcinoma hepatocelular. Observe el aumento del tamaño nuclear, la distribución irregular de la cromatina y la presencia de uno o más nucleolos, así como el incremento en la relación núcleo/citoplasma. 40x
Figura 19
PAAF de hígado, carcinoma hepatocelular.
Grupo de células malignas de un aspirado de carcinoma hepatocelular. Observe el aumento del tamaño nuclear, la distribución irregular de la cromatina y la presencia de uno o más nucleolos, así como el incremento en la relación núcleo/citoplasma.
40x
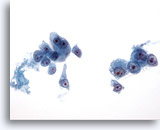
Figura 20
PAAF de hígado, carcinoma hepatocelular.
Células malignas poco cohesionadas a aisladas de un aspirado de carcinoma hepatocelular. Existe una atípi uniforme en la que las células malignas han aumentado su relación núcleo/citoplasma. Observe la presencia de nucleolos prominentes. 40x
Figura 20
PAAF de hígado, carcinoma hepatocelular.
Células malignas poco cohesionadas a aisladas de un aspirado de carcinoma hepatocelular. Existe una atípi uniforme en la que las células malignas han aumentado su relación núcleo/citoplasma. Observe la presencia de nucleolos prominentes.
40x
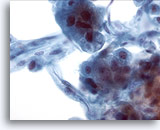
Figura 21
PAAF de hígado, carcinoma hepatocelular.
Aspirado de carcinoma hepatocelular en el que se observan hepatocitos y células endoteliales situadas en la periferia. Las células endoteliales se caracterizan por ser células fusiformes que presentan núcleos alargados y citoplasma indistinto. 40x
Figura 21
PAAF de hígado, carcinoma hepatocelular.
Aspirado de carcinoma hepatocelular en el que se observan hepatocitos y células endoteliales situadas en la periferia. Las células endoteliales se caracterizan por ser células fusiformes que presentan núcleos alargados y citoplasma indistinto.
40x
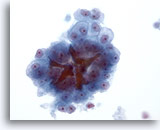
Figura 22
PAAF de hígado, carcinoma hepatocelular.
Carcinoma hepatocelular constituido por hepatocitos atípicos que muestran una atípia uniforme, así como tapones de bilis. 40x
Figura 22
PAAF de hígado, carcinoma hepatocelular.
Carcinoma hepatocelular constituido por hepatocitos atípicos que muestran una atípia uniforme, así como tapones de bilis.
40x
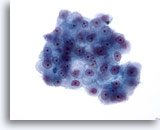
Figura 23
PAAF de hígado, carcinoma hepatocelular.
Grupo de células malignas que presentan una mayor relación núcleo/citoplasma con núcleos cuya forma varía de oval a casi irregular. También se observa la presencia de nucleolos prominentes. El citoplasma varía de granular a pálido, y aparecen contornos citoplasmáticos angulosos. 40x
Figura 23
PAAF de hígado, carcinoma hepatocelular.
Grupo de células malignas que presentan una mayor relación núcleo/citoplasma con núcleos cuya forma varía de oval a casi irregular. También se observa la presencia de nucleolos prominentes. El citoplasma varía de granular a pálido, y aparecen contornos citoplasmáticos angulosos.
40x
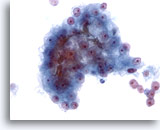
Figura 24
PAAF de hígado, carcinoma hepatocelular.
Grupo de células malignas de un aspirado de carcinoma hepatocelular en el que se observan tapones de bilis. Aunque la presencia de bilis es una característica específica del carcinoma hepatocelular, sólo se observa en una minoría de casos. 40x
Figura 24
PAAF de hígado, carcinoma hepatocelular.
Grupo de células malignas de un aspirado de carcinoma hepatocelular en el que se observan tapones de bilis. Aunque la presencia de bilis es una característica específica del carcinoma hepatocelular, sólo se observa en una minoría de casos.
40x
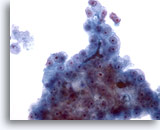
Figura 25
PAAF de hígado, carcinoma hepatocelular.
Otro ejemplo de taponamiento de bilis en un aspirado de carcinoma hepatocelular. 40x
Figura 25
PAAF de hígado, carcinoma hepatocelular.
Otro ejemplo de taponamiento de bilis en un aspirado de carcinoma hepatocelular.
40x
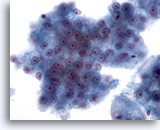
Figura 26
PAAF de hígado, carcinoma hepatocelular.
Grupos de hepatocitos malignos que muestran atápia uniforme. 40x
Figura 26
PAAF de hígado, carcinoma hepatocelular.
Grupos de hepatocitos malignos que muestran atápia uniforme.
40x
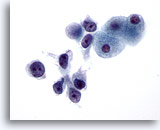
Figura 27
PAAF de hígado, carcinoma hepatocelular.
Carcinoma hepatocelular poco diferenciado que presenta un patrón disociativo con células malignas que muestran una relación núcleo/citoplasma marcadamente superior. 60x
Figura 27
PAAF de hígado, carcinoma hepatocelular.
Carcinoma hepatocelular poco diferenciado que presenta un patrón disociativo con células malignas que muestran una relación núcleo/citoplasma marcadamente superior.
60x
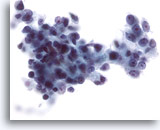
Figura 28
PAAF de hígado, carcinoma hepatocelular.
Carcinoma hepatocelular poco diferenciado en el que las células malignas han aumentado de forma remarcable su relación núcleo/citoplasma. También se observa una irregularidad nuclear considerable. 40x
Figura 28
PAAF de hígado, carcinoma hepatocelular.
Carcinoma hepatocelular poco diferenciado en el que las células malignas han aumentado de forma remarcable su relación núcleo/citoplasma. También se observa una irregularidad nuclear considerable.
40x
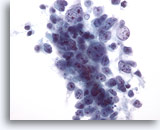
Figura 29: PAAF de hígado, carcinoma hepatocelular.
Aspirado de carcinoma hepatocelular en el que las células tumorales están poco cohesionadas. A medida que los carcinomas hepatocelulares están menos diferenciados, muestran un mayor grado de descohesión y pierden parte de las características “hepatocelulares”. Por ello, el diagnóstico diferencial de un carcinoma hepatocelular primario frente a un carcinoma metastásico puede resultar complicado. 40x
Figura 29
PAAF de hígado, carcinoma hepatocelular.
Aspirado de carcinoma hepatocelular en el que las células tumorales están poco cohesionadas. A medida que los carcinomas hepatocelulares están menos diferenciados, muestran un mayor grado de descohesión y pierden parte de las características “hepatocelulares”. Por ello, el diagnóstico diferencial de un carcinoma hepatocelular primario frente a un carcinoma metastásico puede resultar complicado.
40x
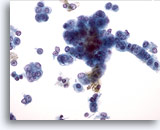
Figura 30
PAAF de hígado, carcinoma hepatocelular.
Hepatocitos malignos en los que existe un aumento de la relación núcleo/citoplasma y núcleos con un patrón cromático vesicular y nucleolos prominentes. La disposición lineal de las células tumorales de la derecha, así como su aspecto más columnar aumenta la posibilidad de una mezcla de carcinoma hepatocelular y colangiocarcinoma. 40x
Figura 30
PAAF de hígado, carcinoma hepatocelular.
Hepatocitos malignos en los que existe un aumento de la relación núcleo/citoplasma y núcleos con un patrón cromático vesicular y nucleolos prominentes. La disposición lineal de las células tumorales de la derecha, así como su aspecto más columnar aumenta la posibilidad de una mezcla de carcinoma hepatocelular y colangiocarcinoma.
40x
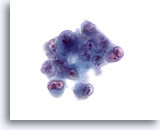
Figura 31
PAAF de hígado, carcinoma hepatocelular.
Aspirado de carcinoma hepatocelular poco diferenciado en el que existen células muy atípicas que muestran una elevada relación núcleo/citoplasma, bi- a multinucleación y agrupamiento irregular de cromatina con prominentes nucleolos irregulares. 60x
Figura 31
PAAF de hígado, carcinoma hepatocelular.
Aspirado de carcinoma hepatocelular poco diferenciado en el que existen células muy atípicas que muestran una elevada relación núcleo/citoplasma, bi- a multinucleación y agrupamiento irregular de cromatina con prominentes nucleolos irregulares.
60x
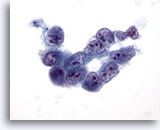
Figura 32
PAAF de hígado, carcinoma hepatocelular. Aspirado de carcinoma hepatocelular poco diferenciado en el que un grupo poco cohesionado de células malignas muestra una elevada relación núcleo/citoplasma, irregularidad nuclear y una distribución irregular de la cromatina con nucleolos múltiples. 60x
Figura 32
PAAF de hígado, carcinoma hepatocelular.
Aspirado de carcinoma hepatocelular poco diferenciado en el que un grupo poco cohesionado de células malignas muestra una elevada relación núcleo/citoplasma, irregularidad nuclear y una distribución irregular de la cromatina con nucleolos múltiples.
60x
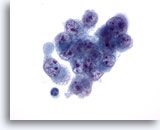
Figura 33
PAAF de hígado, carcinoma hepatocelular.
Aspirado de carcinoma hepatocelular poco diferenciado que muestra células malignas con tamaño y forma variables, con núcleos que también son irregulares y con una distribución irregular de la cromatina y nucleolos múltiples. 60x
Figura 33
PAAF de hígado, carcinoma hepatocelular.
Aspirado de carcinoma hepatocelular poco diferenciado que muestra células malignas con tamaño y forma variables, con núcleos que también son irregulares y con una distribución irregular de la cromatina y nucleolos múltiples.
60x
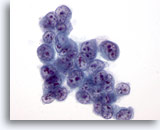
Figura 34
PAAF de hígado, carcinoma hepatocelular.
Aspirado de carcinoma hepatocelular en el que las células tumorales presentan una relación núcleo/citoplasma muy elevada. 60x
Figura 34
PAAF de hígado, carcinoma hepatocelular.
Aspirado de carcinoma hepatocelular en el que las células tumorales presentan una relación núcleo/citoplasma muy elevada.
60x
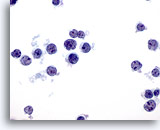
Figura 35
PAAF de hígado, linfoma
En esta diapositiva se muestran células linfoides atípicas, dispuestas de forma disociativa. Observe la elevada relación núcleo/citoplasma con irregularidad nuclear y nucleolos pequeños pero prominentes. 60x
Figura 35
PAAF de hígado, linfoma
En esta diapositiva se muestran células linfoides atípicas, dispuestas de forma disociativa. Observe la elevada relación núcleo/citoplasma con irregularidad nuclear y nucleolos pequeños pero prominentes.
60x
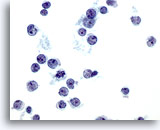
Figura 36
PAAF de hígado, linfoma.
Aspirado de un linfoma de no-Hodgkin en el que las células tumorales están dispersas de forma individual y muestran una elevada relación núcleo/citoplasma con una irregularidad nuclear que incluye hendiduras y salientes. Algunas de las células tumorales son pequeñas, pero con nucleolos prominentes. 60x
Figura 36
PAAF de hígado, linfoma
Aspirado de un linfoma de no-Hodgkin en el que las células tumorales están dispersas de forma individual y muestran una elevada relación núcleo/citoplasma con una irregularidad nuclear que incluye hendiduras y salientes. Algunas de las células tumorales son pequeñas, pero con nucleolos prominentes.
60x
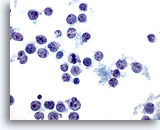
Figura 37
PAAF de hígado, linfoma
Aspirado de linfoma de no-Hodgkin en el que aparecen células linfoides malignas aisladas y dispersas exhibiendo núcleos ovales a irregulares con hendiduras y salientes nucleares y membranas nucleares irregulares. 60x
Figura 37
PAAF de hígado, linfoma
Aspirado de linfoma de no-Hodgkin en el que aparecen células linfoides malignas aisladas y dispersas exhibiendo núcleos ovales a irregulares con hendiduras y salientes nucleares y membranas nucleares irregulares.
60x
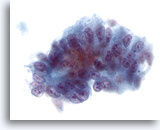
Figura 38
Adenocarcinoma metastásico que afecta al hígado constituido por células atípicas de aspecto columnar que sugieren la pseudoestratificación de los núcleos. Los núcleos son ovales con múltiples nucleolos e irregularidad nuclear. 40x
Figura 38
PAAF de hígado, adenocarcinoma metastásico.
Adenocarcinoma metastásico que afecta al hígado constituido por células atípicas de aspecto columnar que sugieren la pseudoestratificación de los núcleos. Los núcleos son ovales con múltiples nucleolos e irregularidad nuclear.
40x
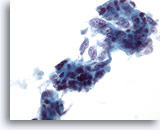
Figura 39
PAAF de hígado, adenocarcinoma metastásico.
Grupos poco rígidos de adenocarcinoma metastásico en el que muchas de las células tumorales presentan un aspecto columnar con núcleos vesiculares alargados y múltiples nucleolos prominentes. 40x
Figura 39
PAAF de hígado, adenocarcinoma metastásico.
Grupos poco rígidos de adenocarcinoma metastásico en el que muchas de las células tumorales presentan un aspecto columnar con núcleos vesiculares alargados y múltiples nucleolos prominentes.
40x
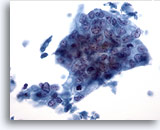
Figura 40
PAAF de hígado, adenocarcinoma metastásico.
Adenocarcinoma poco diferenciado en el que las células tumorales están dispuestas de forma sincitial con los núcleos mostrando pérdida de polaridad. Las células tumorales muestran una considerable variación en el tamaño y la forma nucleares. 40x
Figura 40
PAAF de hígado, adenocarcinoma metastásico.
Adenocarcinoma poco diferenciado en el que las células tumorales están dispuestas de forma sincitial con los núcleos mostrando pérdida de polaridad. Las células tumorales muestran una considerable variación en el tamaño y la forma nucleares.
40x
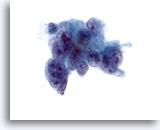
Figura 41
PAAF de hígado, adenocarcinoma metastásico.
Aspirado de adenocarcinoma metastásico en el que se observan células malignas poco diferenciadas que muestran una considerable variación en el tamaño y la forma nucleares. También se observa multinucleación. La cromatina presenta una distribución irregular con uno o más nucleolos prominentes. Las células tumorales presentan un citoplasma delicado. 60x
Figura 41
PAAF de hígado, adenocarcinoma metastásico.
Aspirado de adenocarcinoma metastásico en el que se observan células malignas poco diferenciadas que muestran una considerable variación en el tamaño y la forma nucleares. También se observa multinucleación. La cromatina presenta una distribución irregular con uno o más nucleolos prominentes. Las células tumorales presentan un citoplasma delicado.
60x
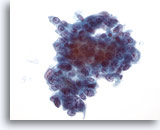
Figura 42
PAAF de hígado, adenocarcinoma metastásico.
Aspirado de adenocarcinoma metastásico en el que las células tumorales varían de cuboidales a casi columnares. Los núcleos muestran cierta variación en la forma y el tamaño y presentan una distribución vesicular de la cromatina con nucleolos prominentes. 40x
Figura 42
PAAF de hígado, adenocarcinoma metastásico.
Aspirado de adenocarcinoma metastásico en el que las células tumorales varían de cuboidales a casi columnares. Los núcleos muestran cierta variación en la forma y el tamaño y presentan una distribución vesicular de la cromatina con nucleolos prominentes.
40x
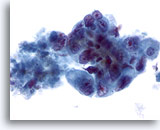
Figura 43
PAAF de hígado, adenocarcinoma metastásico.
Células malignas poco diferenciadas que muestran una variación considerable del tamaño y la forma nucleares, junto con núcleos que presentan una distribución irregular de cromatina y nucleolos prominentes. 40x
Figura 43
PAAF de hígado, adenocarcinoma metastásico.
Células malignas poco diferenciadas que muestran una variación considerable del tamaño y la forma nucleares, junto con núcleos que presentan una distribución irregular de cromatina y nucleolos prominentes.
40x
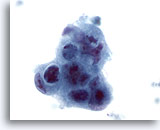
Figura 44
PAAF de hígado, adenocarcinoma metastásico.
Células malignas poco diferenciadas en las que se observa disposición sincitial, así como una pérdida de polaridad. Marcada irregularidad nuclear, hipercromasia y presencia de nucleolos irregulares. 60x
Figura 44
PAAF de hígado, adenocarcinoma metastásico.
Células malignas poco diferenciadas en las que se observa disposición sincitial, así como una pérdida de polaridad. Marcada irregularidad nuclear, hipercromasia y presencia de nucleolos irregulares.
60x
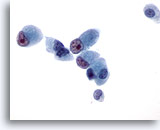
Figura 45
PAAF de hígado, colangiocarcinoma metastásico.
Las células malignas presentan forma cuboidal a columnar con núcleos situados excéntricamente que muestran prominentes nucleolos irregulares. 60x
Figura 45
PAAF de hígado, colangiocarcinoma metastásico.
Las células malignas presentan forma cuboidal a columnar con núcleos situados excéntricamente que muestran prominentes nucleolos irregulares.
60x
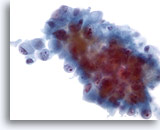
Figura 46
Aspirado de colangiocarcinoma metastásico en el que las células tumorales varían de ovales a columnares. Las células tumorales presentan núcleos que están situados excéntricamente. Se observa irregularidad nuclear, distribución irregular de cromatina y nucleolos prominentes. Aparece un citoplasma anfofílico delicado circundante. 40x
Figura 46
PAAF de hígado, colangiocarcinoma metastásico.
Aspirado de colangiocarcinoma metastásico en el que las células tumorales varían de ovales a columnares. Las células tumorales presentan núcleos que están situados excéntricamente. Se observa irregularidad nuclear, distribución irregular de cromatina y nucleolos prominentes. Aparece un citoplasma anfofílico delicado circundante.
40x
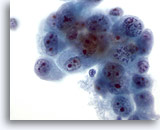
Figura 47
PAAF de hígado, colangiocarcinoma metastásico.
Aspirado de colangiocarcinoma metastásico con células malignas con forma oval a irregular que muestran cromatina agrupada que está distribuida irregularmente. Las células tumorales poseen múltiples nucleolos. Aparece un citoplasma anfofílico delicado circundante. 60x
Figura 47
PAAF de hígado, colangiocarcinoma metastásico.
Aspirado de colangiocarcinoma metastásico con células malignas con forma oval a irregular que muestran cromatina agrupada que está distribuida irregularmente. Las células tumorales poseen múltiples nucleolos. Aparece un citoplasma anfofílico delicado circundante.
60x
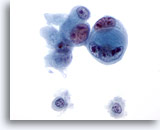
Figura 48
PAAF de hígado, colangiocarcinoma metastásico.
Adenocarcinoma poco diferenciado en el que se observa una disposición “célula dentro de célula”. Aparece una considerable variación en el tamaño y la forma nucleares, así como nucleolos múltiples irregulares. 60x
Figura 48
PAAF de hígado, colangiocarcinoma metastásico.
Adenocarcinoma poco diferenciado en el que se observa una disposición “célula dentro de célula”. Aparece una considerable variación en el tamaño y la forma nucleares, así como nucleolos múltiples irregulares.
60x
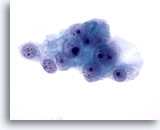
Figura 49
Las células malignas presentan núcleos redondos con nucleolos múltiples y citoplasma pálido delicado circundante con contorno desflecado. 60x
Figura 49
PAAF de hígado, carcinoma metastásico de células renales.
Las células malignas presentan núcleos redondos con nucleolos múltiples y citoplasma pálido delicado circundante con contorno desflecado.
60x
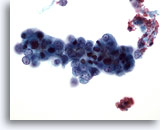
Figura 50
PAAF de hígado, adenocarcinoma metastásico de endometrio.
Aspirado de carcinoma metastásico de endometrio en el que aparecen células malignas relativamente pequeñas con elevada relación núcleo/citoplasma. 40x
Figura 50
PAAF de hígado, adenocarcinoma metastásico de endometrio.
Aspirado de carcinoma metastásico de endometrio en el que aparecen células malignas relativamente pequeñas con elevada relación núcleo/citoplasma.
40x
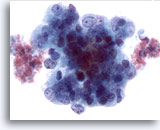
Figura 51
PAAF de hígado, adenocarcinoma metastásico de endometrio.
Aspirado de adenocarcinoma metastásico de endometrio que afecta al hígado en el que las células tumorales muestran una marcada variación en el tamaño y la forma nucleares. Las células tumorales presentan cromatina irregular y nucleolos prominentes. 60x
Figura 51
PAAF de hígado, adenocarcinoma metastásico de endometrio.
Aspirado de adenocarcinoma metastásico de endometrio que afecta al hígado en el que las células tumorales muestran una marcada variación en el tamaño y la forma nucleares. Las células tumorales presentan cromatina irregular y nucleolos prominentes.
60x
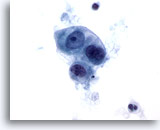
Figura 52
Carcinoma metastásico del apéndice cecal
Adenocarcinoma metastásico del ciego en el que se observa un grupo poco rígido de células malignas cuboidales a ovales. Existe variación en el tamaño y la forma nucleares. 60x
Figura 52
Carcinoma metastásico del apéndice cecal
Adenocarcinoma metastásico del ciego en el que se observa un grupo poco rígido de células malignas cuboidales a ovales. Existe variación en el tamaño y la forma nucleares.
60x
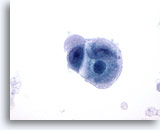
Figura 53
Carcinoma metastásico del apéndice cecal
Aspiración con aguja fina de un carcinoma metastásico poco diferenciado del ciego en el que las células tumorales muestran variación en el tamaño y la forma nucleares. El citoplasma circundante tiene un aspecto anfofílico de burbuja. 60x
Figura 53
Carcinoma metastásico del apéndice cecal
Aspiración con aguja fina de un carcinoma metastásico poco diferenciado del ciego en el que las células tumorales muestran variación en el tamaño y la forma nucleares. El citoplasma circundante tiene un aspecto anfofílico de burbuja.
60x
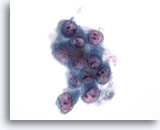
Figura 54: PAAF de hígado, carcinoma metastásico de pulmón.
Aspiración con aguja fina de un adenocarcinoma metastásico del pulmón que afecta al hígado, en el que un grupo poco rígido de células malignas muestra una considerable variación de la forma nuclear. Se observa una elevada relación núcleo/citoplasma. Las células tumorales individuales presentan núcleos situados excéntricamente con citoplasma anfofílico alrededor. 60x
Figura 54
PAAF de hígado, carcinoma metastásico de pulmón.
Aspiración con aguja fina de un adenocarcinoma metastásico del pulmón que afecta al hígado, en el que un grupo poco rígido de células malignas muestra una considerable variación de la forma nuclear. Se observa una elevada relación núcleo/citoplasma. Las células tumorales individuales presentan núcleos situados excéntricamente con citoplasma anfofílico alrededor.
60x
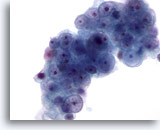
Figura 55
PAAF de hígado, carcinoma metastásico de células renales en el hígado.
Carcinoma metastásico de células renales que afecta al hígado, en el que las células tumorales presentan núcleos redondos con tamaño variable y pequeñas irregularidades en la membrana nuclear. Los núcleos poseen nucleolos pequeños a prominentes. Aparece un citoplasma pálido alrededor. 60x
Figura 55
PAAF de hígado, carcinoma metastásico de células renales en el hígado.
Carcinoma metastásico de células renales que afecta al hígado, en el que las células tumorales presentan núcleos redondos con tamaño variable y pequeñas irregularidades en la membrana nuclear. Los núcleos poseen nucleolos pequeños a prominentes. Aparece un citoplasma pálido alrededor.
60x
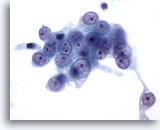
Figura 56
PAAF de hígado, carcinoma metastásico de células renales en el hígado.
Aspiración con aguja fina de un carcinoma metastásico de células renales en el que las células malignas presentan núcleos redondos con un patrón vesicular de cromatina y con uno o más nucleolos prominentes. Observe el citoplasma pálido circundante y el contorno citoplasmático desflecado. 60x
Figura 56
PAAF de hígado, carcinoma metastásico de células renales en el hígado.
Aspiración con aguja fina de un carcinoma metastásico de células renales en el que las células malignas presentan núcleos redondos con un patrón vesicular de cromatina y con uno o más nucleolos prominentes. Observe el citoplasma pálido circundante y el contorno citoplasmático desflecado.
60x
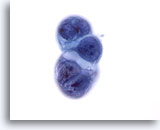
Figura 57
PAAF de hígado, carcinoma metastásico de páncreas.
Un grupo de células de un carcinoma metastásico ductal del páncreas que afecta al hígado. Elevada relación núcleo/citoplasma, así como irregularidad nuclear y presencia de cromatina agrupada. También se observa vacuolización citoplasmática. 60x
Figura 57
PAAF de hígado, carcinoma metastásico de páncreas.
Un grupo de células de un carcinoma metastásico ductal del páncreas que afecta al hígado. Elevada relación núcleo/citoplasma, así como irregularidad nuclear y presencia de cromatina agrupada. También se observa vacuolización citoplasmática.
60x
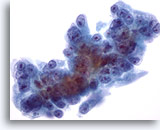
Figura 58
PAAF de hígado, carcinoma metastásico de páncreas.
Carcinoma metastásico de pancreás que afecta al hígado en el que las células malignas muestran una variación considerable en el tamaño y la forma nucleares. Se observan nucleolos situados excéntricamente rodeados de citoplasma anfofílico delicado. 60x
Figura 58
PAAF de hígado, carcinoma metastásico de páncreas.
Carcinoma metastásico de pancreás que afecta al hígado en el que las células malignas muestran una variación considerable en el tamaño y la forma nucleares. Se observan nucleolos situados excéntricamente rodeados de citoplasma anfofílico delicado.
60x
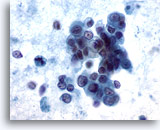
Figura 59
PAAF de hígado, carcinoma metastásico de páncreas.
Grupos poco rígidos de células malignas que presentan un citoplasma pálido a vacuolado y núcleos situados excéntricamente. Se observa una considerable variación en el tamaño y la forma nucleares. Además de los grupos poco cohesionados, se observan algunas células tumorales individuales. El fondo muestra una considerable diátesis tumoral. 60x
Figura 59
PAAF de hígado, carcinoma metastásico de páncreas.
Grupos poco rígidos de células malignas que presentan un citoplasma pálido a vacuolado y núcleos situados excéntricamente. Se observa una considerable variación en el tamaño y la forma nucleares. Además de los grupos poco cohesionados, se observan algunas células tumorales individuales. El fondo muestra una considerable diátesis tumoral.
60x
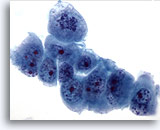
Figura 60
PAAF de hígado, carcinoma metastásico de páncreas.
Células malignas poco diferenciadas que muestran una considerable variación en el tamaño y la forma nucleares. Se observa una distribución irregular de la cromatina y nucleolos prominentes. 60x
Figura 60
PAAF de hígado, carcinoma metastásico de páncreas.
Células malignas poco diferenciadas que muestran una considerable variación en el tamaño y la forma nucleares. Se observa una distribución irregular de la cromatina y nucleolos prominentes.
60x
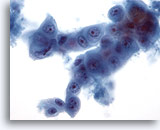
Figura 61
PAAF de hígado, carcinoma metastásico de páncreas.
Aspirado de carcinoma metastásico de pancreás en el que aparecen células ovales a cuboidales, incluyendo la presencia de una disposición “célula dentro de célula”. Se observa una considerable variación en el tamaño y la forma nucleares. 40x
Figura 61
PAAF de hígado, carcinoma metastásico de páncreas.
Aspirado de carcinoma metastásico de pancreás en el que aparecen células ovales a cuboidales, incluyendo la presencia de una disposición “célula dentro de célula”. Se observa una considerable variación en el tamaño y la forma nucleares.
40x
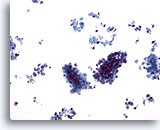
Figura 62
PAAF de hígado, carcinoma metastásico de célula pequeña.
Grupos de células pequeñas malignas, así como la aparición de células tumorales aisladas dispersas. Observe el característico pequeño tamaño de las células malignas, así como la elevada relación núcleo/citoplasma. 20x
Figura 62
PAAF de hígado, carcinoma metastásico de célula pequeña.
Grupos de células pequeñas malignas, así como la aparición de células tumorales aisladas dispersas. Observe el característico pequeño tamaño de las células malignas, así como la elevada relación núcleo/citoplasma.
20x
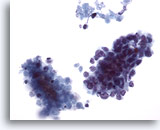
Figura 63
PAAF de hígado, carcinoma metastásico de célula pequeña.
Grupos celulares de un carcinoma metastásico de célula pequeña del pulmón en el que las células malignas pequeñas presentan una elevada relación núcleo/citoplasma. Aparecen núcleos hipercromáticos carentes de nucleolos prominentes. Observe el material necrótico adyacente al grupo maligno. 40x
Figura 63
PAAF de hígado, carcinoma metastásico de célula pequeña.
Grupos celulares de un carcinoma metastásico de célula pequeña del pulmón en el que las células malignas pequeñas presentan una elevada relación núcleo/citoplasma. Aparecen núcleos hipercromáticos carentes de nucleolos prominentes. Observe el material necrótico adyacente al grupo maligno. .
40x
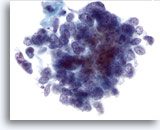
Figura 64
PAAF de hígado, carcinoma metastásico de célula pequeña.
Observe la distribución uniforme de la cromatina y la ausencia de nucleolos prominentes características del carcinoma de célula pequeña, junto con la elevada relación núcleo/citoplasma. 60x
Figura 64
PAAF de hígado, carcinoma metastásico de célula pequeña.
Observe la distribución uniforme de la cromatina y la ausencia de nucleolos prominentes características del carcinoma de célula pequeña, junto con la elevada relación núcleo/citoplasma.
60x
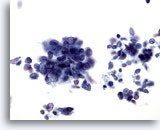
Figura 65
PAAF de hígado, carcinoma metastásico de célula pequeña.
Aspirado de un carcinoma metastásico de célula pequeña del pulmón en el que aparecen grupos poco rígidos de células malignas pequeñas con una elevada relación núcleo/citoplasma. En la mayor parte de los casos, no hay evidencia de nucleolos. Se observa un patrón de cromatina finamente distribuida. 40x
Figura 65
PAAF de hígado, carcinoma metastásico de célula pequeña.
Aspirado de un carcinoma metastásico de célula pequeña del pulmón en el que aparecen grupos poco rígidos de células malignas pequeñas con una elevada relación núcleo/citoplasma. En la mayor parte de los casos, no hay evidencia de nucleolos. Se observa un patrón de cromatina finamente distribuida.
40x
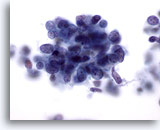
Figura 66
PAAF de hígado, carcinoma metastásico de célula pequeña.
Imagen a gran aumento de un carcinoma metastásico de célula pequeña del pulmón en el que las células malignas presentan una elevada relación núcleo/citoplasma con núcleos que muestran una cromatina finamente granular y uniformemente distribuida con ausencia de nucleolos prominentes. 60x
Figura 66
PAAF de hígado, carcinoma metastásico de célula pequeña.
Imagen a gran aumento de un carcinoma metastásico de célula pequeña del pulmón en el que las células malignas presentan una elevada relación núcleo/citoplasma con núcleos que muestran una cromatina finamente granular y uniformemente distribuida con ausencia de nucleolos prominentes.
60x
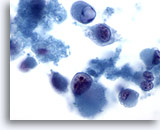
Figura 67
PAAF de hígado, melanoma metastásico
Frotis disociativo en el que se observan células marcadamente atípicas con un fenotipo rabdoide. El fenotipo rabdoide se caracteriza por grandes glóbulos intracitoplasmáticos, así como por núcleos que poseen prominentes nucleolos. 60x
Figura 67
PAAF de hígado, melanoma metastásico
Frotis disociativo en el que se observan células marcadamente atípicas con un fenotipo rabdoide. El fenotipo rabdoide se caracteriza por grandes glóbulos intracitoplasmáticos, así como por núcleos que poseen prominentes nucleolos.
60x
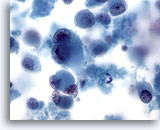
Figura 68
PAAF de hígado, melanoma metastásico.
Aspirado de un melanoma metastásico del hígado en el que aparecen células malignas aisladas y dispersas, incluyendo la presencia característica de una cierta binucleación y de nucleolos prominentes. Al igual que en algunos melanomas metastásicos, se observa una cantidad moderada de citoplasma. 60x
Figura 68
PAAF de hígado, melanoma metastásico
Aspirado de un melanoma metastásico del hígado en el que aparecen células malignas aisladas y dispersas, incluyendo la presencia característica de una cierta binucleación y de nucleolos prominentes. Al igual que en algunos melanomas metastásicos, se observa una cantidad moderada de citoplasma.
60x
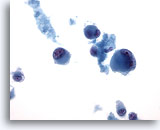
Figura 69
PAAF de hígado, melanoma metastásico
Aspirado de un melanoma metastásico maligno que afecta al hígado en el que aparecen células tumorales aisladas y dispersas de aspecto abigarrado, incluyendo la presencia característica de una cierta binucleación. 40x
Figura 69
PAAF de hígado, melanoma metastásico
Aspirado de un melanoma metastásico maligno que afecta al hígado en el que aparecen células tumorales aisladas y dispersas de aspecto abigarrado, incluyendo la presencia característica de una cierta binucleación.
40x
Páncreas
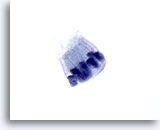
Figura 70
PAAF de páncreas, células ductales benignas.
Observe las células columnares dispuestas en un patrón de empalizada. La relación núcleo/citoplasma sigue siendo baja. Los núcleos tienen forma ovalada con citoplasma pálido anfofílico alrededor. 60x
Figura 70
PAAF de páncreas, células ductales benignas.
Observe las células columnares dispuestas en un patrón de empalizada. La relación núcleo/citoplasma sigue siendo baja. Los núcleos tienen forma ovalada con citoplasma pálido anfofílico alrededor.
60x
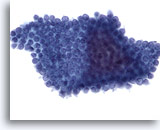
Figura 71
PAAF de páncreas, células ductales benignas.
Aspirado de células ductales benignas procedentes del páncreas, en el que las células están dispuestas en forma de panal de abeja con los núcleos uniformemente espaciados. 40x
Figura 71
PAAF de páncreas, células ductales benignas.
Aspirado de células ductales benignas procedentes del páncreas, en el que las células están dispuestas en forma de panal de abeja con los núcleos uniformemente espaciados.
40x
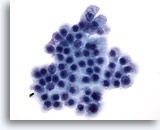
Figura 72
PAAF de páncreas, células ductales benignas.
Las células ductales benignas de este aspirado están dispuestas en panal de abeja y se trata de células uniformes con núcleos redondos y contorno celular bien definido. 60x
Figura 72
PAAF de páncreas, células ductales benignas.
Las células ductales benignas de este aspirado están dispuestas en panal de abeja y se trata de células uniformes con núcleos redondos y contorno celular bien definido.
60x

Figura 73
PAAF de páncreas, músculo esquelético
Se observa la presencia de un fragmento de músculo esquelético, que ha sido recogido de forma inadvertida durante un aspirado percutáneo del páncreas. Se observan núcleos blandos de aspecto fusiforme. 40x
Figura 73
PAAF de páncreas, músculo esquelético
Se observa la presencia de un fragmento de músculo esquelético, que ha sido recogido de forma inadvertida durante un aspirado percutáneo del páncreas. Se observan núcleos blandos de aspecto fusiforme.
40x
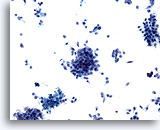
Figura 74
PAAF de páncreas, adenocarcinoma pancreático.
Aspirado de un adenocarcinoma pancreático que está formado por grupos poco rígidos de células malignas, así como por numerosas células atípicas aisladas y dispersas. 20x
Figura 74
PAAF de páncreas, adenocarcinoma pancreático.
Aspirado de un adenocarcinoma pancreático que está formado por grupos poco rígidos de células malignas, así como por numerosas células atípicas aisladas y dispersas.
20x
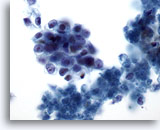
Figura 75
PAAF de páncreas, adenocarcinoma pancreático.
Aspirado de un adenocarcinoma pancreático en el que los grupos poco rígidos de células malignas presentan formas ovaladas con elevada relación núcleo/citoplasma. El fondo presenta algunos restos necróticos. 60x
Figura 75
PAAF de páncreas, adenocarcinoma pancreático.
Aspirado de un adenocarcinoma pancreático en el que los grupos poco rígidos de células malignas presentan formas ovaladas con elevada relación núcleo/citoplasma. El fondo presenta algunos restos necróticos.
60x
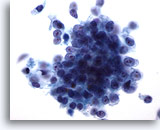
Figura 76
PAAF de páncreas, adenocarcinoma pancreático.
Imagen a gran aumento de un grupo de células malignas de un carcinoma ductal pancreático, con las células dispuestas de forma sincitial, así como con células malignas aisladas y dispersas. La forma de las células varía de cuboidal a columnar y presentan una elevada relación núcleo/citoplasma. 60x
Figura 76
PAAF de páncreas, adenocarcinoma pancreático.
Imagen a gran aumento de un grupo de células malignas de un carcinoma ductal pancreático, con las células dispuestas de forma sincitial, así como con células malignas aisladas y dispersas. La forma de las células varía de cuboidal a columnar y presentan una elevada relación núcleo/citoplasma.
60x
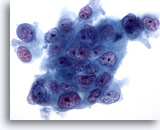
Figura 77
PAAF de páncreas, adenocarcinoma pancreático.
Imagen a gran aumento de adenocarcinomas pancreáticos moderadamente diferenciados de tipo ductal, formado por células tumorales que muestran una disposición sincitial y que muestran una marcada variación en tamaño y forma. También existe evidencia de pérdida de polaridad. Los núcleos son hipercromáticos con múltiples nucleolos irregulares. 60x
Figura 77
PAAF de páncreas, adenocarcinoma pancreático.
Imagen a gran aumento de adenocarcinomas pancreáticos moderadamente diferenciados de tipo ductal, formado por células tumorales que muestran una disposición sincitial y que muestran una marcada variación en tamaño y forma. También existe evidencia de pérdida de polaridad. Los núcleos son hipercromáticos con múltiples nucleolos irregulares.
60x
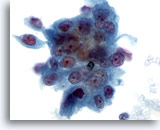
Figura 78
PAAF de páncreas, adenocarcinoma pancreático.
Aspirado de un carcinoma pancreático moderadamente diferenciado en el que se muestra un grupo sincitial de células malignas con una variación considerable en el tamaño y la forma nucleares. 60x
Figura 78
PAAF de páncreas, adenocarcinoma pancreático.
Aspirado de un carcinoma pancreático moderadamente diferenciado en el que se muestra un grupo sincitial de células malignas con una variación considerable en el tamaño y la forma nucleares.
60x
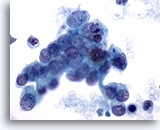
Figura 79
PAAF de páncreas, adenocarcinoma pancreático.
Grupo poco rígido de células malignas aisladas y dispersas de un aspirado de carcinoma ductal pancreático. Las células tumorales muestran una considerable variación en el tamaño y la forma nucleares. Muchas de las células tumorales presentan una elevada relación núcleo/citoplasma, así como cromatina irregular. 60x
Figura 79
PAAF de páncreas, adenocarcinoma pancreático.
Grupo poco rígido de células malignas aisladas y dispersas de un aspirado de carcinoma ductal pancreático. Las células tumorales muestran una considerable variación en el tamaño y la forma nucleares. Muchas de las células tumorales presentan una elevada relación núcleo/citoplasma, así como cromatina irregular.
60x
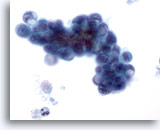
Figura 80
PAAF de páncreas, adenocarcinoma pancreático.
Aspirado de carcinoma ductal pancreático en el que aparecen células malignas ovaladas con algunas células en anillo de sello. Las grandes vacuolas citoplasmáticas han desplazado y deformado los núcleos. 60x
Figura 80
PAAF de páncreas, adenocarcinoma pancreático.
Aspirado de carcinoma ductal pancreático en el que aparecen células malignas ovaladas con algunas células en anillo de sello. Las grandes vacuolas citoplasmáticas han desplazado y deformado los núcleos.
60x
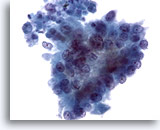
Figura 81
PAAF de páncreas, adenocarcinoma pancreático.
Aspirado de adenocarcinoma pancreático en el que las células tumorales presentan una configuración más columnar. Aparece una considerable variación en el tamaño y forma nucleares, así como una pérdida de polaridad. 40x
Figura 81
PAAF de páncreas, adenocarcinoma pancreático.
Aspirado de adenocarcinoma pancreático en el que las células tumorales presentan una configuración más columnar. Aparece una considerable variación en el tamaño y forma nucleares, así como una pérdida de polaridad.
40x
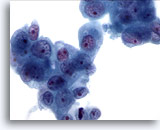
Figura 82
PAAF de páncreas, adenocarcinoma pancreático.
Grupos poco rígidos de células malignas que presentan núcleos aumentados con cromatina irregular y nucleolos prominentes. Aparece un citoplasma circundante anfofílico a ligeramente vacuolado. 60x
Figura 82
PAAF de páncreas, adenocarcinoma pancreático.
Grupos poco rígidos de células malignas que presentan núcleos aumentados con cromatina irregular y nucleolos prominentes. Aparece un citoplasma circundante anfofílico a ligeramente vacuolado.
60x
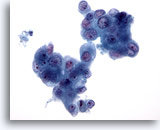
Figura 83
PAAF de páncreas, adenocarcinoma pancreático.
Aspirado de adenocarcinoma pancreático en el que los grupos de células tumorales muestran una variación considerable en el tamaño nuclear. Aparecen células binucleadas ocasionales. 40x
Figura 83
PAAF de páncreas, adenocarcinoma pancreático.
Aspirado de adenocarcinoma pancreático en el que los grupos de células tumorales muestran una variación considerable en el tamaño nuclear. Aparecen células binucleadas ocasionales.
40x
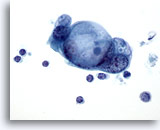
Figura 84
PAAF de páncreas, adenocarcinoma pancreático.
Un grupo de células malignas que poseen grandes vacuolas intracitoplasmáticas con un cierto patrón diana goticular para la mucina. 60x
Figura 84
PAAF de páncreas, adenocarcinoma pancreático.
Un grupo de células malignas que poseen grandes vacuolas intracitoplasmáticas con un cierto patrón diana goticular para la mucina.
60x
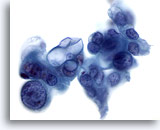
Figura 85
PAAF de páncreas, adenocarcinoma pancreático.
Aspirado de adenocarcinoma poco diferenciado en el que se observan células tumorales de aspecto abigarrado, incluyendo algunas que muestran una considerable variación en el tamaño y la forma nucleares. Además, algunas de las células tumorales presentan grandes vacuolas intracitoplasmáticas. 60x
Figura 85
PAAF de páncreas, adenocarcinoma pancreático.
Aspirado de adenocarcinoma poco diferenciado en el que se observan células tumorales de aspecto abigarrado, incluyendo algunas que muestran una considerable variación en el tamaño y la forma nucleares. Además, algunas de las células tumorales presentan grandes vacuolas intracitoplasmáticas.
60x
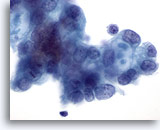
Figura 86
PAAF de páncreas, adenocarcinoma pancreático.
Células malignas que incluyen algunas con vacuolas con mucina de tipo diana. 60x
Figura 86
PAAF de páncreas, adenocarcinoma pancreático.
Células malignas que incluyen algunas con vacuolas con mucina de tipo diana.
60x
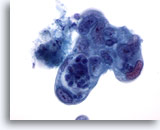
Figura 87
PAAF de páncreas, adenocarcinoma pancreático.
Adenocarcinoma pancreático poco diferenciado que muestra pleomorfismo en las células con una variación considerable del tamaño y la forma nucleares y con una elevada relación núcleo/citoplasma. 60x
Figura 87
PAAF de páncreas, adenocarcinoma pancreático.
Adenocarcinoma pancreático poco diferenciado que muestra pleomorfismo en las células con una variación considerable del tamaño y la forma nucleares y con una elevada relación núcleo/citoplasma.
60x
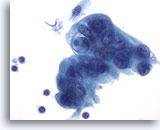
Figura 88
PAAF de páncreas, adenocarcinoma pancreático.
Células malignas poco diferenciadas que incluyen algunas con disposición sincitial. Las células presentan núcleos hipercromáticos con citoplasma delicado anfofílico circundante y contorno desflecado. Una de las células tumorales presenta una vacuola de mucina de tipo diana. 60x
Figura 88
PAAF de páncreas, adenocarcinoma pancreático.
Células malignas poco diferenciadas que incluyen algunas con disposición sincitial. Las células presentan núcleos hipercromáticos con citoplasma delicado anfofílico circundante y contorno desflecado. Una de las células tumorales presenta una vacuola de mucina de tipo diana.
60x
Volver arriba
Volver a la Tabla de Contenidos
























































































