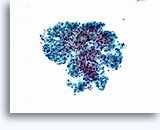
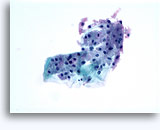
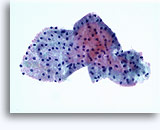
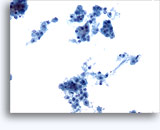
Citología de aspiración con aguja fina
Otras partes del cuerpo
Michele M. Weir, MD, FRCP
Introducción
Esta sección trata de las biopsias por aspiración con aguja fina (BAAF) del riñón, glándula adrenal, gónadas, hueso y tejido blando.
BAAF del riñón
La BAAF de una masa renal es un procedimiento poco común, ya que la mayoría de los pacientes con una masa renal pasan directamente a la resección. No obstante, la BAAF resulta útil en la evaluación de una masa renal cuando:
- las características de las imágenes no son determinantes para su clasificación;
- el paciente no es un candidato a la cirugía; y
- es necesaria una planificación quirúrgica (cirugía de conservación del riñón o del uréter)
Se ha descrito que la BAAF de tumores renales presenta una sensibilidad del 70-92%, una especificidad del 92-99% y una precisión global de diagnóstico del 73-95%. Debido a la heterogeneidad del tumor y a la importancia de la clasificación citogenética, el diagnóstico definitivo de algunos neoplasmas renales se consigue más fácilmente a partir de la muestra histológica. En algunas neoplasias oncocíticas negativas para hierro coloidal de Hale, la determinación del subtipo puede resultar complicada a partir de la BAAF, y sólo se debe dar un diagnóstico diferencial.
En adultos, la causa no neoplásica más común de la aparición de una masa renal es un quiste renal. Otras lesiones pueden ser un absceso y una pielonefritis xantogranulomatosa. De los neoplasmas renales, el caso benigno más común es el oncocitoma y el maligno más común es el carcinoma de células renales (RCC). Otros neoplasmas incluyen el angiomiolipoma benigno y el carcinoma urotelial de la pelvis renal.
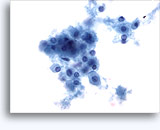
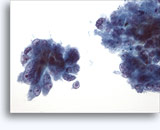
Citología de la BAAF de riñón
- Normal
- Muestra con baja celularidad
- Células aisladas o grupos pequeños
- Glomérulos:
- bucles capilares, células fusiformes o redondas
- sin atipia, sin esférulas ni papilas (al contrario que el RCC papilar)
- estructuras celulares globulares
- SIMULA: RCC papilar
- Túbulo contorneado proximal (PCT):
- túbulos y placas
- abundante citoplasma granular
- citoplasma frágil no definido sin contornos celulares (al contrario que el oncocitoma)
- núcleo blando, nucleolo prominente
- SIMULA: oncocitoma, RCC
- Túbulo contorneado distal / Conducto colector (DCT/CD):
- túbulos, placas planas (al contrario que el RCC)
- citoplasma bien definido, células más pequeñas
- sin vacuolas (al contrario que el RCC)
- sin nucleolo
- SIMULA: RCC
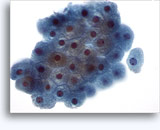
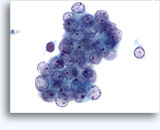
- Oncocitoma
- Fondo limpio
- Células aisladas de desadhesión o grupos poco rígidos, sin núcleos desnudos
- Raramente en grupos grandes (al contrario que el RCC)
- Pequeños núcleos uniformes, contorno homogéneo (al contrario que el RCC)
- Atipia nuclear focal, binucleación, nucleolos discretos
- Abundante citoplasma granular uniforme bien definido
- Sin vacuolas (al contrario que el RCC)
- Contorno celular anguloso bien definido (al contrario que las células PCT)
- Negativo para vimentina, positivo para citoqueratina 8/18 (uso bloque de biotina)
- Negativo para hierro coloidal de Hale o tinción perinuclear/atípica presente
- Microscopía electrónica: Mitocondria
- SIMULA: PCT, RCC cromófobo, RCC convencional con citoplasma granular
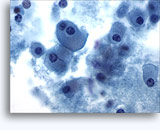
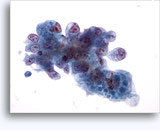
- Carcinoma de células renales
- Células de tipo convencional/común/aclarado (CRCC)
- fondo limpio o necrótico
- placas cohesionadas en monocapas (al contrario que el oncocitoma)
- prominentes capilares ramificados
- células aisladas raras (bajo grado) → más células aisladas y núcleos desnudos (grados más altos) (al contrario que el oncocitoma)
- núcleos blandos, sin nucleolos (bajo grado)
- núcleos atípicos más grandes, algunos con aspecto abigarrado, nucleolos prominentes (grado más alto) (al contrario que el oncocitoma, RCC cromófobo)
- núcleo excéntrico, extraído de las células
- núcleos más uniformes que en RCC cromófobo
- citoplasma vacuolado esponjoso (al contrario que el ONC y normal)
- abundante citoplasma claro o granular (no uniforme) (baja relación núcleo/citoplasma)
- cuerpos intracitoplasmáticos de tipo Mallory
- positivo para vimentina y citoqueratina (uso bloque de queratina)
- negativo para hierro coloidal de Hale
- Microscopía electrónica: glucógeno, lípidos, mitocondria en algunas
- SIMULA: túbulo contorneado distal y conducto colector, oncocitoma, RCC cromófobo
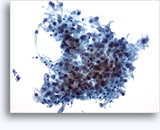
- Tipo cromófobo
- fondo limpio
- placas, grupos y células aisladas (de disociación, pero menos que CRCC)
- núcleos desnudos (al contrario que el oncocitoma)
- mayor variación en el tamaño celular y nuclear (que en el oncocitoma y CRCC)
- núcleos vesiculares, binucleación, inclusiones
- perfil nuclear irregular (al contrario que el oncocitoma y CRCC)
- nucleolos notables en algunas
- abundante citoplasma granular
- aclaramiento perinuclear, contornos celulares prominentes (“coilocítico”)
- citoplasma plumoso / claro / granular no uniforme
- negativo para vimentina y positivo para citoqueratina (uso bloque de queratina)
- positivo para hierro coloidal de Hale – uniforme, denso, citoplásmico
- Microscopía electrónica: microvesículas, mitocondria si se trata de la variante eosinófila
- SIMULA: oncocitoma, CRCC
- Células de tipo convencional/común/aclarado (CRCC)
BAAF adrenal
La BAAF de una masa adrenal suele realizarse para confirmar una metástasis, o en el tratamiento de un nódulo accidental. Un feocromocitoma funcional o sospechoso es una contraindicación para realizar la BAAF, debido a la posibilidad de que se produzca una crisis de hipertensión y/o la muerte del paciente. Se ha descrito que la BAAF de tumores adrenales presenta una sensibilidad del 85-94%, y una especificidad del 100% para las metástasis.
En adultos, la neoplasia más común en la glándula adrenal es una metástasis del pulmón o de la mama. Otros lugares frecuentes de origen incluyen el tracto gastrointestinal, el páncreas, el riñón y la piel (melanoma). Las neoplasias adrenales primarias incluyen las de origen cortical (adenoma, carcinoma) y las de origen medular (feocromocitoma). Otras lesiones adrenales primarias incluyen mielolipoma, quistes e hiperplasia nodular cortical.
Citología de BAAF adrenal
- Normal
- Baja celularidad
- Córtex: Capas externas
- fondo esponjoso rico en lípidos
- células aisladas, grupos
- núcleos blandos ovalados
- sin nucleolos o con nucleolos pequeños
- abundante citoplasma vacuolado con bordes desflecados
- SIMULA: puede ser indistinguible del nódulo cortical adrenal benigno y de algunos carcinomas corticales adrenales.
- Córtex: Capa interna
- sin vacuolación
- citoplasma eosinófilo granular
- células más pequeñas
- pigmento de lipofuscina
- Médula:
- citoplasma basófilo
- gran núcleo excéntrico
- nucleolos manifiestos
- cromatina granular fina
- Nódulo cortical adrenal benigno
- Puede tratarse de una muestra celular
- Fondo esponjoso rico en lípidos (ausente en RCC)
- Fragmentos cohesionados con células endoteliales sinusoidales
- Núcleos desnudos
- Núcleos redondos a ovalados (más uniformes que en RCC)
- Sin nucleolos o con nucleolos pequeños
- Multinucleación
- Citoplasma vacuolado (más que en RCC)
- Positivo para vimentina, positivo para citoqueratina (bajo peso molecular) en algunas
- Positivo para inhibina, melan-A y calretinina
- Negativo para EMA, CK7 y CK20
- SIMULA: RCC y puede ser indistinguible de los carcinomas normales de la glándula adrenal y de algunos carcinomas corticales adrenales.
- Carcinoma cortical adrenal
- SIMULA: Características del adenoma
- Puede aparecer necrosis
- Pueden observarse criterios nucleares de malignidad
- La evaluación histológica es necesaria para distinguir los adenomas más grandes de los carcinomas
- Perfil inmunológico similar al del adenoma
- SIMULA: Si está poco diferenciado, puede ser indistinguible del adenoma normal de la glándula adrenal y del adenoma cortical adrenal, del feocromocitoma y de otras malignidades.
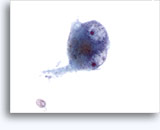
- Feocromocitoma
- 3 tipos de células
- nº 1 – citoplasma fibrilar, núcleos ovalados hipercromáticos – pueden mostrar anisonucleosis / pleomorfismo / binucleación
- células fusiformes (células sustentaculares)
- células plasmocitoides
- Pigmento de melanina en algunas
- Disociación, células aisladas, algunos grupos
- Importante variación del tamaño y la forma nucleares
- Granularidad citoplásmica roja en el material secado al aire
- Positivo para sinaptofisina y cromogranina; positivo para S-100 en células fusiformes.
- SIMULA: Carcinoma cortical adrenal, otras malignidades poco diferenciadas.
- 3 tipos de células
- Población celular uniforme
- Criterios nucleares de malignidad, puede presentar características neuroendocrinas
- Puede aparecer diferenciación granular o escamosa del citoplasma
- Puede aparecer necrosis
- Positivo para citoqueratina
- El perfil CK7, CK20 puede tener un lugar de origen estrecho
- Normalmente negativo para inhibina, melan-A y calretinina
- TTF-1 puede facilitar la confirmación del origen pulmonar
- SIMULA: Feocromocitoma, carcinoma cortical adrenal, otras malignidades poco diferenciadas.
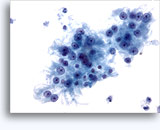
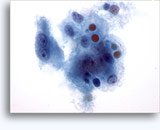
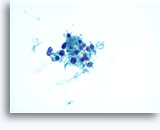
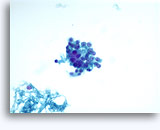
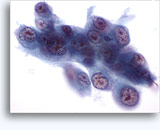
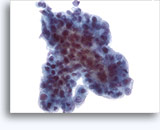
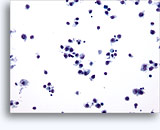
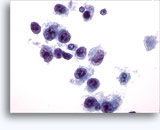
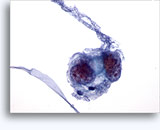
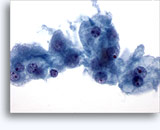
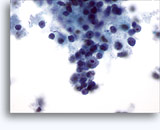
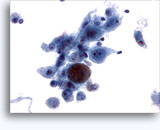
Figuras 22-23: Pequeñas células con núcleos hipercromáticos y núcleos amoldados de extendido, escaso citoplasma y elevadas relaciones núcleo/citoplasma. El fondo contiene restos granulares necróticos.
BAAF de ovario y testículo
La BAAF ovárica y testicular se utiliza raramente para el diagnóstico primario de los neoplasmas gonadales. En Estados Unidos, la BAAF se emplea en el diagnóstico de malignidades gonadales recurrentes o metastásicas. Para este último uso, la sensibilidad de diagnóstico de la BAAF varía entre un 65 y un 95%, con mayor especificidad (92-100%). Los motivos que pueden llevar a un falso negativo incluyen un error en la toma de muestra debido a la fibrosis inducida por la radiación, el tamaño de la masa, la presencia de necrosis y un error de interpretación (al considerarlo benigno).
Citología seleccionada de BAAF ovárica
- Adenocarcinoma seroso
- Muestras celulares
- Papilas, algunas ramificadas
- Algunas células aisladas
- Criterios nucleares de malignidad, aunque pueden estar ausentes en caso de bajo grado
- Vacuolas intracitoplasmáticas
- Cuerpos de psammoma desnudos, o en grupos celulares (no específicos)
- SIMULA: otros carcinomas (primarios y secundarios) si es de bajo grado, indistinguible del tumor seroso de bajo potencial maligno
Citología seleccionada de BAAF testicular
- Seminoma
- Grandes células dispersas y algunos grupos.
- Núcleos desnudos, citoplasma delicado
- Células primitivas: núcleos centrales, cromatina vesicular fina, prominente nucleolo central
- Linfocitos de fondo, histiocitos epitelioides
- Fondo tigroide (espumoso, tipo bola, puede no existir o ser mínimo en preparaciones en capa fina)
- Positivo para PLAP, negativo para LCA, AFP y citoqueratina
- SIMULA: otros tumores de células germinales, linfoma maligno
- Carcinoma embrional
- Presencia de necrosis
- Papilar, tipo glándula o en placas
- Núcleos pleomórficos, cromatina gruesa, varios nucleolos prominentes
- Positivo para PLAP y citoqueratina, negativo para LCA y puede ser positivo para AFP
- SIMULA: otros tumores de células germinales, linfoma maligno, melanoma, carcinoma de alto grado
BAAF de hueso y tejido blando
La BAAF de las lesiones óseas y de tejido blando se suele emplear para confirmar una enfermedad metastásicas, normalmente un carcinoma. En algunos centros, la BAAF puede utilizarse para diagnosticar determinados sarcomas primarios de hueso o de tejido blando. La precisión diagnóstica es la más elevada de las BAAF de neoplasias metastásicas (varía entre el 92 y el 100%).
Citología de BAAF de metástasis de hueso o de tejido blando
- Carcinoma metastásico
- Necrosis en algunos casos
- Características nucleares de malignidad
- Grupos de células y células aisladas (disociación)
- Diferenciación neuroendocrina: altas relaciones núcleo/citoplasma, núcleos amoldados hipercromáticos de extendido con escaso citoplasma.
- Diferenciación glandular: vacuolas intracitoplasmáticas, bolas de células, papilas, glándulas
- Diferenciación escamosa: queratinización, citoplasma duro refráctil
- Diferenciación urotelial: células cercariformes (dominios citoplasmáticos)
- Normalmente positivo para citoqueratina
- Melanoma metastásico maligno
- Células aisladas de disociación
- Características nucleares de malignidad, núcleos excéntricos
- Rango de patrones: células pequeñas, fusiformes o epitelioides
- Variación en el tamaño nuclear
- Pseudoinclusiones nucleares con bi- y multinucleación
- Pigmento de melanina marrón borroso intracitoplasmático
- Positivo para S-100, HMB-45 y Melan-A (no siempre)
- Linfoma maligno
- Células aisladas de disociación
- Cromatina granular abierta
- Nucleolos basados en la membrana nuclear en algunos subtipos
- Protusiones e irregularidades en la membrana nuclear
- Escaso citoplasma en algunos subtipos (elevadas relaciones núcleo/citoplasma)
- Cuerpos linfoglandulares en el fondo de la muestra
- Positivo para LCA, línea de células B o T
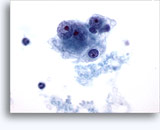
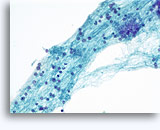
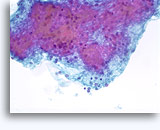
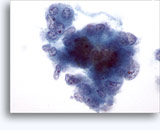
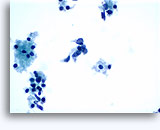
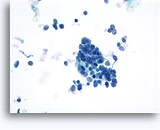
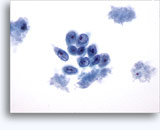
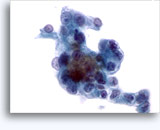
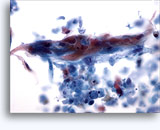
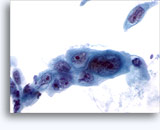
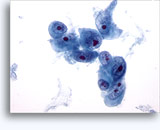
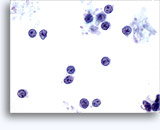
Figuras 37-38: Células aisladas de disociación con elevadas relaciones núcleo/citoplasma, escaso citoplasma, cromatina abierta, protusiones de la membrana y membrana basada en nucleolos. Cuerpos linfoglandulares en el fondo de la muestra.
Bibliografía
- Bommer KK, Ramzy I and Mody D. Fine-Needle Aspiration Biopsy in the Diagnosis and Management of Bone Lesions. Cancer (Cancer Cytopathology) 1997; 81:148-56.
- Caraway NP, Fanning CV, Amato RJ and Sneige N. Fine-Needle Aspiration Cytology of Seminoma: A Review of 16 Cases. Diagnostic Cytopathology 1995; 12:327-33.
- Geisinger KR et al. Modern Cytopathology. Philadelphia, Churchill Livingstone. 2004; pp 579-606, 689-700.
- Kabukcuoglu F, Kabukcuoglu Y, Kuzgun U and Evren I. Fine Needle aspiration of Malignant Bone Lesions. Acta Cytologica 1998;42:875-82.
- Liu J, Fanning CV. Can Renal Oncocytomas be Distinguished from Renal Cell Carcinoma on Fine-Needle Aspiration Specimens? Cancer (Cancer Cytopathol) 2001;93:390-7.
- Nguyen G and Akin MM. Fine Needle Aspiration Cytology of the Kidney, Renal Pelvis and Adrenal. In:Clinics in Laboratory Medicine. Stanley MW editor. Philadelphia. WB Saunders Company. 1998;18(3):429-60.
- Renshaw AA, Granter SR, Cibas ES. Fine-Needle Aspiration of the Adult Kidney. Cancer (Cancer Cytopathol) 1997;81:71-88.
- Renshaw, AA, Lee KR, Madge R, Granter SR. Accuracy of Fine Needle Aspiration in Distinguishing Subtypes of Renal Cell Carcinoma. Acta Cytol 1997;41:987-94.
- Wakely PE, Kneisl, JS. Soft Tissue Aspiration Cytopathology. Cancer (Cancer Cytopathol) 2000;90:292-8.
- Wiatrowska, BA, Zakowski MF. Fine-Needle Aspiration Biopsy of Chromophobe Renal Cell Carcinoma and Oncocytoma. Cancer (Cancer Cytopathol) 1999;87:161-7.
- Wu H H, Cramer HM, Kho J and Elsheikh, TM. Fine Needle Aspiration Cytology of Benign Adrenal Cortical Nodules. Acta Cytologica 1998;42:1352-8.
- Yang B, Syed ZA and Rosenthal DL. CD10 Facilitates the Diagnosis of Metastatic Renal Cell Carcinoma From Primary Adrenal Cortical Neoplasm in Adrenal Fine-Needle Aspiration. Diagn. Cytopathol. 2002;27:149-52.
- Zardauin IM. Renal FNAC Acta Cytol 1999;43:184-90.
- Zhang, PJ, Genega EM, Tomaszewski JE, Pasha TL, LiVolsi VA. The Role of Calretinin, Inhibin, Melan-A, BCL-2, and C-kit in Differentiating Adrenal Cortical and Medullary Tumors: An Immunohistochemical Study. Mod Pathol 2003;16(6):591-7.