Introducción
Latha Pisharodi, MD
El tracto gastrointestinal (GI), está dividido en esófago, estómago, intestino delgado e intestino grueso. Las diferentes divisiones están separadas por esfínteres que controlan el paso de contenidos de una parte del tracto GI a la siguiente. Además, cada una de estas divisiones se caracteriza por un cambio en la naturaleza de la mucosa de las células de revestimiento. El tracto GI es el órgano digestivo del cuerpo, una fuente de generación de inmunidad y un órgano endocrino.
Toma de muestras
Las muestras citológicas del tracto GI pueden obtenerse mediante cepillados, lavados o por biopsias por aspiración con aguja fina (BAAF) guiadas por ultrasonido. Normalmente, una muestra de cepillado se obtiene pasando un cepillo envuelto en una funda transparente a través del endoscopio e introduciéndolo en la lesión entre cinco y diez veces. A continuación, se retira el cepillo y se extrae la muestra depositándola en los portaobjetos o en un medio de preservación.
La BAAF endoscópica implica la introducción de la aguja a través de un endoscopio de fibra óptica. Una vez localizada la lesión, se aplica presión negativa a la aguja y ésta se mueve adelante y atrás por la lesión. Se libera la presión, se saca la aguja y se recoge la muestra en una solución de preservación.
Las muestras pueden recogerse en una solución CytoLyt® y procesarse utilizando el procesador ThinPrep® 2000 o recogerse en otra solución de preservación y procesarse como Cytospins o frotis tradicionales.
Esófago
Las células normales de revestimiento del esófago son células epiteliales escamosas no queratinizadas. Raramente se pueden observar células metaplásicas derivadas de glándulas submucosas. Las células glandulares columnares pueden provenir del estómago o del esófago de Barrett.
Normalmente, la esofagitis no específica presenta inflamación aguda y/o crónica con cambios reactivos. La esofagitis herpética presenta efectos citopáticos clásicos que consisten en multinucleación, inclusiones virales eosinófilas y núcleos borrosos. La esofagitis candidiásica se diagnostica por la detección de esporas de hongos e hifas pseudoseptadas. Raramente se pueden observar otros organismos como Aspergillus.
La evaluación citológica del esófago es una herramienta importante en el diagnóstico del carcinoma esofágico, especialmente en países con una alta incidencia de cáncer esofágico como China o Japón, en donde se usa como programa de screening masivo. Algunos autores han mostrado que una combinación citología–biopsia es la técnica más adecuada para el diagnóstico de neoplasias gastrointestinales superiores [1, 2]. Una displasia glandular surgida en un fondo de esófago de Barrett suele presentar células atípicas dispersas con algunas, pero no todas, las características del adenocarcinoma. Las células escamosas atípicas con formas abigarradas, hipercromasia y pleomorfismo caracterizan los carcinomas escamosos bien diferenciados. Los carcinomas escamosos poco diferenciados suelen presentar células altamente pleomórficas con elevada relación núcleo/citoplasma, nucleolos y citoplasma denso. Los adenocarcinomas suelen presentar grupos y agrupaciones de células epiteliales neoplásicas.
Estómago
El epitelio de revestimiento del estómago está formado por células glandulares columnares normalmente dispuestas en capas de panal de abeja. Pueden observarse vacuolas mucinosas. En los cepillados gástricos raramente se observan células parietales o principales. Las células parietales presentan citoplasma acidófilo con la tinción de Pap. Las células principales se identifican mejor mediante tinción de Romanowsky [3]. Las Helicobacter pylori son bacterias espirales gram-negativas fácilmente identificadas con tinciones de Pap, Romanowsky, Warthin-Starry y H & E. Los cambios reactivos y reparativos no específicos, las células inflamatorias, la actividad mitótica y los nucleolos prominentes son característicos de la úlcera péptica y de la gastritis. Los adenocarcinomas gástricos presentan células epiteliales malignas con una marcada atípia. Pueden aparecer células en anillo de sello. La presencia de células escamosas malignas sugiere la presencia de un carcinoma adenoescamoso, del poco frecuente carcinoma puro de estómago o de la extensión del carcinoma escamoso esofágico en el estómago. Otros tumores como los carcinoides y estromales son difícilmente diagnosticados mediante citología de cepillado gástrico. Sin embargo, la sensibilidad diagnóstica de estos tumores por citología es mucho más elevada mediante BAAF endoscópica que mediante cepillado.
Conducto biliar
Los cepillados de tracto biliar se obtienen normalmente mediante colangiopancreatografía retrógrada endoscópica (CPRE). Las muestras también pueden obtenerse a partir de stents (endoprótesis) biliares. La principal indicación para una citología biliar es la sospecha de malignidad en un paciente con una estenosis biliar. Los cambios reactivos y reparativos son frecuentes en enfermedades infecciosas y en colangitis esclerosante primaria (CEP). En el tracto biliar se puede observar displasia. Las características citológicas incluyen aglomeración y superposición, aumento de la relación núcleo/citoplasma y distribución anormal de cromatina. Por otra parte, la atípia es menos severa que en el adenocarcinoma. El adenocarcinoma en el tracto biliar (colangiocarcinoma) es similar citológicamente a los adenocarcinomas observados en el tracto GI. La variante mucinosa puede ser especialmente difícil de diagnosticar debido a sus características citológicas blandas. Estas células contienen abundante mucina y, en ocasiones, pueden confundirse con histiocitos.
Colon
Las células pueden obtenerse por cepillado endoscópico, por lavado o por PAAF. La mucosa normal del colon se caracteriza por células columnares altas dispuestas en capas o aisladas. También pueden observarse células caliciformes. Algunos autores han descrito hallazgos citológicos de adenoma en los que el adenoma tubular presenta células más planas y achatadas, mientras el adenoma velloso presenta células alargadas, puntiagudas y delgadas [4]. El adenocarcinoma de colon presenta grupos cohesionados y altamente atípicos de células glandulares con nucleolos prominentes y un fondo necrótico. La sensibilidad del cepillado de colon en el diagnóstico de carcinoma de colon varía entre un 70 y un 85 % [5]. No obstante, la combinación de la citología con la biopsia ofrece mayor precisión [6].
Cepillados anales
Al igual que la zona de transformación del cérvix, la unión escamocolumnar del canal anal es propensa al desarrollo de una neoplasia [7] . La apariencia citológica de los dos tipos de muestras es muy similar. De hecho, los hallazgos pueden clasificarse de acuerdo con los criterios definidos por el sistema de Bethesda [8] .
El material citológico a evaluar se obtiene fácilmente mediante raspado directo del área y extendido sobre portaobjetos o lavado en un medio de preservación. Además, los frotis anales de papanicolaou están siendo cada vez más utilizados como herramienta de cribado para evaluar los cambios displásicos, especialmente en la población VIH positiva [9]. Los carcinomas escamosos de la región anal presentan células escamosas neoplásicas características con diferentes grados de diferenciación.
Bibliografía
- C P Shroff, S A Nanivadekar: Endoscopic brushing cytology and biopsy in the diagnosis of upper gastrointestinal tract lesions. A study of 350 cases. Acta Cytol 1988: 32 (4}: 455-60.
- O Donoghue, P G Horgan, M K Donohoe et al: Adjunctive endoscopic brush cytology in the detection of upper gastrointestinal malignancy. Acta Cytol 1995: 39(1}: 28-33.
- M Drake: Gastric cytology: normal and abnormal. In Gastroesophageal Cytology. Basel: Karger, 1985, page 120.
- V Kannan, CB Masters: Cytodiagnosis of colonic adenoma: morphology and clinical importance. Diag Cytopathol 1991 7(4}: 13-16
- RG Bardawil, FG Ambrosio, SI Hajdu: Colonic cytology. A retrospective study with histologic correlation. Acta Cytol 1990; 34 (5}: 10-12
- M Halpern, R Gal, L Rath-Wolfson, R Koren et al. Brush cytology and biopsy in the diagnosis of colorectal cancer. A comparison. Acta Cytol 1997; 41 (3}: 628-32.
- Goldstone et al. High Prevalence of Anal Squamous Intraepithelial Lesions and Squamous Cell Carcinoma in Men Who Have Sex with Men as Seen in a Surgical Practice. Dis Colon Rectum 2001;44:690-698.
- Darragh et al. Comparison of Conventional Cytologic Smears and ThinPrep Preparations from the Anal Canal. Acta Cytol 1997;41:1167-70.
- MA Friedlander, E Stier, O Lin. Anorectal cytology as a screening tool for anal squamous lesions: cytologic, anoscopic, and histologic correlation. Cancer 2004: 102(1}:19-26.
Citología esofágica

Nota: Puede clicar en cualquier imagen del
Atlas para ver la imagen aumentada
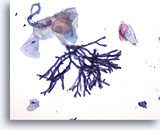
Figura 1
Cepillado esofágico, aspergillus
Cepillado esofágico que muestra la especie Aspergillus con hifas septadas, y ramificación de 45 grados. En raras ocasiones se puede observar una atípia de células escamosas asociada. 20x
Figura 1
Cepillado esofágico, aspergillus
Cepillado esofágico que muestra la especie Aspergillus con hifas septadas, y ramificación de 45 grados. En raras ocasiones se puede observar una atípia de células escamosas asociada.
20x
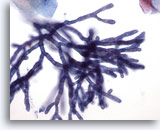
Figura 2
Cepillado esofágico, aspergillus
En la ampliación se pueden apreciar con claridad las septas y ramificación de 45 grados. 40x
Figura 2
Cepillado esofágico, aspergillus
En la ampliación se pueden apreciar con claridad las septas y ramificación de 45 grados.
40x
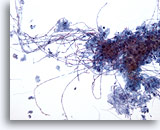
Figura 3
Cepillado esofágico, candida
La esofagitis candidiásica se caracteriza por la identificación de formas pseudohifales alargadas y de levadura ovoides. 20x
Figura 3
Cepillado esofágico, candida
La esofagitis candidiásica se caracteriza por la identificación de formas pseudohifales alargadas y de levadura ovoides.
20x
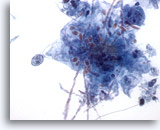
Figura 4
Cepillado esofágico, candida
Pueden observarse fácilmente las formas de levadura.60x
Figura 4
Cepillado esofágico, candida
Pueden observarse fácilmente las formas de levadura.
60x
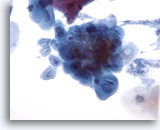
Figura 5
Cepillado esofágico, herpes
La infección herpética se muestra mediante características citológicas clásicas incluyendo multinucleación, amoldamiento de los núcleos y cromatina borrosa. 40x
Figura 5
Cepillado esofágico, herpes
La infección herpética se muestra mediante características citológicas clásicas incluyendo multinucleación, amoldamiento de los núcleos y cromatina borrosa.
40x

Figura 6
Cepillado esofágico, herpes
En infecciones por Herpes pueden observarse inclusiones intranucleares eosinófilas. 40x
Figura 6
Cepillado esofágico, herpes
En infecciones por Herpes pueden observarse inclusiones intranucleares eosinófilas.
40x
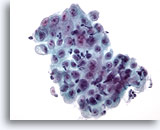
Figura 7
Cepillado esofágico, úlcera
Capa de células epiteliales con células inflamatorias superpuestas y cambios reactivos. 40x
Figura 7
Cepillado esofágico, úlcera
Capa de células epiteliales con células inflamatorias superpuestas y cambios reactivos.
40x
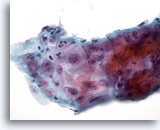
Figura 8
Cepillado esofágico, úlcera
Reparación atípica en una úlcera esofágica que muestra infiltración inflamatoria, atípia reactiva con nucleolos prominentes, membranas nucleares homogéneas y cromatina fina. 60x
Figura 8
Cepillado esofágico, úlcera
Reparación atípica en una úlcera esofágica que muestra infiltración inflamatoria, atípia reactiva con nucleolos prominentes, membranas nucleares homogéneas y cromatina fina.
60x
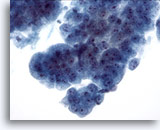
Figura 9
Cepillado esofágico, displasia de alto grado en epitelio de Barret.
Grupos cohesionados de células glandulares atípicas con algunas, aunque no todas, las características de un adenocarcinoma. 40x
Figura 9
Cepillado esofágico, displasia de alto grado en epitelio de Barret.
Grupos cohesionados de células glandulares atípicas con algunas, aunque no todas, las características de un adenocarcinoma.
40x
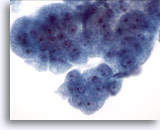
Figura 10
Cepillado esofágico, displasia de alto grado en epitelio de Barret.
Un grupo de células cohesionadas con núcleos de tamaño variable, alta relación núcleo/citoplasma, superposición y aglomeración. Las características citológicas no son suficientes para realizar un diagnóstico definitivo de adenocarcinoma. 60x
Figura 10
Cepillado esofágico, displasia de alto grado en epitelio de Barret.
Un grupo de células cohesionadas con núcleos de tamaño variable, alta relación núcleo/citoplasma, superposición y aglomeración. Las características citológicas no son suficientes para realizar un diagnóstico definitivo de adenocarcinoma.
60x
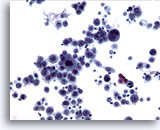
Figura 11
Cepillado esofágico, carcinoma escamoso..
Células epiteliales altamente atípicas diagnósticas de un carcinoma poco diferenciado. 20x
Figura 11
Cepillado esofágico, carcinoma escamoso..
Células epiteliales altamente atípicas diagnósticas de un carcinoma poco diferenciado. 20x
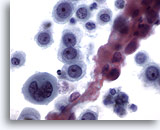
Figura 12
Cepillado esofágico, carcinoma escamoso poco diferenciado.
Células epiteliales atípicas con cromatina anormal. La diferenciación escamosa no es obvia. 60x
Figura 12
Cepillado esofágico, carcinoma escamoso poco diferenciado.
Células epiteliales atípicas con cromatina anormal. La diferenciación escamosa no es obvia.
60x
Citología gástrica
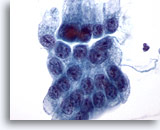
Figura 13
Cepillado gástrico, displasia gástrica.
Capa plana de células epiteliales gástricas atípicas con núcleos aumentados, aglomeración y superposición focal de células. 60x
Figura 13
Cepillado gástrico, displasia gástrica.
Capa plana de células epiteliales gástricas atípicas con núcleos aumentados, aglomeración y superposición focal de células.
60x
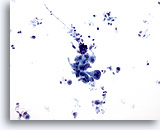
Figura 14
Cepillado gástrico, adenocarcinoma gástrico.
Grupo cohesionado de células atípicas. Observe el fondo sucio. 20x
Figura 14
Cepillado gástrico, adenocarcinoma gástrico.
Grupo cohesionado de células atípicas. Observe el fondo sucio.
20x
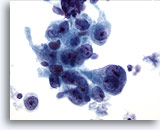
Figura 15
Cepillado gástrico, adenocarcinoma gástrico.
Células epiteliales neoplásicas que muestran pleomorfismo y nucleolos prominentes. 60x
Figura 15
Cepillado gástrico, adenocarcinoma gástrico.
Células epiteliales neoplásicas que muestran pleomorfismo y nucleolos prominentes.
60x
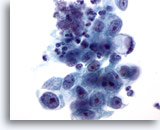
Figura 16
Cepillado gástrico, adenocarcinoma gástrico.
Adenocarcinoma con célula en anillo de sello en un extremo. Las células en anillo de sello se caracterizan por presentar inmensas vacuolas mucinosas que comprimen el núcleo hasta formar una media luna contra la membrana nuclear. 60x
Figura 16
Cepillado gástrico, adenocarcinoma gástrico.
Adenocarcinoma con célula en anillo de sello en un extremo. Las células en anillo de sello se caracterizan por presentar inmensas vacuolas mucinosas que comprimen el núcleo hasta formar una media luna contra la membrana nuclear.
60x
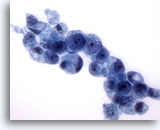
Figura 17
Cepillado gástrico, adenocarcinoma gástrico.
Más células en anillo de sello con morfología típica.
60x 60x
Figura 17
Cepillado gástrico, adenocarcinoma gástrico.
Más células en anillo de sello con morfología típica.
60x
60x
Citología colónica
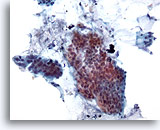
Figura 18
Cepillado de colón, adenocarcinoma de colón.
Cepillado de colón que muestra células epiteliales atípicas a bajo aumento.
20x
Figura 18
Cepillado de colón, adenocarcinoma de colón.
Cepillado de colón que muestra células epiteliales atípicas a bajo aumento.
20x
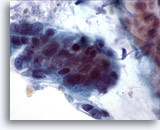
Figura 19
Cepillado de colón, adenocarcinoma de colón.
Ampliación que muestra pleomorfismo, aglomeración y superposición de células.60x
Figura 19
Cepillado de colón, adenocarcinoma de colón.
Ampliación que muestra pleomorfismo, aglomeración y superposición de células.
60x
Citología pancreática
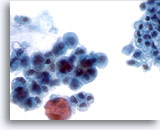
Figura 20
Cepillado ductal pancreático, adenocarcinoma pancreático.
Cepillado pancreático que muestra las características citológicas del adenocarcinoma de páncreas. Compárelo con el epitelio no neoplásico adyacente. 40x
Figura 20
Cepillado ductal pancreático, adenocarcinoma pancreático.
Cepillado pancreático que muestra las características citológicas del adenocarcinoma de páncreas. Compárelo con el epitelio no neoplásico adyacente.
40x
Citología ductal biliar
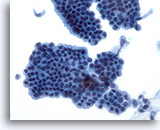
Figura 21
Cepillado ductal biliar, epitelio ductal biliar normal.
Capa en panel de abeja de células epiteliales sin atípia. 40x
Figura 21
Cepillado ductal biliar, epitelio ductal biliar normal.
Capa en panel de abeja de células epiteliales sin atípia.
40x

Figura 22
Cepillado ductal biliar, colangiocarcinoma.
Células epiteliales malignas adyacentes al epitelio ductal biliar normal. 20x
Figura 22
Cepillado ductal biliar, colangiocarcinoma.
Células epiteliales malignas adyacentes al epitelio ductal biliar normal.
20x
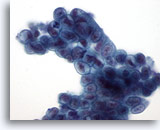
Figura 23
Cepillado ductal biliar, adenocarcinoma mucinoso bien diferenciado.
Grupo sincitial de epitelio mucinoso con hipercromasia nuclear y membranas nucleares irregulares. 60x
Figura 23
Cepillado ductal biliar, adenocarcinoma mucinoso bien diferenciado.
Grupo sincitial de epitelio mucinoso con hipercromasia nuclear y membranas nucleares irregulares.
60x
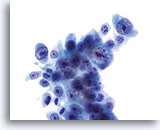
Figura 24
Cepillado ductal biliar, colangiocarcinoma.
Adenocarcinoma poco diferenciado con atípia nuclear severa y nucleolos prominentes.
60x
Figura 24
Cepillado ductal biliar, colangiocarcinoma.
Adenocarcinoma poco diferenciado con atípia nuclear severa y nucleolos prominentes.
60x
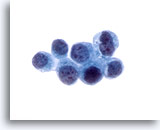
Figura 25
Cepillado ductal biliar, carcinoma metastásico de mama.
Adenocarcinoma metastático de la mama. El diagnóstico se confirmó mediante tinciones inmunohistoquímicas en el bloque celular. 60x
Figura 25
Cepillado ductal biliar, carcinoma metastásico de mama.
Adenocarcinoma metastático de la mama. El diagnóstico se confirmó mediante tinciones inmunohistoquímicas en el bloque celular.
60x
Citología anal
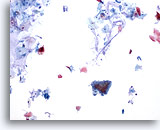
Figura 26
Cepillado anal, epitelio glandular normal.
Los cepillados anales suelen contener mucina en el fondo, epitelio glandular normal y escamoso normal. La hiperqueratosis es normalmente abundante.
10x
Figura 26
Cepillado anal, epitelio glandular normal.
Los cepillados anales suelen contener mucina en el fondo, epitelio glandular normal y escamoso normal. La hiperqueratosis es normalmente abundante.
10x
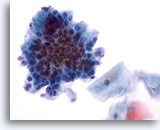
Figura 27
Cepillado anal, epitelio glandular normal.
En la imagen a mayor aumento se aprecia la morfología pavimentosa y en empalizada.
40x
Figura 27
Cepillado anal, epitelio glandular normal.
En la imagen a mayor aumento se aprecia la morfología pavimentosa y en empalizada.
40x

Figura 28
Cepillado anal, células escamosas atípicas (ASC).
Cambios que sugieren HPV, pero que no son suficientes para un diagnóstico de LSIL en la categoría ASC.
40x
Figura 28
Cepillado anal, células escamosas atípicas (ASC).
Cambios que sugieren HPV, pero que no son suficientes para un diagnóstico de LSIL en la categoría ASC.
40x
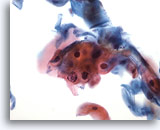
Figura 29
Cepillado anal, células escamosas atípicas (ASC).
Paraqueratosis (pk) atípica, no diagnóstica de LSIL, dentro en la categoría de ASC. 40x
Figura 29
Cepillado anal, células escamosas atípicas (ASC).
Paraqueratosis (pk) atípica, no diagnóstica de LSIL, dentro en la categoría de ASC.
40x
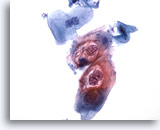
Figura 30
Cepillado anal, lesión intraepitelial anal de bajo grado.
Estas células exhiben la binucleación y las cavitaciones citoplásmicas asociadas a las infecciones HPV y permiten el diagnóstico de lesiones intraepiteliales anales de bajo grado.
40x
Figura 30
Cepillado anal, lesión intraepitelial anal de bajo grado.
Estas células exhiben la binucleación y las cavitaciones citoplásmicas asociadas a las infecciones HPV y permiten el diagnóstico de lesiones intraepiteliales anales de bajo grado.
40x

Figura 31
Cepillado anal, lesión intraepitelial anal de bajo grado.
Células metaplásicas escamosas con núcleos aumentados que pueden ser características de lesiones intraepiteliales anales de bajo grado. 40x
Figura 31
Cepillado anal, lesión intraepitelial anal de bajo grado.
Células metaplásicas escamosas con núcleos aumentados que pueden ser características de lesiones intraepiteliales anales de bajo grado.
40x
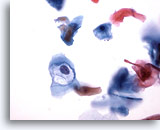
Figura 32
Cepillado anal, lesión intraepitelial anal de bajo grado.
La cavitación causada por HPV es diagnóstica de lesiones intraepiteliales anales de bajo grado.
40x
Figura 32
Cepillado anal, lesión intraepitelial anal de bajo grado.
La cavitación causada por HPV es diagnóstica de lesiones intraepiteliales anales de bajo grado.
40x
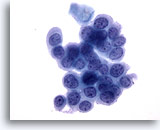
Figura 33
Cepillado anal, lesión intraepitelial anal de alto grado.
Las células redondeadas con elevada relación núcleo/citoplasma y la cromatina uniformemente distribuida son características citológicas que permiten diagnosticar una lesión intraepitelial anal de alto grado.40x
Figura 33
Cepillado anal, lesión intraepitelial anal de alto grado.
Las células redondeadas con elevada relación núcleo/citoplasma y la cromatina uniformemente distribuida son características citológicas que permiten diagnosticar una lesión intraepitelial anal de alto grado.
40x
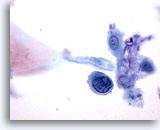
Figura 34
Las células aisladas con elevada relación núcleo/citoplasma y los núcleos hipercromáticos permiten diagnosticar lesiones intraepiteliales anales de alto grado. 60x
Figura 34
Cepillado anal, lesión intraepitelial anal de alto grado.
Las células aisladas con elevada relación núcleo/citoplasma y los núcleos hipercromáticos permiten diagnosticar lesiones intraepiteliales anales de alto grado.
60x
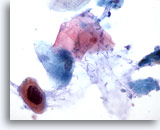
Figura 35
Cepillado anal, lesión intraepitelial anal de alto grado.
Las células queratinizadas atípicas con núcleos hipercromáticos aumentados se observan en algunas ocasiones en lesiones intraepiteliales anales de alto grado. 60x
Figura 35
Cepillado anal, lesión intraepitelial anal de alto grado.
Las células queratinizadas atípicas con núcleos hipercromáticos aumentados se observan en algunas ocasiones en lesiones intraepiteliales anales de alto grado.
60x
Volver arriba
Volver a la Tabla de Contenidos



































