TIROIDES
Helen H. Wang, MD, DrPH
Introducción
Los nódulos de tiroides son hallazgos clínicos comunes con una tasa de incidencia anual estimada del 4-8%. 1 En todo momento existen entre 10 y 20 millones de norteamericanos con nódulos tiroideos detectables. 1 La aspiración con aguja fina (PAAF) de tiroides es la prueba inicial en la gestión de la mayoría de los pacientes con un nódulo tiroideo, ya que se trata de un procedimiento seguro y barato que proporciona una selección de los pacientes candidatos a cirugía mejor que ninguna otra prueba. 2 Por ello, la PAAF de tiroides es, sin duda, el tipo de muestra de PAAF más común en un laboratorio de citología. Aunque ha sido ampliamente aceptada y practicada desde los años 70, el procesado y realización de informes de las PAAF de tiroides siguen despertando controversias.
Toma de muestras y procesado
La PAAF de tiroides se obtiene con ayuda de la palpación o del ultrasonido, dependiendo del tamaño de la lesión. Ambas se procesan de la misma forma, es decir, mediante la realización de un extendido directo convencional a partir del aspirado o mediante lavado del aspirado en una solución de preservación para obtener una preparación de base líquida. Dos estudios en los que se compara la precisión de las preparaciones ThinPrep® frente a los extendidos convencionales para PAAF de tiroides coinciden en el hecho de que ambos métodos presentan una precisión comparable para las neoplasias de tiroides, 3, 4 aunque uno de ellos establece que las preparaciones ThinPrep presentan una menor correlación global con el diagnóstico histológico que los extendidos directos, especialmente en la detección de la tiroiditis linfocítica crónica (62% para ThinPrep frente al 92% para los extendidos directos). 4 Además, algunos autores han sugerido que las preparaciones ThinPrep no permiten detectar un coloide difuso o acuoso. 3, 5 En un estudio realizado por Tulecke et al., el material con textura de «papel de seda» de las preparaciones ThinPrep se mostró asociado a abundante coloide en histología y probablemente representa un coloide acuoso. 6 En resumen, el coloide parece presentarse en menor cantidad en ThinPrep que en los extendidos convencionales. Sin embargo, ThinPrep es superior a los extendidos convencionales, ya sea fijado en alcohol o secado al aire, a la hora de mostrar las características nucleares que son cruciales para el diagnóstico del carcinoma papilar. Por otra parte, ThinPrep parece romper los folículos y presenta células foliculares en capas, grupos o incluso en células aisladas de forma más sencilla que los extendidos convencionales.
Realización de informes
En la literatura se han propuesto y utilizado numerosos esquemas para la realización de informes. Nosotros hemos encontrado un esquema basado en la probabilidad de encontrar un carcinoma en histología, que puede ser útil para patólogos y médicos.
Positivo para malignidad
Las muestras de esta categoría representan aquellos casos en los que se encuentra una malignidad en las resecciones en prácticamente el 100% de las ocasiones. El carcinoma papilar es una de las malignidades más comunes del tiroides y presenta características nucleares específicas que son fácilmente identificables en las muestras citológicas. Otras malignidades que se pueden diagnosticar con una gran precisión mediante citología incluyen los carcinomas medulares, los linfomas y los carcinomas metastáticos. El carcinoma papilar se caracteriza en ThinPrep por la presencia de capas y grupos papilares de células aglomeradas con aumento y amoldamiento nuclear, cromatina borrosa, membranas nucleares irregulares, como se evidencia por los surcos nucleares e inclusiones citoplasmáticas intranucleares, y pequeños pero prominentes nucleolos que a menudo son eosinófilos. 7 Por otra parte, el carcinoma medular se caracteriza por la presencia de células plasmocitoides monomórficas aisladas que presentan una elevada relación núcleo/citoplasma, núcleos excéntricos y cromatina granular engrosada con o sin nucleolos prominentes. Pequeños gránulos discretos llenan el citoplasma. De forma ocasional, las células aparecen alargadas y delgadas, pero siguen mostrando las mismas características nucleares. Los linfomas y carcinomas metastáticos de tiroides son mucho menos comunes. Sus características citológicas dependen del tipo y del lugar de origen , respectivamente.
Sospechoso de malignidad
Cuando la muestra no es hipercelular o se observa la presencia de muchas, pero no todas, las características anteriormente descritas para el carcinoma papilar y medular o para otras malignidades, se diagnostica como sospechosa de malignidad. El valor predictivo positivo (tasa de malignidad en histología) de «sospechoso de carcinoma papilar» varía en la literatura entre el 54 y el 84%, dependiendo de si existe una categoría menos definitiva, como puede ser ‘indeterminado’. 7, 8, 9, 10 Cuando se incluye una categoría de ‘indeterminado’ además de la categoría de ‘sospechoso’, el VPP para la categoría de ‘sospechoso’ es del 64% o superior. 7, 9, 10 Dado que los otros tipos de carcinomas de tiroides son mucho menos comunes, sus valores predictivos positivos de un diagnóstico de ‘sospechoso’ no han sido descritos.
Indeterminado para malignidad
Esta categoría incluye, en nuestro laboratorio, a aquellas muestras que presentan un valor predictivo de malignidad en histología inferior al 50% (en general, inferior al 30%) y superior al 10%. 6, 7 En ella se incluyen aquellas muestras que presentan algunas características de carcinoma papilar, pero que sean insuficientes para realizar un diagnóstico de ‘sospechoso’. 7 Su valor predictivo positivo varía en la literatura entre el 20 y el 54%. 7, 9, 10, 11. Estas lesiones representan, a menudo, la variante folicular del carcinoma papilar. Esta categoría diagnóstica también incluye las neoplasias foliculares y de células de Hürthle , caracterizadas por la presencia de escaso coloide y células foliculares en microfolículos y grupos aglomerados o en células de Hürthle aisladas. El valor predictivo positivo de estas lesiones para un carcinoma varía en la literatura desde el 2 hasta el 91%, 6, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27 probablemente debido a las diferentes definiciones de estos términos y a los diversos criterios empleados en su esquema, así como en el diagnóstico histológico, aunque es inferior al 30% en muchos de los informes. 10, 15, 22, 24, 27.
Muy probablemente benigno
Esta categoría incluye a aquellas lesiones foliculares que muestran un patrón macrofolicular o micro- y macrofolicular mezclado con cantidad normal a abundante de coloide en el fondo. En ThinPrep, se observan macrofolículos como capas de docenas de células foliculares uniformemente espaciadas con una distancia adecuada entre los núcleos. La importancia de las células foliculares aisladas en ThinPrep no está clara, ya que se observan en un patrón micro- o macrofolicular. La probabilidad de que estas lesiones muestren malignidad (variante folicular del carcinoma papilar o carcinoma folicular) en histología es baja pero no llega a ser cero, variando en la literatura entre 0 y 43%, 6, 9, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 24, 25, 26, 27, 14, 16, 27 siendo inferior al 6%, por lo que nosotros la denominamos ‘muy probablemente benigna’ en lugar de ‘inequívocamente benigna’.
Células negativas para malignidad compatibles con la tiroiditis de Hashimoto
Hemos observado que ThinPrep no es el procedimiento óptimo para el diagnóstico de la tiroiditis. 6 La tiroiditis de Hashimoto se caracteriza por presentar capas o grupos de células foliculares con diversos grados de cambios en las células de Hürthle en un fondo con un número variable de linfocitos y células plasmáticas con ocasionales agregados centrales linfoides y foliculares. Dado que la tiroiditis linfocítica/de Hashimoto es un hallazgo común en el tiroides, la toma de muestras es una fase crítica para descartar otras lesiones coexistentes más significativas.
La celularidad es subóptima pero muestra características que sugieren …
Dado que la PAAF de tiroides selecciona esencialmente a pacientes candidatos a otras cirugías o seguimientos, desearíamos tener una celularidad más que adecuada para poder realizar un diagnóstico definitivo de esta selección. Si la celularidad es subóptima (pero suficiente para sugerir un diagnóstico), comenzaríamos el informe con esta calificación y seguiríamos con una de las categorías anteriores. Esta categoría incluye a aquella muestras que presenten contenido quístico (macrófagos) con muy pocas células foliculares. No disponemos de un límite cuantitativo para esta categoría, sino que nos basamos en una combinación de características, incluyendo la cantidad de coloide y la disposición celular, así como las características citológicas, para tomar una decisión.
No diagnóstico
Esta categoría suele estar reservada a aquellas muestras que no presentan prácticamente ninguna, o casi ninguna, célula folicular.
Bibliografía
- Cramer H. Fine-needle aspiration cytology of the thyroid: an appraisal. Cancer 2000; 90(6):325-9.
- Mazzaferri EL. Management of a solitary thyroid nodule see comments. N Engl J Med 1993; 328(8):553-9.
- Biscotti CV, Hollow JA, Toddy SM, Easley KA. ThinPrep versus conventional smear cytologic preparations in the analysis of thyroid fine-needle aspiration specimens. Am J Clin Pathol 1995; 104(2):150-3.
- Frost AR, Sidawy MK, Ferfelli M, et al. Utility of thin-layer preparations in thyroid fine-needle aspiration: diagnostic accuracy, cytomorphology, and optimal sample preparation. Cancer 1998; 84(1):17-25.
- Afify AM, Liu J, Al-Khafaji BM. Cytologic artifacts and pitfalls of thyroid fine-needle aspiration using ThinPrep: a comparative retrospective review. Cancer 2001; 93(3):179-86.
- Tulecke MA, Wang HH. ThinPrep for cytologic evaluation of follicular thyroid lesions: correlation with histologic findings. Diagn Cytopathol 2004; 30(1):7-13.
- Zhang Y, Fraser JL, Wang HH. Morphologic predictors of papillary carcinoma on fine-needle aspiration of thyroid with ThinPrep preparations. Diagn Cytopathol 2001; 24(6):378-83.
- Chen H, Zeiger MA, Clark DP, Westra WH, Udelsman R. Carcinoma papilar of the thyroid: can operative management be based solely on fine-needle aspiration? J Am Coll Surg 1997; 184(6):605-10.
- Renshaw AA. Accuracy of thyroid fine-needle aspiration using receiver operator characteristic curves. Am J Clin Pathol 2001; 116(4):477-82.
- Goldstein RE, Netterville JL, Burkey B, Johnson JE. Implications of follicular neoplasms, atypia, and lesions suspicious for malignancy diagnosed by fine-needle aspiration of thyroid nodules. Ann Surg 2002; 235(5):656-62; discussion 662-4.
- Renshaw AA. Focal features of papillary carcinoma of the thyroid in fine-needle aspiration material are strongly associated with papillary carcinoma at resection. Am J Clin Pathol 2002; 118(2):208-10.
- Al-Rikabi AC, Al-Omran M, Cheema M, El-Khwsky F, Al-Nuaim A. Pattern of thyroid lesions and role of fine needle aspiration cytology (FNA) in the management of thyroid enlargement: a retrospective study from a teaching hospital in Riyadh. Apmis 1998; 106(11):1069-74.
- Baloch ZW, Tam D, Langer J, Mandel S, LiVolsi VA, Gupta PK. Ultrasound-guided fine-needle aspiration biopsy of the thyroid: role of on-site assessment and multiple cytologic preparations. Diagn Cytopathol 2000; 23(6):425-9.
- Boyd LA, Earnhardt RC, Dunn JT, Frierson HF, Hanks JB. Preoperative evaluation and predictive value of fine-needle aspiration and frozen section of thyroid nodules. J Am Coll Surg 1998; 187(5):494-502.
- Hawkins F, Bellido D, Bernal C, et al. Fine needle aspiration biopsy in the diagnosis of thyroid cancer and thyroid disease. Cancer 1987; 59(6):1206-9.
- Ko HM, Jhu IK, Yang SH, et al. Clinicopathologic analysis of fine needle aspiration cytology of the thyroid. A review of 1,613 cases and correlation with histopathologic diagnoses. Acta Cytol 2003; 47(5):727-32.
- Mandreker SR, Nadkarni NS, Pinto RG, Menezes S. Role of fine needle aspiration cytology as the initial modality in the investigation of thyroid lesions. Acta Cytol 1995; 39(5):898-904.
- Miller JM, Kini SR, Hamburger JI. The diagnosis of malignant follicular neoplasms of the thyroid by needle biopsy. Cancer 1985; 55(12):2812-7.
- Morgan JL, Serpell JW, Cheng MS. Fine-needle aspiration cytology of thyroid nodules: how useful is it? ANZ J Surg 2003; 73(7):480-3.
- Prinz RA, O’Morchoe PJ, Barbato AL, et al. Fine needle aspiration biopsy of thyroid nodules. Ann Surg 1983; 198(1):70-3.
- Ravetto C, Colombo L, Dottorini ME. Usefulness of fine-needle aspiration in the diagnosis of thyroid carcinoma: a retrospective study in 37,895 patients. Cancer 2000; 90(6):357-63.
- Nam-Goong IS, Kim HY, Gong G, et al. Ultrasonography-guided fine-needle aspiration of thyroid incidentaloma: correlation with pathological findings. Clin Endocrinol (Oxf) 2004; 60(1):21-8.
- Silverman JF, West RL, Larkin EW, et al. The role of fine-needle aspiration biopsy in the rapid diagnosis and management of thyroid neoplasm. Cancer 1986; 57(6):1164-70.
- La Rosa GL, Belfiore A, Giuffrida D, et al. Evaluation of the fine needle aspiration biopsy in the preoperative selection of cold thyroid nodules. Cancer 1991; 67(8):2137-41.
- DeMay RM. Follicular lesions of the thyroid. W(h)ither follicular carcinoma? Am J Clin Pathol 2000; 114(5):681-3.
- Mateša N, Tabain I, Dabelic N, Petric V, Kusic Z. Diagnostic relevance of fine needle aspiration cytology for follicular lesions of the thyroid: retrospective study. Croat Med J 2002; 43(5):606-9.
- Blansfield JA, Sack MJ, Kukora JS. Recent experience with preoperative fine-needle aspiration biopsy of thyroid nodules in a community hospital. Arch Surg 2002; 137(7):818-21.

Positivo para carcinoma papilar
Nota: Puede clicar en cualquier imagen del
Atlas para ver la imagen aumentada
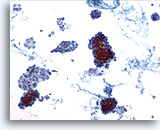
Figura 1
Carcinoma papilar.
El primer criterio para realizar un diagnóstico definitivo de carcinoma papilar es la hipercelularidad con numerosas capas y grupos cohesionados de células foliculares en una imagen a bajo aumento como la mostrada en esta figura. 10x
Figura 1
Carcinoma papilar.
El primer criterio para realizar un diagnóstico definitivo de carcinoma papilar es la hipercelularidad con numerosas capas y grupos cohesionados de células foliculares en una imagen a bajo aumento como la mostrada en esta figura.
10x
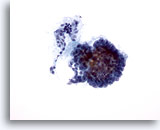
Figura 2
Carcinoma papilar.
Para realizar un diagnóstico definitivo de carcinoma papilar no es necesaria una estructura papilar como la observada en esta figura. 20X
Figura 2
Carcinoma papilar.
Para realizar un diagnóstico definitivo de carcinoma papilar no es necesaria una estructura papilar como la observada en esta figura.
20X
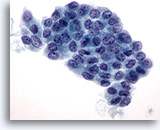
Figura 3
Carcinoma papilar.
En las preparaciones ThinPrep, los carcinomas papilares se presentan frecuentemente como placas de células foliculares aumentadas con membranas nucleares irregulares, y nucleolos pequeños pero prominentes y, a menudo, eosinófilos. 60X
Figura 3
Carcinoma papilar.
En las preparaciones ThinPrep, los carcinomas papilares se presentan frecuentemente como placas de células foliculares aumentadas con membranas nucleares irregulares, y nucleolos pequeños pero prominentes y, a menudo, eosinófilos.
60X
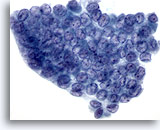
Figura 4
Carcinoma papilar.
En esta figura se ilustran la aglomeración, superposición y amoldamiento nuclear, como resultado de un marcado aumento del tamaño nuclear, así como una cromatina borrosa junto con la aparición de surcos nucleares y de inclusiones citoplasmáticas intranucleares. 60X
Figura 4
Carcinoma papilar.
En esta figura se ilustran la aglomeración, superposición y amoldamiento nuclear, como resultado de un marcado aumento del tamaño nuclear, así como una cromatina borrosa junto con la aparición de surcos nucleares y de inclusiones citoplasmáticas intranucleares.
60X
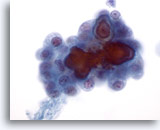
Figura 5
Aunque las características mostradas en las Figuras 1 – 4 son suficientes para realizar un diagnóstico definitivo de carcinoma papilar, resulta tranquilizador ver cuerpos de psammoma como los mostrados en esta figura. Los cuerpos de psammoma se observan raramente y no son necesarios para realizar un diagnóstico definitivo de carcinoma papilar. 60x
Figura 5
Carcinoma papilar.
Aunque las características mostradas en las Figuras 1 – 4 son suficientes para realizar un diagnóstico definitivo de carcinoma papilar, resulta tranquilizador ver cuerpos de psammoma como los mostrados en esta figura. Los cuerpos de psammoma se observan raramente y no son necesarios para realizar un diagnóstico definitivo de carcinoma papilar.
60x
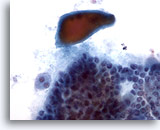
Figura 6
Carcinoma papilar.
En un carcinoma papilar se observa en ocasiones un coloide denso como el mostrado en esta figura, aunque no es específico. 40x
Figura 6
Carcinoma papilar.
En un carcinoma papilar se observa en ocasiones un coloide denso como el mostrado en esta figura, aunque no es específico.
40x
Sospechoso de carcinoma papilar
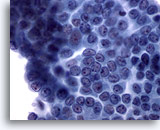
Figura 7: Carcinoma papilar.
En esta placa de células se observan muchas, aunque no todas, las características del carcinoma papilar, como son la cromatina borrosa, los surcos nucleares y los nucleolos pequeños pero prominentes. No hay evidencia de inclusiones citoplasmáticas intranucleares. Además, los núcleos están aumentados, pero no hasta el grado de amoldamiento y aglomeración. En el 65 al 90% de estos casos se confirma mediante histología que se trata de un carcinoma papilar. En consideración al 10-35% restante de los casos, esta muestra se diagnostica probablemente mejor como ‘sospechosa de carcinoma papilar’. 60x
Figura 7
Carcinoma papilar.
En esta placa de células se observan muchas, aunque no todas, las características del carcinoma papilar, como son la cromatina borrosa, los surcos nucleares y los nucleolos pequeños pero prominentes. No hay evidencia de inclusiones citoplasmáticas intranucleares. Además, los núcleos están aumentados, pero no hasta el grado de amoldamiento y aglomeración. En el 65 al 90% de estos casos se confirma mediante histología que se trata de un carcinoma papilar. En consideración al 10-35% restante de los casos, esta muestra se diagnostica probablemente mejor como ‘sospechosa de carcinoma papilar’.
60x
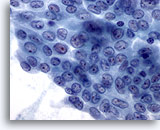
Figura 8
Carcinoma papilar.
Al igual que en la Figura 7, esta capa de células presenta muchas, pero no todas, las características de un carcinoma papilar. Se puede debatir si debería describirse como ‘positiva para carcinoma papilar’ o como ‘sospechosa’. Ambos diagnósticos serían correctos. Por supuesto, las células encontradas en el resto de la muestra también contribuirían al diagnóstico final. 60X
Figura 8
Carcinoma papilar.
Al igual que en la Figura 7, esta capa de células presenta muchas, pero no todas, las características de un carcinoma papilar. Se puede debatir si debería describirse como ‘positiva para carcinoma papilar’ o como ‘sospechosa’. Ambos diagnósticos serían correctos. Por supuesto, las células encontradas en el resto de la muestra también contribuirían al diagnóstico final.
60X
Indeterminado para carcinoma papilar, carcinoma papilar con cambio quístico
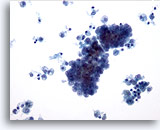
Figura 9
Carcinoma papilar.
En esta figura se observa un cambio quístico, caracterizado por la presencia de macrófagos en el fondo, que es habitual en un carcinoma papilar. 20x
Figura 9
Carcinoma papilar.
En esta figura se observa un cambio quístico, caracterizado por la presencia de macrófagos en el fondo, que es habitual en un carcinoma papilar.
20x
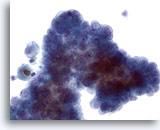
Figura 10
Carcinoma papilar.
Cuando los carcinomas papilares se convierten en quísticos, sus características nucleares típicas se hacen menos aparentes. En este grupo aglomerado de células se observan nucleolos pequeños pero prominentes con cromatina borrosa. Sin embargo, el aumento nuclear y las irregularidades de las membranas no son obvias. 40x
Figura 10
Carcinoma papilar.
Cuando los carcinomas papilares se convierten en quísticos, sus características nucleares típicas se hacen menos aparentes. En este grupo aglomerado de células se observan nucleolos pequeños pero prominentes con cromatina borrosa. Sin embargo, el aumento nuclear y las irregularidades de las membranas no son obvias.
40x
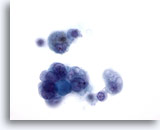
Figura 11: Carcinoma papilar.
Este campo de visión proviene de la misma muestra que la Figura 10. En él, las características nucleares de este carcinoma papilar confirmado histológicamente son aún menos aparentes. Dado que no todas las lesiones con algunas de las características nucleares del carcinoma papilar, con o sin cambio quístico, son realmente carcinomas papilares, es preferible describir este tipo de muestras como “indeterminadas” para carcinoma papilar. En la literatura, en el 20 al 54% de estos casos se confirma mediante histología que se trata de un carcinoma papilar. 60x
Figura 11
Carcinoma papilar.
Este campo de visión proviene de la misma muestra que la Figura 10. En él, las características nucleares de este carcinoma papilar confirmado histológicamente son aún menos aparentes. Dado que no todas las lesiones con algunas de las características nucleares del carcinoma papilar, con o sin cambio quístico, son realmente carcinomas papilares, es preferible describir este tipo de muestras como “indeterminadas” para carcinoma papilar. En la literatura, en el 20 al 54% de estos casos se confirma mediante histología que se trata de un carcinoma papilar.
60x
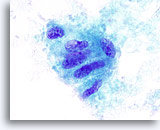
Figura 12
Indeterminado para carcinoma papilar, adenoma trabecular hialinizante.
Este grupo de células foliculares muestra irregularidades nucleares, pequeños nucleolos prominentes y una inclusión probable. Esta PAAF se describió como “indeterminada para carcinoma papilar”. La muestra de tiroidectomía mostró un adenoma trabecular hialinizante.
100x
Figura 12
Indeterminado para carcinoma papilar, adenoma trabecular hialinizante.
Este grupo de células foliculares muestra irregularidades nucleares, pequeños nucleolos prominentes y una inclusión probable. Esta PAAF se describió como “indeterminada para carcinoma papilar”. La muestra de tiroidectomía mostró un adenoma trabecular hialinizante.
100x
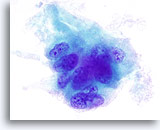
Figura 13
Como en la Figura 12, se observan surcos nucleares y pequeños nucleolos prominentes. El material amorfo verde que rodea este grupo de células se identifica como colágeno cuando se compara con la histología de la lesión. 100x
Figura 13
Indeterminado para carcinoma papilar, adenoma trabecular hialinizante.
Como en la Figura 12, se observan surcos nucleares y pequeños nucleolos prominentes. El material amorfo verde que rodea este grupo de células se identifica como colágeno cuando se compara con la histología de la lesión.
100x
Positivo para carcinoma medular

Figura 14
Carcinoma medular.
Normalmente, el carcinoma medular se presenta en PAAF como grupos poco rígidos de células plasmocitoides monomórficas y como esas mismas células aisladas. En este campo de visión se observa un fragmento de amiloide. 20x
Figura 14
Carcinoma medular.
Normalmente, el carcinoma medular se presenta en PAAF como grupos poco rígidos de células plasmocitoides monomórficas y como esas mismas células aisladas. En este campo de visión se observa un fragmento de amiloide.
20x
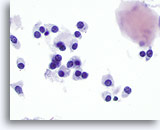
Figura 15
Carcinoma medular.
En una imagen a mayor aumento, las células tumorales son redondas, ovales, poligonales o largas y delgadas con núcleos con la misma apariencia. En la esquina superior derecha de la figura se observa un fragmento de amiloide. 60x
Figura 15
Carcinoma medular.
En una imagen a mayor aumento, las células tumorales son redondas, ovales, poligonales o largas y delgadas con núcleos con la misma apariencia. En la esquina superior derecha de la figura se observa un fragmento de amiloide.
60x
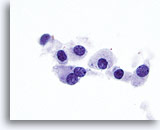
Figura 16
Carcinoma medular.
A un aumento todavía mayor, se aprecian el citoplasma finamente granular y la cromatina granular engrosada. Ocasionalmente se observan nucleolos prominentes y binucleación característica del carcinoma medular. 100x
Figura 16
Carcinoma medular.
A un aumento todavía mayor, se aprecian el citoplasma finamente granular y la cromatina granular engrosada. Ocasionalmente se observan nucleolos prominentes y binucleación característica del carcinoma medular.
100x
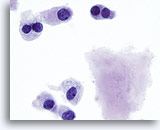
Figura 17
Carcinoma medular.
Se observan más células binucleadas con amiloide. 100x
Figura 17
Carcinoma medular.
Se observan más células binucleadas con amiloide.
100x
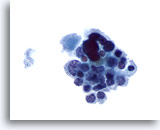
Figura 18
Carcinoma medular.
En esta figura se aprecia un grupo poco rígido de células básicamente pequeñas y uniformes con células grandes atípicas ocasionales. Las células pequeñas presentan núcleos excéntricos y citoplasma finamente granular. Esta figura y la siguiente ilustran una presentación poco habitual del carcinoma medular en una PAAF. 60x
Figura 18
Carcinoma medular.
En esta figura se aprecia un grupo poco rígido de células básicamente pequeñas y uniformes con células grandes atípicas ocasionales. Las células pequeñas presentan núcleos excéntricos y citoplasma finamente granular. Esta figura y la siguiente ilustran una presentación poco habitual del carcinoma medular en una PAAF.
60x
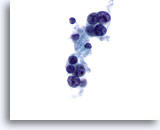
Figura 19
Carcinoma medular.
En algunas ocasiones, el carcinoma medular muestra nucleolos prominentes como los observados en esta figura. En ella, la mayor parte de las células han perdido su citoplasma. 60x
Figura 19
Carcinoma medular.
En algunas ocasiones, el carcinoma medular muestra nucleolos prominentes como los observados en esta figura. En ella, la mayor parte de las células han perdido su citoplasma.
60x
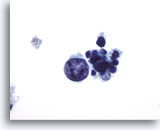
Figura 20
Carcinoma medular.
En este campo de visión se observa una célula tumoral muy grande, atípica pero degenerada con varias células tumorales pequeñas, uniformes y degeneradas. 60x
Figura 20
Carcinoma medular.
En este campo de visión se observa una célula tumoral muy grande, atípica pero degenerada con varias células tumorales pequeñas, uniformes y degeneradas.
60x
Positivo para carcinoma anaplástico de tiroides
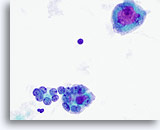
Figura 21
En la mitad inferior de la figura se observan dos microfolículos, que están compuestos por células foliculares atípicas de tamaño aumentado, algunas de ellas con nucleolos prominentes. Una célula gigante de tipo osteoclasto aparece en la mitad superior con nucleolos grandes y prominentes. 60x
Figura 21
Carcinoma anaplástico.
En la mitad inferior de la figura se observan dos microfolículos, que están compuestos por células foliculares atípicas de tamaño aumentado, algunas de ellas con nucleolos prominentes. Una célula gigante de tipo osteoclasto aparece en la mitad superior con nucleolos grandes y prominentes.
60x
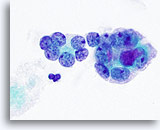
Figura 22
Carcinoma anaplástico.
Una imagen a mayor aumento de los microfolículos de la Figura 21. 100x
Figura 22
Carcinoma anaplástico.
Una imagen a mayor aumento de los microfolículos de la Figura 21.
100x
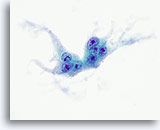
Figura 23
Carcinoma anaplástico.
Otra célula gigante de tipo osteoclasto. 60x
Figura 23
Carcinoma anaplástico.
Otra célula gigante de tipo osteoclasto.
60x
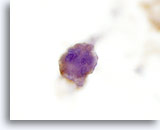
Figura 24
Carcinoma anaplástico.
Las células tumorales son positivas para tiroglobulina en inmunocitoquímica, confirmando su origen tiroideo. 60x
Figura 24
Carcinoma anaplástico.
Las células tumorales son positivas para tiroglobulina en inmunocitoquímica, confirmando su origen tiroideo.
60x
Intermedio para malignidad, neoplasma de células de Hürthle
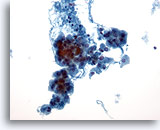
Figura 25
Neoplasia de células de Hürthle.
Las neoplasias de células de Hürthle se caracterizan en citología por presentar una muestra celular con numerosos grupos descohesionados de células de Hürthle y células de Hürthle aisladas a bajo aumento. 20x
Figura 25
Neoplasia de células de Hürthle.
Las neoplasias de células de Hürthle se caracterizan en citología por presentar una muestra celular con numerosos grupos descohesionados de células de Hürthle y células de Hürthle aisladas a bajo aumento.
20x
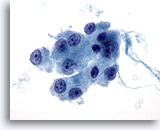
Figura 26
Neoplasia de células de Hürthle.
En la imagen a mayor aumento, las células de Hürthle se caracterizan por presentar un citoplasma granular moderado a abundante y nucleolos centrales prominentes. 60x
Figura 26
Neoplasia de células de Hürthle.
En la imagen a mayor aumento, las células de Hürthle se caracterizan por presentar un citoplasma granular moderado a abundante y nucleolos centrales prominentes.
60x
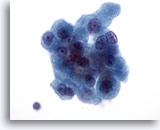
Figura 27
Neoplasia de células de Hürthle.
La binucleación, como la observada en la esquina superior derecha y en la esquina inferior izquierda de este grupo de células, es otra de las características de las células de Hürthle. 60x
Figura 27
Neoplasia de células de Hürthle.
La binucleación, como la observada en la esquina superior derecha y en la esquina inferior izquierda de este grupo de células, es otra de las características de las células de Hürthle.
60x
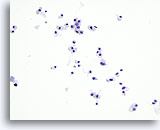
Figura 28
Neoplasia de células de Hürthle.
Al igual que en el carcinoma medular, la neoplasia de células de Hürthle también presenta en PAAF numerosos grupos de células tumorales y células tumorales aisladas. El citoplasma de la neoplasia de células de Hürthle es más abundante que el del carcinoma medular. 20x
Figura 28
Neoplasia de células de Hürthle.
Al igual que en el carcinoma medular, la neoplasia de células de Hürthle también presenta en PAAF numerosos grupos de células tumorales y células tumorales aisladas. El citoplasma de la neoplasia de células de Hürthle es más abundante que el del carcinoma medular.
20x
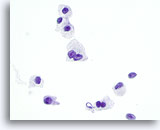
Figura 29
Neoplasia de células de Hürthle.
La frecuente binucleación, como la observada en esta figura, es otra de las características del neoplasia de células de Hürthle que es compartida por el carcinoma medular. 60x
Figura 29
Neoplasia de células de Hürthle.
La frecuente binucleación, como la observada en esta figura, es otra de las características del neoplasia de células de Hürthle que es compartida por el carcinoma medular.
60x
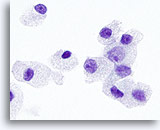
Figura 30
Neoplasia de células de Hürthle.
En la imagen a mayor aumento, los gránulos citoplasmáticos y los nucleolos tienen un tamaño mayor y son más prominentes en los neoplasia de células de Hürthle que en los carcinomas medulares. 100x
Figura 30
Neoplasia de células de Hürthle.
En la imagen a mayor aumento, los gránulos citoplasmáticos y los nucleolos tienen un tamaño mayor y son más prominentes en los neoplasia de células de Hürthle que en los carcinomas medulares.
100x
Indeterminado para malignidad, neoplasma microfolicular con características de células de Hürthle
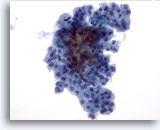
Figura 31
Neoplasma microfolicular con cambio en las células de Hürthle.
En la muestra se observan grupos aglomerados de células foliculares sin coloide en el fondo. 40x
Figura 31
Neoplasma microfolicular con cambio en las células de Hürthle.
En la muestra se observan grupos aglomerados de células foliculares sin coloide en el fondo.
40x
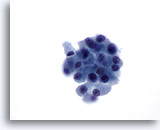
Figura 32
Neoplasma microfolicular con cambio en las células de Hürthle.
En una imagen a mayor aumento, las células foliculares aparecen algo descohesionadas con una escasa cantidad de citoplasma granular. Sin embargo, no todas las células presentan grandes nucleolos prominentes. 60x
Figura 32
Neoplasma microfolicular con cambio en las células de Hürthle.
En una imagen a mayor aumento, las células foliculares aparecen algo descohesionadas con una escasa cantidad de citoplasma granular. Sin embargo, no todas las células presentan grandes nucleolos prominentes.
60x
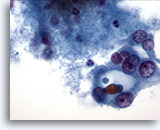
Figura 33
Neoplasma microfolicular con cambio en las células de Hürthle.
Las células de Hürthle de la parte derecha de esta figura están formando, aparentemente, un microfolículo. 60x
Figura 33
Neoplasma microfolicular con cambio en las células de Hürthle.
Las células de Hürthle de la parte derecha de esta figura están formando, aparentemente, un microfolículo.
60x
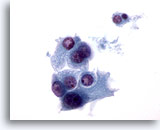
Figura 34
En otra parte de la misma muestra que en la Figura 33, la naturaleza descohesionada de estas células de Hürthle es más evidente. 60x
Figura 34
Neoplasma microfolicular con cambio en las células de Hürthle.
En otra parte de la misma muestra que en la Figura 33, la naturaleza descohesionada de estas células de Hürthle es más evidente.
60x
Intermedio para malignidad, neoplasma microfolicular
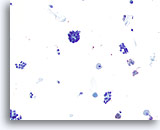
Figura 35
Neoplasia microfolicular.
En esta imagen obtenida a un aumento relativamente bajo se observan grupos/microfolículos aglomerados con algunos macrófagos en el fondo. 20x
Figura 35
Neoplasia microfolicular.
En esta imagen obtenida a un aumento relativamente bajo se observan grupos/microfolículos aglomerados con algunos macrófagos en el fondo.
20x
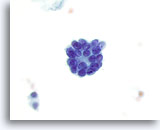
Figura 36
Neoplasia microfolicular.
A mayor aumento se observa un microfolículo. 60x
Figura 36
Neoplasia microfolicular.
A mayor aumento se observa un microfolículo.
60x
Muy probablemente benigno, consistente con una lesión micro- y macrofolicular mezclada
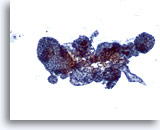
Figura 37
Lesión macrofolicular.
Se observa la presencia de varios folículos de tamaño variable. 10x
Figura 37
Lesión macrofolicular.
Se observa la presencia de varios folículos de tamaño variable.
10x
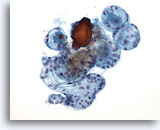
Figura 38
Lesión macrofolicular.
En una imagen a mayor aumento de la Figura 37 se observan más folículos intactos de tamaño variable.20x
Figura 38
Lesión macrofolicular.
En una imagen a mayor aumento de la Figura 37 se observan más folículos intactos de tamaño variable.
20x
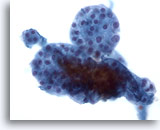
Figura 39
Lesión macrofolicular.
Una magnificación todavía mayor muestra un grupo de pequeños folículos. 40x
Figura 39
Lesión macrofolicular.
Una magnificación todavía mayor muestra un grupo de pequeños folículos.
40x
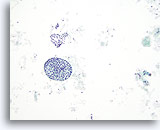
Figura 40
Lesión macrofolicular.
En esta figura se observan un macrofolículo y una capa de células foliculares. Ya sea en folículos o en capas, los macrofolículos se caracterizan por ser células foliculares ampliamente espaciadas. 10x
Figura 40
Lesión macrofolicular.
En esta figura se observan un macrofolículo y una capa de células foliculares. Ya sea en folículos o en capas, los macrofolículos se caracterizan por ser células foliculares ampliamente espaciadas.
10x
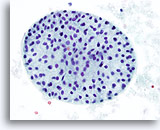
Figura 41
Lesión macrofolicular.
Una imagen a gran aumento del macrofolículo de la Figura 40. 40x
Figura 41
Lesión macrofolicular.
Una imagen a gran aumento del macrofolículo de la Figura 40.
40x

Figura 42
Lesión macrofolicular.
Los macrofolículos se presentan más frecuentemente en capas de células foliculares como las observadas en esta figura. 20x
Figura 42
Lesión macrofolicular.
Los macrofolículos se presentan más frecuentemente en capas de células foliculares como las observadas en esta figura.
20x
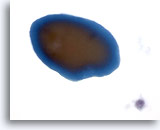
Figura 43
Lesión macrofolicular.
El coloide aparece, normalmente, como un fragmento de material amorfo homogéneo con un borde anguloso y dos tonos de color en ThinPrep. 60x
Figura 43
Lesión macrofolicular.
El coloide aparece, normalmente, como un fragmento de material amorfo homogéneo con un borde anguloso y dos tonos de color en ThinPrep.
60x
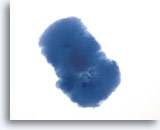
Figura 44
Lesión macrofolicular.
En ThinPrep, el coloide también puede presentar una textura ligeramente irregular. 60x
Figura 44
Lesión macrofolicular.
En ThinPrep, el coloide también puede presentar una textura ligeramente irregular.
60x
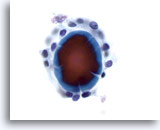
Figura 45
Lesión macrofolicular.
El fragmento de coloide en el centro de un folículo muestra artefactos de agrietamiento. 60x
Figura 45
Lesión macrofolicular.
El fragmento de coloide en el centro de un folículo muestra artefactos de agrietamiento.
60x
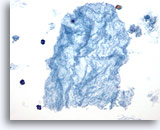
Figura 46
Lesión macrofolicular.
Este material con textura de «papel de seda» se mostró fuertemente asociado a la cantidad de coloide de la muestra de tiroidectomía y probablemente representa un coloide acuoso. 40x
Figura 46
Lesión macrofolicular.
Este material con textura de «papel de seda» se mostró fuertemente asociado a la cantidad de coloide de la muestra de tiroidectomía y probablemente representa un coloide acuoso.
40x
Negativo para células malignas, consistente con tiroiditis de Hashimoto

Figura 47
Tiroiditis de Hashimoto.
En esta figura se observan numerosas células mononucleares con escaso citoplasma y un folículo linfoide. 20x
Figura 47
Tiroiditis de Hashimoto.
En esta figura se observan numerosas células mononucleares con escaso citoplasma y un folículo linfoide.
20x
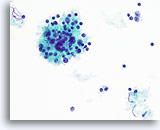
Figura 48
Tiroiditis de Hashimoto.
Una imagen a mayor aumento muestra las células mononucleares y el folículo linfoide con células linfoides en diversos estadíos de maduración. 40x
Figura 48
Tiroiditis de Hashimoto.
Una imagen a mayor aumento muestra las células mononucleares y el folículo linfoide con células linfoides en diversos estadíos de maduración.
40x
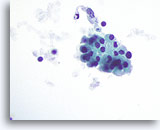
Figura 49
Tiroiditis de Hashimoto.
En otra parte de la muestra se observa un grupo cohesionado de células de Hürthle con citoplasma granular. 60x
Figura 49
Tiroiditis de Hashimoto.
En otra parte de la muestra se observa un grupo cohesionado de células de Hürthle con citoplasma granular.
60x
Volver arriba
Volver a la Tabla de Contenidos

















































