Atlas GINE Sección Uno
AGRADECIMIENTOS
Suzanne M. Werneke, BA, CT(ASCP)
Quisiera agradecer a Kurt Douglass, CT(ASCP) sus esfuerzos por llevar este proyecto a cabo y por la versión original del Manual de Referencia de Morfología Thinprep, el cual está aún en uso hoy en día. Agradecer también a Mike LeDonne, CT(ASCP) por muchas de sus imágenes digitales utilizadas en este atlas
Me gustaría agradecer personalmente a todos de nuestros editores invitados quienes han trabajado diligentemente para llegar a las fechas limite de entrega. Hemos aprendido mucho de cada uno de estos patólogos y citotécnicos y apreciamos en gran medida su entusiasmo y admiramos su pasión por el campo de la citología
Finalmente, muchas gracias a Charlotte L. Brahm, CT(ASCP), Managing Editor, cuyo nombre no aparece en ningún otro lugar en este atlas, pero quién ha trabajado incansablemente para que esto diera su fruto
Contribuciones:
Raheela Ashfaq, MD
Profesor, Departamento de Patología, Universidad de Texas Southwestern Medical Center, y Director del Laboratorio de Citopatología y Oncodiagnóstico , Parkland Health and Hospital, Dallas, TX
R. Marshall Austin, MD, PhD
Director Médico y Director de los Servicios de Citopatología y Patología Ginecológica, Coastal Pathology Associates, Charleston, SC
John M. Bauer, MD
Director Médico , Piedmont Pathology, Incorporated, Hickory, NC
Diane D. Davey, MD
Profesor de Patología y Medicina Laboratoria, Director del Servicio de Citopatología y Médula Osea, Director del Programa de la Comunidad de Citopatología University of Kentucky, Lexington, KY
Luis A. Diaz-Rosario, MD
Director Médico , Anatomía Patológica , Quest Diagnostics, Incorporated, Tampa, FL
Martha L. Hutchinson, MD, PhD
Profesora Asociada de Patología, Brown University, Providence, RI
Deanna K. Iverson, MHS, SCT(ASCP), HTL
Jefe de Patología , Palo Alto Medical Foundation, Palo Alto, CA
Joyce E. Johnson, MD
Profesora Asociada, Departmento de Patología, Director Division of Education, Vanderbilt University Medical Center, Nashville, TN
James Linder, MD
Director Médico, Hologic, Inc., Boxborough, MA; Professor, Pathology and Microbiology, University of Nebraska Medical Center, Omaha, NE
Jacalyn L. Papillo, BS, CT(ASCP)
Jefe de Citopatología , Fletcher Allen Healthcare, Burlington, VT
Pamela Smith Piraino, CT(ASCP)
Clear Path Diagnostics, Syracuse, NY
Richard A. Smith, MD, PhD
Jefe de Patología, Sturdy Memorial Hospital, Attleboro, MA
Zahniser, David, PhD
Presidente, Diagnostic Vision Incorporated, Wellesley, MA
INTRODUCCIÓN
Este atlas ha sido diseñado para ayudar a citotecnólogos y patólogos a desarrollar y poner a punto su capacidad a la hora de interpretar la citología ginecológica utilizando el ThinPrep® Pap Test. La precoz investigación y desarrollo del Thin Prep Pap en Hologic Corp. estableció los fundamentos para poder establecer comparaciones con la extensión convencional. Desde ese momento, otros citotecnólogos y patólogos en su práctica clínica en todo el mundo han ayudado a desarrollar este fundamento. Este atlas de referencia está concebido para servir como herramienta educacional y progresiva referencia para usuarios del ThinPrep Pap Test.
La organización del atlas está basada en el Sistema Bethesda como se desarrollo en el National Cancer insitute, y resumido en una publicación por Robert J.Kurman y Diane Solomon, titulado «The Bethesda System for Reporting Cervical/Vaginal Cytologic Diagnoses: Definitions, Criteria and Explanatory Notes for Terminology and Specimen Adequacy (New York: Springer-Verlag, 1994). Editado también en castellano («El Sistema Bethesda para informar la citología cervical: Definiciones, criterios y notas aclaratorias»). Han sido incluidas actualizaciones en la nomenclatura al Bethesda 2001. El libro titulado «The Art and Science of Cytopathology» del Dr. Richard DeMay ha sido también utilizado como referencia para los criterios citológicos relacionados con atipia, displasia y lesiones más severas.
Para cada categoría diagnóstica, las imágenes ilustran la morfología ThinPrep, la correspondiente apariencia en la extensión convencional y las entidades clave de diagnóstico diferencial. Todas las fotografías de este atlas pretenden ilustrar hallazgos típicos en las preparaciones de ThinPrep y pueden estar sujetas a interpretación individual
RESUMEN DEL MÉTODO
DE PREPARACIÓN DEL THINPREP
El sistema ThinPrep® para muestras de Papanicolau esta aprobado por la FDA como alternativa al método convencional para detectar células atípicas, cáncer cervical y sus lesiones precursoras así como otras categorías citológicas según se define en The Bethesda System. El ThinPrep Pap Test ha demostrado ser significativamente más efectivo que la extensión convencional para la detección de Lesiones intraepiteliales escamosas de bajo grado (LSIL) y lesiones más severas en una variedad de poblaciones de pacientes, incluyendo un 59,7% de aumento en la detección de HSIL y lesiones de mayor grado en estudios de HSIL direct-to-vial. La calidad de la muestra es también significativamente mejor sobre las preparaciones de extendidos convencionales
Una recogida y una preparación óptimas son los factores más importantes para la mejora en la precisión del Pap test. Las diferencias en los procedimientos utilizados para preparar las extensiones convencionales y las muestras en Thinprep Pap Test se traduce en diferencias en la apariencia microscópica entre las extensiones convencionales y las muestras en ThinPrep. Una correcta interpretación de los portas ThinPrep es necesaria una adecuada comprensión del método de preparación del ThinPrep. Esto es especialmente importante en lo que respecta a las cualidades de la muestra que determina la preservación y presentación de la muestra. Por esta razón, se resume a continuación el método de preparación ThinPrep
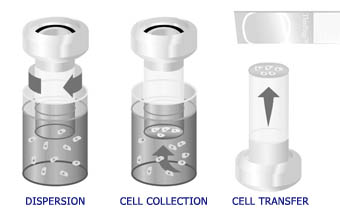
El proceso automatizado en el procesador ThinPrep incluye dispersión de la muestra, filtración de precisión para recoger las células en una membrana y transferirlas a un portaobjetos
EL PROCESADOR THINPREP:
PRINCIPIOS DE OPERACIÓN
El proceso del ThinPrep empieza con la muestra ginecológica del paciente siendo recogida por el clínico utilizando tanto un dispositivo tipo cepillo o una combinación cepillo/espátula de plástico. El dispositivo se enjuaga entonces en un vial con solución PreservCyt®. El vial con la muestra de Thinprep se tapa, se etiqueta y se envía a un laboratorio equipado con el Procesador Thinprep
En el laboratorio, al vial con la muestra se le da entrada con el correspondiente formulario para citología y se le asigna un numero de citología al formulario, al vial y al portaobjeto de ThinPrep. El vial y su porta correspondiente se sitúan en el Procesador ThinPrep junto con el cilindro con el filtro ginecológico (filtro claro), y el operador selecciona la secuencia apropiada. El instrumento homogeniza la muestra haciendo rotar bien el filtro (T2000), bien el vial (T3000) creando corrientes en el líquido lo suficientemente fuerte como para dispersar aleatoriamente el material, deshacer la sangre, el moco y los restos celulares no diagnósticos mientras mantiene los grupos de células intactos. Si se enjuaga adecuadamente, todas las células recogidas van al vial en lugar de ser tiradas como cuando se realiza la extensión convencional. Esta característica, junto con la aleatorización de la muestra celular durante la fase de rotación, permite un muestra celular representativa que se transfiere al portaobjetos y un reflejo más exacto del estado del epitelio de la paciente.
Estas células son recogidas en la membrana del Filtro TransCyt aplicando un suave vacío a través de la membrana del filtro para aspirar el líquido a través de la membrana. Como el material el vial con la muestra se recoge en la membrana del filtro, los poros de la membrana se bloquean provocando así que el procesador deje de aspirar. El índice de flujo a través del filtro Transcyt se monitoriza constantemente para minimizar la variabilidad de las muestras.
Cuando el procesador para el paso de filtración, el cilindro del filtro es retira del vial con la muestra y rota parcialmente para evacuar el filtrado dentro de la botella de depósito de residuos. El cilindro del filtro entonces gira hacia arriba hacia donde está el portaobjetos. Una ligera presión de aire se aplica al filtro para ayudar a la transferencia de las células del filtro al cristal. Debido a las propiedades naturales de adhesión de las células y las propiedades naturales electroquímicas de los portaobjetos ThinPrep, las células tienen una mayor afinidad por el cristal del portaobjetos que por la membrana del filtro y una fina capa de células se transfiere al portaobjetos en un círculo de 20 mm de diámetro. Una vez completada la transferencia celular, el portaobjetos sale del contacto con el filtro y se deposita automáticamente en un baño de fijación. Este se saca por el operador y se coloca en un rack de tinción (T2000) para la subsiguiente tinción de Papanicolaou y montaje de rutina. Con el procesador T3000, el portaobjetos se fija por el instrumento con una capa de solución fijadora y se coloca en un rack de tinción para la tinción y colocación del cubreobjetos.
REFERENCIAS:
- Hutchinson ML, et al: Homogeneous sampling accounts for the increased diagnostic accuracy using the ThinPrep® Processor. Am J of Clin Pathol 1994; 101:215-219.
- ThinPrep® 2000 System Package Insert, Hologic, Inc., 2001.
- TP® 2000 Operator’s Manual, Rev G, Hologic, Inc., 2000.
- TP® 3000 Operator’s Manual, Rev C, Hologic, Inc., 2000-2001.
FUNDAMENTOS CIENTÍFICOS
David Zahniser, PhD
La presencia de falsos negativos en la extensión de Papanicolaou es uno de los principales problemas de calidad a los que se debe enfrentar el laboratorio de citología. El fracaso al detectar enfermedad cervical en las mujeres está estrechamente ligado a errores en la toma de muestra o a errores en el screening. Los errores de toma de muestra justifican la mayoría de los falsos negativos, comprendiendo entre un 60-80%. Errores de screening o interpretación son los justifican los errores restantes. Históricamente, los errores de toma de muestra se atribuían a que el clínico no tomaba correctamente una muestra de la lesión a la hora de recoger las células. Se pensaba que la lesión podía ser demasiado pequeña, o podía estar más arriba en el canal endocervical. Hoy en día es evidente que los errores de toma de muestra juegan un papel muy importante a la hora de limitar la sensitividad del Papanicolaou. El reciente trabajo en el desarrollo del sistema ThinPrep 2000 ayudó a dejar al descubierto las dificultades inherentes en la preparación de la extensión convencional y a definir más los errores de toma de muestra. Los estudios demuestran ahora que los errores de toma de muestra no son necesariamente dependientes del médico, pero están más específicamente asociados con las limitaciones de la técnica manual de extendido.
Los orígenes de la tecnología ThinPrep datan de la unión de varios esfuerzos de investigación encaminados a desarrollar un sistema cuantitativo para analizar la extensión de Papanicolaou. Durante los años 60, los ordenadores digitales hicieron posible construir sistemas de escaneado. Desde el principio, los sistemas computerizados de imagen estuvieron limitados por las preparaciones manuales no homogéneas. Era evidente que las extensiones cervicales tradicionales eran demasiado complicadas para el análisis por un sistema automatizado. Más investigación llevó a desarrollar dispositivos de preparación que facilitaran el análisis automático. La primera generación de sistemas de preparación automatizados estaban siendo diseñados para lograr una población de células sueltas sin grupos, para que fuesen adecuados para el análisis por los ordenadores primitivos. Para disgregar esas placas y grupos de células, se probaron varios medios mecánicos. Los raspados cervicales recogidos en una solución estuvieron sujetos a una vigorosa acción mecánica. Los instrumentos de preparación con más éxito fueron los que utilizaron una acción de inyección, empujando la muestra celular a través de una aguja de jeringa de gran calibre, para lograr una población de células sueltas. Esos instrumentos fueron exitosos al presentar al ordenador preparaciones celulares simplificadas. Desafortunadamente, el éxito de la mono-dispersión estaba acompañado por perdida de células y de la arquitectura del tejido siendo destruidas en el proceso, comprometiendo la interpretación humana. Trabajos en Holanda orientaron sobre los problemas relacionados con la inyección. Para mejorar el paso de la dispersión introdujeron el uso de un cilindro rotando a altas velocidades entre las célula en suspensión. La hipótesis era que como el cilindro está rotando en el vial se alcanzan fuerzas cortantes, similares a la acción de inyección. Controlando la velocidad de la dispersión del cilindro se puede manipular el grado de dispersión . Los procesadores ThinPrep corrientes incorporan la técnica de dispersión del cilindro utilizando mucha menor velocidad de dispersión para preservar la integridad de las uniones celulares naturales. Además, se han realizado modificaciones en la solución de recogida para optimizar más la preparación de la muestra.
El método de filtración estaba también bajo desarrollo en conjunción con el paso de dispersión. La calidad de la muestra se podría mejorar más limitando los elementos no diagnósticos del fondo. Se tuvo cuidado de que no se perdiera información originariamente presente en la muestra. Se eligió un filtro de membrana de plástico para concentrar el material celular del líquido en suspensión y limitar así los artefactos por simple filtración. El proceso utilizado para producir esos filtros resultó en una distribución aleatoria de poros de tamaño uniforme.
El dispositivo de preparación requería un paso adicional para depositar las células en suspensión en un portaobjetos. Se estudiaron numerosas técnicas para optimizar la transferencia de células al cristal para que fueran adecuadas tanto para el análisis humano como por ordenador. El uso de la membrana del filtro permitía la transferencia de células al cristal prensando el filtro contra el cristal, dando como resultado una fina y uniforme capa de células con distribución homogénea y morfología celular familiar.
El renovado interés por la automatización de la extensión de Papanicolaou se ha generado por una falta citotécnicos y un aumento en los pleitos por problemas en las extensiones de Papanicolaou. Hoy numerosos instrumentos de screening automático están disponibles comercialmente en el mercado. Sin embargo, incluso aunque la tecnología informática ha avanzado, la necesidad de preparar portaobjetos adecuados continua. La tecnología ThinPrep adquiere importancia al intentar resolver las limitaciones en la preparación de los portas y los estudios clínicos y no clínicos sostienen que la tecnología ThinPrep ha ayudado a un mejor entendimiento de las limitaciones del test de Papanicolaou
REFERENCIAS:
- Linder J and Zahniser: ThinPrep Papanicolaou testing to reduce false-negative cervical
- Arch Pathol Lab Med; 1998; 122:139-144.
EVALUACIÓN MICROSCÓPICA DE LAS PREPARACIONES THINPREP®
Deanna K. Iverson, MHS, SCT(ASCP), HTL
George Papanicolaou desarrolló los criterios morfológicos del test que lleva su nombre a principios de 1920. Desde entonces, se han hecho muchas modificaciones basadas en numerosos estudios y están bien documentadas. Se observan pequeños cambios en los criterios morfológicos básicos entre el método de extensión tradicional y el ThinPrep Pap Test. Las únicas diferencias microscópicas están asociadas generalmente con el método de recogida líquida utilizado con el Sistema ThinPrep®. Es importante observar que la arquitectura del tejido no se altera durante el procesamiento del instrumento y para la interpretación se utiliza la morfología celular clásica. Las similitudes entre la morfología ThinPrep y la convencional pesan mucho más que las diferencias y la experiencia con la morfología convencional hace que se cambie rápido. Lo que sigue es un resumen de las características morfológicas clave del ThinPrep y como hacer el screening para detectar mejor las anomalías
Como en la extensión convencional el screening de una preparación de ThinPrep Pap Test (TPPT) debe realizarse siguiendo un patrón lento, sistemático y solapando campos microscópicos. El borde circular del depósito de células en el cristal de ThinPrep se puede utilizar como punto de referencia. Antes de la evaluación sistemática del cristal a bajo aumento (10x), puede ser útil realizar una revisión rápida del porta con el objetivo de escaneado (4x), para evaluar la composición celular, identificar el componente endocervical y asegurar la calidad técnica de la preparación
Los citotécnicos experimentados y los patólogos pueden identificar rápidamente loas diferentes tipos de células en las preparaciones de ThinPrep. El citólogo aún encontrará casos biológicamente complejos y necesitarán de un examen minucioso. Se puede realizar la valoración cuantitativa de la celularidad (poblaciones normales o anómalas) y es similar a los métodos convencionales. Sin embargo, con las preparaciones ThinPrep, la cantidad de células anómalas es menos importante que su presencia o ausencia definitiva.
Las únicas características de los portas ThinPrep Pap Test incluyen uniformidad de la preparación celular, fijación húmeda, tamaño celular, patrón de extendido y fondo de la muestra
Uniformidad de las preparaciones celulares:
- concentradas
- uniformemente distribuidas
- área circular de 20 mm
Debido a que el material celular ha sido recogido en una solución y posteriormente filtrado, la presentación de la muestra en los portas ThinPrep aparece de manera algo diferente que las extensiones convencionales. La extensión convencional áreas gruesas y áreas finas, artefactos de secado al aire, y a menudo hay distorsión mecánica del material celular. El material celular en las preparaciones ThinPrep está concentrado y distribuido uniformemente en un área circular de 20 mm. Las placas de epitelio aún se pueden observar pero hay menos solapamiento de células.
Fijación húmeda:
- Células redondeada en solución
- Detalle citoplasmático aumentado
- Solución de recogida con base de metanol
- Detalle nuclear aumentado
- Variabilidad en cromasia
La fijación húmeda: Lo que hace que los portas ThinPrep sean únicos es que el material celular se recoge y se coloca en una solución fijadora de base líquida. La morfología celular en las preparaciones ThinPrep es similar a las muestras no ginecológicas en las que las células tienden a redondearse cuando están en solución, sin embargo, los diferentes tipos de células son todavía fácilmente distinguibles en las preparaciones ThinPrep. Las células Endocervicales pueden aparecer más tridimensionales y pueden confundirse con células endometriales. La configuración en empalizada de las células endocervicales pueden verse a menudo en la periferia de los grupos celulares al examinarlos a más aumento (40X)
La solución fijadora de base líquida del ThinPrep Pap Test contiene metanol, el cual aumenta la preservación de la célula y la morfología nuclear. El aumento de los detalles citoplasmáticos resulta en una mejor capacidad para determinar el linaje de las células y su estado de maduración.. El aumento en la morfología nuclear es principalmente el resultado de la fijación húmeda. Los núcleos se pueden sobre interpretar y se debe tener precaución para evitar una sobre interpretación de los núcleos bien preservados al evaluar las preparaciones de ThinPrep. El aumento nuclear observado en las preparaciones ThinPrep es similar al que observamos en la extensión convencional cuando ha sido fijada con etanol al 95%.
La hipercromasia nuclear típicamente asociada a lesiones escamosas en la extensión convencional se puede reducir en los portas ThinPrep. Por esta razón, la hipercromasia no es un indicador fiable en las preparaciones de ThinPrep. Si se presenta hipercromasia se debe considerar, pero la ausencia de hipercromasia no debe ser utilizada para descartar atipias nucleares. En ausencia de hipercromasia, la interpretación precisa de lesiones de alto grado puede ser especialmente difícil en los portas ThinPrep, pero dependerá más de las variaciones en el tamaño y forma nuclear; criterios morfológicos que son a menudo pasados por alto o inapreciados en la extensión convencional.
Tamaño Celular:
- Proporcionalmente más pequeñas
- Células aisladas más destacadas
Tamaño celular: Debido a la fijación húmeda, las células en preparaciones ThinPrep pueden aparecer proporcionalmente más pequeñas. Una célula intermedia bien conservada es una referencia útil para determinar el tamaño celular y el tamaño nuclear. Es particularmente importante al evaluar e interpretar células pequeñas de tipo metaplásico inmaduras. Es importante examinar estas células a mayor aumento para evaluar cuidadosamente el núcleo para observar si hay una atipia nuclear, especialmente en ausencia de hipercromasia
Las células sueltas están dispersas y pueden aparecer como parte de un «submuestra aleatoria», característica del Sistema ThinPrep. Ya que la sangre y la inflamación no cubren esas células parece que hay mas células aisladas en la preparación que en la extensión convencional
Patrón de extendido:
- Se elimina el patrón de «extendido»
- Se altera el patrón del fondo
Patrón de extendido: En general, la arquitectura celular y el fondo contextual en las preparaciones ThinPrep es similar a la que observamos en las extensiones convencionales bien preservadas. El material celular en los portas ThinPrep es uniforme y distribuido homogéneamente. La arquitectura del tejido se mantiene (placas y sincitios) y la distorsión mecánica se reduce significativamente
Fondo: Al contrario que las extensiones convencionales, el fondo de las preparaciones ThinPrep es generalmente limpio. Debido a que el fondo en estas preparaciones es tan limpio, es más fácil identificar las poblaciones celulares normales y las atípicas. La presencia de sangre, moco, inflamación, y diátesis aparece en el cristal de ThinPrep pero estas entidades aparecen ligeramente diferentes a cuando las observamos en el Papanicolaou convencional, debido a la diferencia en la recogida y preparación de la muestra. La presencia de sangre e inflamación en los portas ThinPrep raramente enmascara a menos que sea el producto predominante de la toma a la paciente por parte del clínico en la visita ginecológica. La sangre fresca se lisa por el agente hemolítico que hay en el medio líquido, provocando que los hematíes aparezcan incoloros (hematíes fantasma). La sangre vieja no se lisa completamente y muestra tinción roja variable. La capacidad para diferenciar la sangre fresca de la vieja puede ser útil a la hora de considerar un proceso maligno.
El material inflamatorio está disperso más homogéneamente en las preparaciones ThinPrep y puede a menudo verse enganchado a células epiteliales. Ocasionalmente el fondo puede tener una apariencia de «enfadado». El material en el portaobjetos aparece sucio y deshecho y hay pocas células escamosas bien conservadas. Cuando se observa este tipo de fondo es importante considerar lo siguiente: la presencia de un agente infeccioso, histolisis, y/o lesión maligna (diátesis tumoral). La diátesis tumoral, si aparece, (células inflamatorias, hematíes, fibrina, restos celulares necróticos y material granular proteináceo) se puede observar en las preparaciones ThinPrep por todo el fondo de la preparación, rodeando o cubriendo las células epiteliales (diátesis «pegajosa»)
