Atlante Ginecologico Sezione 1
RINGRAZIAMENTI
Suzanne M. Werneke, medico chirurgo, citotecnologo (ASCP)
Voglio ringraziare Kurt Douglass, citotecnologo (ASCP), per gli sforzi profusi per il completamento di questo progetto e per la versione originale del Manuale di riferimento morfologico ThinPrep, che viene utilizzato ancora oggi. Un sentito ringraziamento anche a Mike LeDonne, citotecnologo (ASCP), per le immagini digitali che ha messo a disposizione per l’Atlante.
Voglio ringraziare personalmente tutti i guest editor che hanno collaborato in modo assiduo per consentire il rispetto delle scadenze. Tutti i patologi e i citologi sono stati una preziosa fonte di informazioni e un continuo stimolo grazie al loro entusiasmo e alla loro passione per la citologia.
Infine, voglio ringraziare in modo particolare Charlotte L. Brahm, citotecnologo (ASCP), direttore editoriale, il cui nome non viene mai citato nell’Atlante, ma che ha lavorato instancabilmente per consentirne la realizzazione.
Collaboratori:
Raheela Ashfaq, medico
Professore presso il dipartimento di patologia, University of Texas Southwestern Medical Center e direttore del laboratorio di citopatologia e diagnostica oncologica, Parkland Health and Hospital, Dallas, Texas
R. Marshall Austin, medico
Direttore medico e direttore dei servizi di citopatologia e patologia ginecologica, Coastal Pathology Associates, Charleston, South Carolina
John M. Bauer, medico
Direttore medico, Piedmont Pathology Incorporated, Hickory, North Carolina
Diane D. Davey, medico
Professore di patologia e medicina di laboratorio, direttore del servizio di citopatologia e midollo osseo, direttore del Cytopathology Fellowship Program, University of Kentucky, Lexington, Kentucky
Luis A. Diaz-Rosario, medico
Direttore medico, patologia anatomica, Quest Diagnostics Incorporated, Tampa, Florida
Martha L. Hutchinson, medico
Professore associato di patologia, Brown University, Providence, Rhode Island
Deanna K. Iverson, master in Health Science, citologia (ASCP), istotecnologo
Responsabile di patologia, Palo Alto Medical Foundation, Palo Alto, California
Joyce E. Johnson, medico
Professore associato presso il dipartimento di patologia, direttore del settore formativo, Vanderbilt University Medical Center, Nashville, Tennessee
James Linder, medico
Dirigente medico, Hologic, Inc., Boxborough, Massachusetts; Professore di patologia e microbiologia, University of Nebraska Medical Center, Omaha, Nebraska
Jacalyn L. Papillo, medico chirurgo, citotecnologo (ASCP)
Responsabile di citopatologia, Fletcher Allen Healthcare, Burlington, Vermont
Pamela Smith Piraino, citotecnologo (ASCP)
Clear Path Diagnostics, Syracuse, New York
Richard A. Smith, medico
Responsabile di patologia, Sturdy Memorial Hospital, Attleboro, Massachusetts
Zahniser, David, medico
Presidente di Diagnostic Vision Incorporated, Wellesley, Massachusetts
INTRODUZIONE
Questo Atlante è stato ideato per aiutare i citologi e i patologi nello sviluppo e nella messa a punto della loro capacità di interpretazione della citologia ginecologica con l’utilizzo del ThinPrep® Pap Test. Le prime ricerche e gli sviluppi del ThinPrep Pap Test presso Hologic, Inc. hanno costituito i fondamenti per i confronti effettuati con lo striscio tradizionale. Da allora, altri citologi e patologi professionisti di vari paesi del mondo hanno contribuito ad arricchire tali fondamenti. Questo Atlante di riferimento è stato concepito con funzioni didattiche e di riferimento continuo per tutti gli utilizzatori del ThinPrep Pap Test.
L’organizzazione dell’Atlante si basa sul Bethesda System come è stato sviluppato presso il National Cancer Institute e riassunto in una pubblicazione di Robert J. Kurman e Diane Solomon intitolata The Bethesda System for Reporting Cervical/Vaginal Cytologic Diagnoses: Definitions, Criteria and Explanatory Notes for Terminology and Specimen Adequacy (New York: Springer-Verlag, 1994). Sono stati inclusi aggiornamenti per garantire la presenza della nomenclatura del Bethesda 2001. Per quanto riguarda i criteri attinenti ad atipia, displasia e lesioni più gravi, è stato utilizzato come riferimento il testo intitolato The Art and Science of Cytopathology del dott. Richard DeMay.
Per tutte le categorie diagnostiche, le immagini mostrano la morfologia del ThinPrep Pap Test (TPPT), il corrispondente aspetto dello striscio tradizionale e i principali elementi identici. Tutte le fotografie dell’Atlante rappresentano diapositive ThinPrep, salvo diversamente specificato. Le fotografie sono state inserite per riprodurre risultati rappresentativi delle preparazioni dei campioni ThinPrep e possono essere interpretate in modo personale dai diversi utenti.
PANORAMICA SUL
METODO DI PREPARAZIONE THINPREP
Il sistema ThinPrep®per i campioni destinati al Pap test è stato approvato dalla Food and Drug Administration in quanto strumento sostitutivo rispetto al tradizionale metodo di rilevamento di cellule atipiche, cancro della cervice e lesioni precorritrici e di altre categorie citologiche definite dal Bethesda System. È stato dimostrato che il ThinPrep Pap Test è estremamente più efficace rispetto allo striscio tradizionale nel rilevare lesioni intraepiteliali squamose di basso grado (LSIL) e altre lesioni più gravi in una vasta gamma di popolazioni di pazienti. Ha inoltre permesso di rilevare fino al 59,7% in più di HSIL e di lesioni di grado più alto in uno studio HSIL direct-to-vial. Anche la qualità dei campioni è notevolmente migliorata rispetto a quella della preparazione dello striscio tradizionale.
Una raccolta e una preparazione ottimale del campione sono i fattori più importanti per il miglioramento della precisione del Pap test. Le differenze nella procedura utilizzata per la preparazione dei campioni degli strisci tradizionali e del ThinPrep Pap Test si tramutano in differenze nell’aspetto dei due campioni studiati al microscopio. Per interpretare correttamente i vetrini del ThinPrep Pap Test è necessaria un’adeguata comprensione del metodo di preparazione ThinPrep, in particolare per quanto riguarda la qualità del prelievo che determina la conservazione e la presentazione del campione. Per questo motivo, di seguito viene riportato un riepilogo del metodo di preparazione ThinPrep.
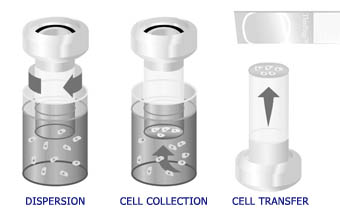
Il processo automatico del processore ThinPrep comprende la dispersione del campione, la filtrazione di precisione per la raccolta delle cellule in una membrana e il trasferimento in un vetrino per microscopio.
Processore ThinPrep:
principi operativi
Il processo ThinPrep ha inizio con l’esecuzione del prelievo ginecologico sulla paziente da parte del personale sanitario mediante un dispositivo simile a una spazzola o una combinazione di spazzolino e spatola di plastica. Il dispositivo viene risciacquato nella fiala del campione contenente soluzione PreservCyt®. La fiala del campione ThinPrep viene quindi chiusa, etichettata e inviata a un laboratorio dotato di un processore ThinPrep.
Al laboratorio, la fiala del campione viene associata al modulo di richiesta esame citologico corrispondente, dopodiché al modulo, alla fiala e al vetrino per l’esame ThinPrep al microscopio viene assegnato un numero citologico. La fiala e il relativo vetrino vengono posizionati nel processore ThinPrep insieme al cilindro del filtro ginecologico monouso (filtro trasparente) e l’operatore seleziona la sequenza di vetrini appropriata. Lo strumento omogeneizza il campione ruotando il filtro (T2000) o la fiala (T3000) e creando nel fluido forze di taglio sufficientemente potenti per separare materiale aggregato casualmente, sangue lisato, muco e frammenti non diagnostici, pur mantenendo intatti gli aggregati veri di cellule. Se il risciacquo avviene correttamente, tutte le cellule raccolte finiscono nella soluzione invece di rimanere sul dispositivo e venire scartate dopo l’esecuzione di uno striscio tradizionale. Questa caratteristica, unitamente alla distribuzione casuale del campione di cellule durante la fase di rotazione, consente di trasferire sul vetrino un campione cellulare rappresentativo e di ottenere una visione più precisa dello stato dell’epitelio della paziente.
Le cellule vengono quindi raccolte in una membrana del filtro TransCyt applicando un leggero vuoto attraverso la membrana del filtro per consentire l’aspirazione del fluido attraverso la membrana. Quando il materiale della fiala del campione si raccoglie sulla membrana del filtro, i pori della membrana si bloccano e il processo di aspirazione del processore si interrompe. La quantità di fluido che attraversa il filtro TransCyt viene costantemente monitorata per ridurre al minimo la variabilità dei campioni.
Al termine del processo di filtraggio, il cilindro del filtro viene estratto dalla fiala del campione e ruotato parzialmente affinché scarichi la sostanza filtrata nel flacone dei rifiuti. Il cilindro viene quindi ruotato in alto sul vetrino. Sul filtro viene esercitata una leggera pressione con aria per facilitare il trasferimento delle cellule sul vetrino. A causa delle proprietà naturali di aderenza delle cellule e delle proprietà elettrochimiche naturali dei vetrini ThinPrep, le cellule dimostrano una maggiore affinità con il vetrino che con la membrana del filtro e, di conseguenza, un sottile strato di cellule viene trasferito sul vetrino in un’area circolare di 20 mm di diametro. Completato il trasferimento delle cellule, il vetrino viene rimosso dal cilindro del filtro e inserito automaticamente in un bagno di fissaggio. Viene quindi rimosso dall’operatore e posizionato su un rack per colorazione (T2000) per eseguire la colorazione e il montaggio del vetrino secondo metodo Pap di routine. Con il processore T3000, il vetrino viene fissato dallo strumento con il vapore della soluzione fissante e posizionato su un rack per colorazione per eseguire la colorazione e il montaggio del vetrino secondo metodo Pap di routine.
BIBLIOGRAFIA DI RIFERIMENTO:
- Hutchinson ML, et al: Homogeneous sampling accounts for the increased diagnostic accuracy using the ThinPrep® Processor. Am J of Clin Pathol 1994; 101:215-219.
- ThinPrep® 2000 System Package Insert, Hologic, Inc., 2001.
- TP® 2000 Operator’s Manual, Rev G, Hologic, Inc., 2000.
- TP® 3000 Operator’s Manual, Rev C, Hologic, Inc., 2000-2001.
FONDAMENTI SCIENTIFICI
David Zahniser, medico
La presenza di falsi negativi durante l’analisi dello striscio è uno dei principali problemi legati alla qualità che un laboratorio citologico si trova ad affrontare. L’impossibilità di rilevare malattie della cervice è strettamente legata a errori di campionamento o di screening. Gli errori di campionamento rappresentano la maggioranza di falsi negativi nello striscio, con una percentuale compresa tra il 60 e l’80%. Gli errori di screening e di interpretazione costituiscono la percentuale restante. In genere, gli errori di campionamento vengono attribuiti al personale sanitario, che non viene ritenuto in grado di prelevare un campione adeguato dalla lesione al momento della raccolta di cellule. La lesione può essere troppo ridotta o può essere posizionata troppo in alto nel canale endocervicale. È ormai evidente che gli errori di campionamento hanno un ruolo fondamentale nel limitare la sensibilità dello striscio. I primi studi per lo sviluppo del sistema ThinPrep®hanno permesso di scoprire le lacune insite nella preparazione dello striscio tradizionale e di definire ulteriormente gli errori di campionamento. Si è ora consapevoli del fatto che tali errori non sono necessariamente da imputare al medico, ma possono essere associati ai limiti della tecnica di striscio manuale.
La nascita della tecnologia ThinPrep risale al periodo in cui i ricercatori erano impegnati nello sviluppo di un sistema quantitativo per l’analisi dello striscio. Negli anni ’60, i computer hanno reso possibile la creazione di sistemi di scansione. Sin dall’inizio, i risultati dei sistemi di rappresentazione delle immagini dei computer sono stati limitati da preparazioni manuali non omogenee. Era evidente che gli strisci della cervice erano troppo complicati per consentire un’analisi con un sistema automatico. Buona parte della ricerca si è concentrata sullo sviluppo di dispositivi di preparazione che facilitassero l’analisi automatica. La prima generazione di sistemi di preparazione automatici è stata progettata per ottenere un’unica popolazione cellulare priva di aggregati che consentisse l’analisi mediante computer rudimentali. Per disaggregare foglietti e aggregati di cellule, sono stati testati vari strumenti meccanici. I raschiamenti raccolti nella soluzione erano sottoposti a una vigorosa azione meccanica. I dispositivi di preparazione più efficaci facevano uso di una siringa e prevedevano l’inserimento del campione di cellule all’interno dell’ago di una siringa con diametro largo per ottenere un’unica popolazione cellulare. Tali dispositivi erano in grado di creare preparazioni cellulari semplificate per l’analisi al computer. Purtroppo, l’efficacia della monodispersione era associata a una perdita dell’architettura delle cellule e dei tessuti, che veniva distrutta durante il processo compromettendo l’interpretazione umana. Studi svolti in Olanda hanno preso in considerazione alcuni dei problemi legati all’utilizzo della siringa. Per migliorare la dispersione, hanno introdotto l’uso di un cilindro rotante ad alta velocità nella sospensione cellulare. Il presupposto era che il cilindro, ruotando nella fiala, generasse forze di taglio simili all’azione della siringa. Attraverso il controllo della velocità del cilindro di dispersione, era possibile determinare il grado di dispersione. I moderni processori ThinPrep utilizzano la tecnica di dispersione dei cilindri servendosi di una velocità di dispersione estremamente più ridotta per preservare l’integrità dei legami naturali delle cellule. Inoltre, sono state apportate modifiche alla soluzione di raccolta per migliorare ulteriormente la preparazione del campione.
Oltre alle innovazioni a livello di dispersione, viene ideato anche un nuovo metodo di filtraggio. Si scopre che è possibile migliorare ulteriormente la qualità del campione limitando gli elementi di sfondo non diagnostici. Naturalmente i ricercatori si assicurano che eventuali informazioni essenziali presenti nel campione non vadano perdute. Viene selezionata una membrana del filtro di plastica che concentra il materiale cellulare dalla sospensione del fluido e limita tali artefatti grazie al semplice filtraggio. Il processo utilizzato per la produzione dei filtri genera una distribuzione casuale dei pori con una dimensione uniforme.
Il dispositivo di preparazione richiede un ulteriore passaggio per depositare le cellule in sospensione su un vetrino per microscopio. Sono state prese in considerazione varie tecniche per l’ottimizzazione del deposito delle cellule sul vetrino, adatte sia per l’analisi umana che per quella computerizzata. L’uso della membrana del filtro consente il trasferimento delle cellule sul vetrino attraverso la pressione del filtro e delle cellule sul vetrino, in modo da costituire uno strato sottile e uniforme di cellule con distribuzione regolare e morfologia cellulare conosciuta.
Il rinnovato interesse per l’automatizzazione dello striscio è stato generato da una carenza di personale sanitario addetto alla citologia e dall’aumento delle controversie relative allo striscio stesso. Oggi il mercato offre numerosi strumenti per lo screening automatico. Tuttavia, anche se la tecnologia informatica ha fatto passi da gigante, l’esigenza di preparazione omogenea dei vetrini permane. La tecnologia ThinPrep cerca di risolvere le limitazioni legate alla preparazione dei vetrini e studi clinici e non clinici a supporto di questa tecnologia hanno contribuito a meglio comprendere le limitazioni dello striscio.
BIBLIOGRAFIA DI RIFERIMENTO:
- Linder J and Zahniser: ThinPrep Papanicolaou testing to reduce false-negative cervical
VALUTAZIONE AL MICROSCOPIO DEI VETRINI THINPREP®
Deanna K. Iverson, master in Health Science, citologia (ASCP), istotecnologo
George Papanicolaou ha fissato i criteri morfologici dello striscio tradizionale all’inizio degli anni ’20. Con il passare del tempo, sono state apportate modifiche, tutte debitamente documentate, in base ai numerosi studi effettuati. I criteri morfologici di base utilizzati per le analisi con il metodo dello striscio tradizionale e con il ThinPrep Pap Test hanno subito modifiche minime. Le uniche differenze visibili al microscopio sono generalmente associate al metodo di raccolta dei fluidi utilizzato con il sistema ThinPrep®. È importante sottolineare il fatto che l’architettura dei tessuti non viene alterata durante l’elaborazione dello strumento e che per l’interpretazione viene utilizzata la morfologia cellulare classica. Le analogie morfologiche tra il ThinPrep Pap Test e lo striscio tradizionale superano di gran lunga le differenze ed è quindi possibile applicare le conoscenze acquisite grazie alla morfologia tradizionale. Di seguito viene riportato un riassunto delle principali caratteristiche morfologiche del ThinPrep Pap Test e la modalità di screening delle anomalie meglio identificate.
Come avviene per lo striscio tradizionale, lo screening dei vetrini del ThinPrep Pap Test (TPPT) deve essere eseguito in base a uno schema lento e sistematico, sovrapponendo i campi del microscopio. Il bordo circolare del deposito cellulare sul vetrino ThinPrep può essere utilizzato come punto di riferimento. Prima di eseguire una valutazione sistematica del vetrino a bassa potenza (10X), può essere utile eseguire un rapido esame del vetrino con l’obiettivo per la scansione (4X) per valutare la composizione cellulare, identificare il componente endocervicale e determinare la qualità tecnica della preparazione.
I citologi e i patologi esperti sono in grado di identificare facilmente i vari tipi di cellule nei vetrini del ThinPrep Pap Test. Può accadere che il citologo si imbatta in casi biologicamente complessi che richiedono un esame accurato. È ancora possibile eseguire le valutazioni quantitative della cellularità (popolazioni normali e anormali) con un metodo simile a quelli tradizionali. Tuttavia, nei vetrini del ThinPrep Pap Test, la quantità di cellule anormali riveste meno importanza rispetto alla loro presenza o assenza.
Le caratteristiche distintive dei vetrini del ThinPrep Pap Test includono uniformità delle preparazioni cellulari, fissaggio ad umido, dimensione delle cellule, quadro dello striscio e sfondo del campione.
Uniformità delle preparazioni cellulari:
- Concentrata
- Distribuita uniformemente
- Area circolare di 20 mm
Poiché il materiale cellulare è stato raccolto in una soluzione e poi filtrato, la presentazione del campione sui vetrini del ThinPrep Pap Test sembra in qualche modo diversa da quella degli strisci tradizionali. Lo striscio tradizionale presenta aree spesse e sottili, manufatto con essiccamento all’aria e spesso distorsione meccanica del materiale cellulare. Il materiale cellulare sui vetrini del ThinPrep Pap Test è concentrato e uniformemente distribuito all’interno di un’area circolare di 20 mm. È possibile osservare foglietti di epitelio, ma vi è una minore sovrapposizione delle cellule.
Fissaggio ad umido:
- Cellule riunite nella soluzione
- Dettaglio citoplasmatico migliorato
- Soluzione di raccolta a base di metanolo
- Dettaglio nucleare migliorato
- Variabilità nella cromasia
Fissaggio ad umido: ciò che contraddistingue i vetrini del ThinPrep Pap Test è il fatto che il materiale cellulare viene raccolto e posizionato in una soluzione di fissazione. La morfologia cellulare dei vetrini del ThinPrep Pap Test è simile a quella dei campioni non ginecologici, in quanto le cellule tendono a riunirsi nella soluzione, anche se nei vetrini i vari tipi di cellule rimangono ben distinti. Le cellule endocervicali possono apparire più tridimensionali ed essere confuse con le cellule endometriali. La configurazione a palizzata delle cellule endocervicali viene spesso osservata sul perimetro degli aggregati di cellule quando si esegue un esame ad elevato ingrandiemento.
La soluzione di fissazione del ThinPrep Pap Test contiene metanolo, che consente una migliore conservazione delle cellule e della morfologia nucleare. Il dettaglio citoplasmatico migliorato consente di affinare la capacità di determinare la percentuale di cellule e la fase di maturazione. La morfologia nucleare migliorata è il risultato soprattutto del fissaggio ad umido. È possibile che i nuclei vengano interpretati in modo esagerato e si deve prestare particolare attenzione per evitare interpretazioni eccessive dei nuclei ben conservati quando si valutano i vetrini del ThinPrep Pap Test. Il miglioramento nucleare osservato nelle preparazioni ThinPrep è simile a quello degli strisci tradizionali fissati ad umido con il 95% di etanolo.
Nei vetrini del ThinPrep Pap Test, è possibile ridurre l’ipercromasia tipicamente associata a lesioni squamose negli strisci tradizionali. Di conseguenza, l’ipercromasia può non essere un indicatore affidabile nei vetrini del ThinPrep Pap Test. Qualora sia presente, deve essere presa in considerazione, ma l’assenza di ipercromasia non deve portare a trascurare eventuali anomalie nucleari. In assenza di ipercromasia, un’interpretazione accurata delle lesioni di alto grado può risultare particolarmente difficile nei vetrini del ThinPrep Pap Test, perché dipende dalle variazioni della dimensione e della forma dei nuclei, criteri morfologici spesso tralasciati o non valorizzati negli strisci tradizionali.
Dimensione delle cellule:
- Più piccola in proporzione
- Cellule singole più prominenti
Dimensione delle cellule: a causa del fissaggio ad umido, le cellule delle preparazioni del ThinPrep Pap Test possono apparire più piccole in proporzione. Una cellula intermedia ben conservata costituisce un utile riferimento per determinare la dimensione delle cellule e dei nuclei. Si tratta di un notevole aiuto se si devono valutare e interpretare cellule metaplastiche piccole e immature. È essenziale esaminare queste cellule ad alta potenza per valutare attentamente la presenza di atipia nucleare, soprattutto in assenza di ipercromasia.
Le cellule singole si disperdono per formare “campioni secondari distribuiti casualmente”, caratteristici del sistema ThinPrep. Poiché sangue e infiammazioni non coprono queste cellule, sembra che nella preparazione le cellule singole siano più numerose rispetto a uno striscio tradizionale.
Quadro dello striscio:
- Quadro dello “striscio” eliminato
- Quadro dello sfondo alterato
Quadro dello striscio: in linea di massima, l’architettura delle cellule e lo sfondo contestuale dei vetrini del ThinPrep Pap Test sono simili a quelli osservati negli strisci tradizionali ben conservati. Il materiale cellulare sui vetrini del ThinPrep Pap Test è regolare e uniformemente distribuito. L’architettura dei tessuti viene mantenuta (foglietti e sincizio) e la distorsione meccanica notevolmente ridotta.
Sfondo: a differenza degli strisci tradizionali, lo sfondo dei vetrini del ThinPrep Pap Test è solitamente pulito. Per questo motivo, è molto più semplice identificare popolazioni di cellule normali e anormali. Nel vetrino ThinPrep sono presenti sangue, muco, infiammazioni e diatesi, ma questi elementi appaiono leggermente diversi rispetto a uno striscio tradizionale a causa delle differenze nella raccolta e nella preparazione. La presenza di sangue e infiammazioni nei vetrini del ThinPrep Pap Test crea raramente problemi di visibilità, a meno che non si tratti dei materiali predominanti prelevati durante lo striscio. Il sangue fresco viene lisato dall’agente emolitico nel brodo di coltura e i globuli rossi perdono la loro colorazione (cellule “fantasma”). Il sangue vecchio non si lisa completamente e presenta una colorazione rossa variabile. La possibilità di differenziare il sangue fresco dal sangue vecchio può essere utile se si prende in considerazione un processo maligno.
Nei vetrini del ThinPrep Pap Test, il materiale infiammatorio viene disperso in modo più uniforme e spesso aderisce alle cellule epiteliali. Di tanto in tanto, lo sfondo può apparire “malmesso”. Il materiale sul vetrino appare sporco e lacerato, con solo alcune cellule epiteliali squamose ben conservate. Se si osserva questo tipo di sfondo, è essenziale prendere in considerazione i seguenti elementi: la presenza di un agente infettivo, citolisi e/o malattie maligne (diatesi tumorale). Se presente, è possibile osservare la diatesi tumorale (cellule infiammatorie, globuli rossi, fibrina, frammenti cellulari necrotici e materiale proteico granulare) sui vetrini del ThinPrep Pap Test in tutto lo sfondo della preparazione, intorno o sopra le cellule epiteliali (diatesi “aderenti”).