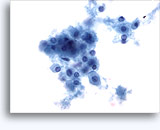
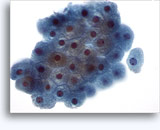
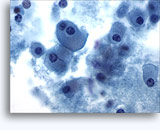
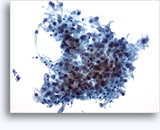
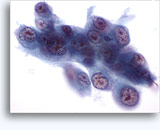
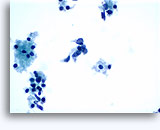
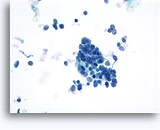
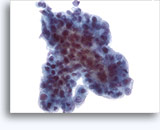
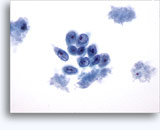
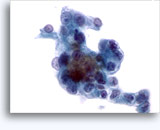
Citologia degli aspirati con ago sottile.
Altre regioni corporee
Michele M. Weir, medico, laureato presso il Royal College of Physicians
Introduzione
Questa sezione è dedicata alle biopsie per aspirazione con ago sottile (FNAB) dei reni, della ghiandola surrenale, delle gonadi, delle ossa e dei tessuti molli.
FNAB renale
La FNAB di una massa renale è una procedura piuttosto inusuale perché la maggior parte dei pazienti che presenta questo genere di massa viene sottoposta direttamente alla resezione. Tuttavia, può essere utilizzata per la valutazione della massa quando:
- le caratteristiche deducibili dalle immagini non sono determinanti per la classificazione;
- il paziente non può essere sottoposto a una procedura chirurgica;
- è necessario pianificare un intervento chirurgico (chirurgia conservativa dei reni o degli ureteri).
La sensibilità della FNAB dei tumori renali si attesta tra il 79 e il 92%, la specificità tra il 92 e il 99% e la precisione complessiva della diagnosi tra il 73 e il 95%. A causa dell’eterogeneità dei tumori e dell’importanza della classificazione citogenetica, la formulazione di una diagnosi definitiva per alcune neoplasie renali è notevolmente facilitata dall’uso di campioni istologici. Può essere molto difficile, mediante la FNAB, classificare in sottotipi alcuni neoplasie oncocitiche negative alla colorazione al ferro colloidale di Hale ed è quindi preferibile formulare una diagnosi differenziale.
Negli adulti, la causa più comune di una massa renale non neoplastica è una cisti renale. Altre lesioni possono essere ascessi e pielonefrite xantogranulomatosa. Tra le neoplasie renali, la patologia benigno più diffusa è l’oncocitoma e quella maligna il carcinoma a cellule renali (RCC). Altre forme neoplastiche includono l’angiomiolipoma e il carcinoma uroteliale della pelvi renale.
Citologia della FNAB dei reni
- Normale
- Campione a bassa cellularità
- Cellule isolate o in piccoli gruppi
- Glomeruli:
- anse capillari, cellule fusate e tondeggianti
- nessuna atipia, sferula o papilla (a differenza del carcinoma papillare a cellule renali)
- strutture cellulari globulari
- somiglianza: carcinoma papillare a cellule renali
- Tubuli contorti prossimali:
- tubuli e lembi
- abbondante citoplasma granulare
- citoplasma fragile non ben definito senza bordi cellulari (a differenza dell’oncocitoma)
- nucleo poco evidente, nucleolo prominente
- somiglianza: oncocitoma, carcinoma a cellule renali
- Tubuli contorti distali/Dotto collettore:
- tubuli, lembi piatti (a differenza del carcinoma a cellule renali)
- citoplasma ben definito, cellule più piccole del normale
- assenza di vacuoli (a differenza del carcinoma a cellule renali)
- assenza di nucleolo
- SOMIGLIANZA: carcinoma a cellule renali
- Oncocitoma
- Fondo pulito
- Aggregati disgiunti o cellule singole non coese, assenza di nuclei striati
- Raramente in grandi gruppi (a differenza del carcinoma a cellule renali)
- Piccoli nuclei uniformi, bordi regolari (a differenza del carcinoma a cellule renali)
- Atipia nucleare focale, binucleazione, nucleoli appena visibili
- Abbondante citoplasma uniformemente granulare e ben definito
- Assenza di vacuoli (a differenza del carcinoma a cellule renali)
- Bordo cellulare tagliente ben definito (a differenza delle cellule dei tubuli contorti prossimali)
- Negativo alla vimentina, positivo alla citocheratina 8/18 (utilizzare il blocco della biotina)
- Negativo alla colorazione del ferro colloidale di Hale o presenza di colorazione perinucleare/atipica
- Microscopia elettronica: mitocondri
- SOMIGLIANZA: tubuli contorti prossimali, carcinoma a cellule renali cromofobo, carcinoma a cellule renali convenzionale con citoplasma granulare
- Carcinoma a cellule renali
- Cellule di tipo convenzionale/comune/chiaro (CRCC)
- fondo pulito o necrotico
- lembi coesi monostrato (a differenza dell’oncocitoma)
- capillari prominenti con diramazioni
- sporadichecellule singole (basso grado) → cellule singole più numerose e nuclei striati (alto grado) (a differenza dell’oncocitoma)
- nuclei regolari, assenza di nucleolo (basso grado)
- nuclei atipici più grandi del normale, alcuni con forme particolari, nucleoli prominenti (alto grado) (a differenza dell’oncocitoma, carcinoma a cellule renali cromofobo)
- nucleo eccentrico, fuoriuscito dalle cellule
- nuclei più uniformi rispetto al carcinoma a cellule renali cromofobo
- citoplasma vacuolato schiumoso (a differenza dell’oncocitoma e del normale)
- abbondante citoplasma trasparente o granulare (non uniforme) (basso rapporto N/C)
- corpi intracitoplasmatici simili a quelli di Mallory
- positivo alla vimentina e citocheratina (utilizzare il blocco della biotina)
- negativo alla colorazione del ferro colloidale di Hale
- microscopia elettronica: glicogeno, lipidi; in alcuni casi mitocondri
- SOMIGLIANZA: tubuli contorti distali e dotto collettore, oncocitoma, carcinoma a cellule renali cromofobo
- Tipo cromofobo
- sfondo pulito
- lembi, aggregati, cellule singole (non coese, ma meno rispetto al carcinoma renale a cellule chiare)
- nuclei nudi (a differenza dell’oncocitoma)
- maggiore variazione della dimensione delle cellule e dei nuclei (rispetto all’oncocitoma e al carcinoma renale a cellule chiare)
- nuclei vescicolari, binucleazione, presenza di inclusioni
- contorno nucleare irregolare (a differenza dell’oncocitoma e del carcinoma renale a cellule chiare)
- in alcuni casi nucleoli prominenti
- abbondante citoplasma granulare
- chiarificazione perinucleare, bordi cellulari prominenti (“aspetto coilocitico”)
- citoplasma impalpabile/chiaro/granulare non uniforme
- negativo alla vimentina, positivo alla citocheratina (utilizzare blocco della biotina)
- positivo alla colorazione del ferro colloidale di Hale – uniforme, denso, citoplasmatico
- microscopia elettronica: microvescicole; mitocondri nella variante eosinofila
- SOMIGLIANZA: oncocitoma e carcinoma renale a cellule chiare
- Cellule di tipo convenzionale/comune/chiaro (CRCC)
FNAB surrenale
La FNAB di una massa surrenale viene in genere effettuata per confermare la presenza di una metastasi o per eseguire ulteriori analisi su un nodulo individuato casualmente. La presenza di un feocromocitoma funzionale o sospetto rappresenta una controindicazione allo svolgimento della FNAB ché potrebbe causare una crisi ipertensiva o addirittura la morte. La sensibilità della FNAB dei tumori della ghiandola surrenale si attesta tra l’85 e il 94% e la specificità per le metastasi al 100%.
Negli adulti, la neoplasia della ghiandola surrenale più diffusa è una metastasi con origine nei polmoni o nel seno. Altri frequenti siti di origine comprendono il tratto gastrointestinale, il pancreas, i reni e la pelle (melanoma). Le neoplasie surrenali primitive includono quelle di origine corticale (adenoma, carcinoma) e di origine midollare (feocromocitoma). Altre lesioni surrenali primitive sono: mielolipoma, cisti e iperplasia nodulare corticale.
Citologia della FNAB surrenale
- Normale
- Bassa cellularità
- Corteccia: strati esterni
- fondo schiumoso ricco di lipidi
- cellule singole, aggregati
- nuclei ovali regolari
- nucleoli assenti o piccoli
- abbondante citoplasma vacuolato con bordi sfilacciati
- SOMIGLIANZA: può non essere distinguibile da un nodulo corticale surrenale benigno e da alcuni surrenali carcinomi corticali
- Corteccia: strato interno
- nessuna vacuolizzazione
- citoplasma eosinofilo granulare
- cellule più piccole del normale
- pigmento lipofucsina
- Midollo:
- citoplasma basofilo
- nucleo grande eccentrico
- nucleoli evidenti
- cromatina leggermente granulare
- Nodulo surrenale corticale benigno
- Può essere un campione cellulare
- Fondo schiumoso ricco di lipidi (assente nel carcinoma a cellule renali)
- Frammenti coesi con cellule endoteliali sinusoidali
- Nuclei striati
- Nuclei tondi o ovali (più uniformi rispetto al carcinoma a cellule renali)
- Nucleoli assenti o piccoli
- Multinucleazione
- Citoplasma vacuolato (più di quello del carcinoma a cellule renali)
- Positivo a vimentina e, in alcuni casi, a citocheratina (basso peso molecolare)
- Positivo a inibina, Melan-A, calretinina
- Negativo a EMA, CK7, CK20
- SOMIGLIANZA: carcinoma a cellule renali, può non essere distinguibile da una ghiandola surrenale normale e da alcuni carcinomi surrenali corticali
- Carcinoma surrenale corticale adrenale
- RICORDA le caratteristiche dell’adenoma
- Può essere presente necrosi
- Si possono rilevare criteri dei nuclei maligni
- La valutazione istologica è necessaria per distinguere grandi adenomi da carcinomi
- Profilo immunologico simile all’adenoma
- SOMIGLIANZA: può non essere distinguibile da una ghiandola surrenale normale e da un adenoma surrenale corticale; feocromocitoma e altri tumori maligni, se scarsamente differenziati
- Feocromocitoma
- 3 tipi di cellule
- n.1 – citoplasma fibrillare, nuclei ovali ipercromici che possono mostrare anisonucleosi/pleomorfismo/binucleazione
- n.2 – cellule fusiformi (cellule di Sertoli)
- n.3 – cellule plasmocitoidi
- In alcuni casi, pigmento di melanina
- Alcuni aggregati disgiunti e cellule singole non coese
- Notevole variazione della dimensione e della forma nucleare
- Granularità citoplasmatica rossa nel materiale fissato all’aria
- Positivo a sinaptofisina e cromogranina; positivo a S-100 nelle cellule fusiformi
- SOMIGLIANZA: carcinoma surrenale corticale e altri tumori maligni scarsamente differenziati
- 3 tipi di cellule
- Carcinoma metastatico
- Popolazione uniforme di cellule
- Criteri dei nuclei maligni, possibili caratteristiche neuroendocrine
- Può esserci una differenziazione ghiandolare o squamosa del citoplasma
- Possibile necrosi
- Positivo a citocheratina
- Il profilo CK7, CK20 può delimitare il sito di origine
- In genere, negativo a inibina, Melan-A, calretinina
- Il TTF-1 può confermare l’origine polmonare
- SOMIGLIANZA: feocromocitoma, carcinoma surrenale corticale e altri tumori maligni scarsamente differenziati
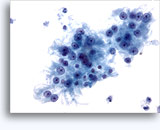
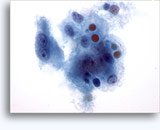
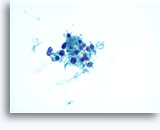
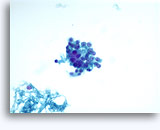
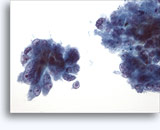
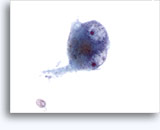
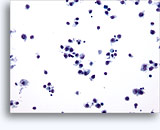
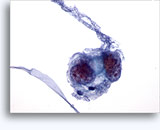
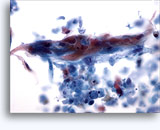
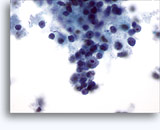
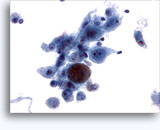
Figure 22-23: Piccole cellule con nuclei ipercromici e ripiegati irregolarmente, citoplasma sottile e rapporti N/C elevati. Lo sfondo presenta frammenti granulari necrotici.
FNAB dell’ovaio e del testicolo
Le FNAB dell’ovaio e del testicolo vengono eseguite molto di rado per formulare diagnosi primarie di neoplasie gonadiche. Nell’America del Nord, la FNAB ha un ruolo fondamentale per la diagnosi dei tumori maligni gonadici metastatici o ricorrenti. In quest’ultimo caso, la sensibilità diagnostica della FNAB si attesta tra il 65 e il 95% e la specificità è ancora più elevata (92-100%). Le ragioni che portano ad un risultato negativo possono includere un errore di campionamento dovuto a fibrosi provocata da radiazioni, dimensione della massa o presenza di necrosi e ad un errore di interpretazione (diagnosi benigna per sottovalutazione).
Citologia selezionata della FNAB dell’ovaio
- Adenocarcinoma sieroso
- Campioni cellulari
- Papille, alcune con diramazioni
- Alcune cellule singole
- Criteri dei nuclei maligni, che possono essere assenti se il tumore è di basso grado
- Vacuoli intracitoplasmatici
- Corpi psammomatosi nudi o in gruppi di cellule (risultato non specifico)
- SOMIGLIANZA: altri carcinomi (primari e secondari), se di basso grado, non distinguibili dal tumore sieroso borderline
Citologia selezionata della FNAB del testicolo
- Seminoma
- Grandi cellule disperse e alcuni aggregati
- Nuclei striati, citoplasma fine
- Cellule allo stadio iniziale: nuclei centrali, cromatina vescicolare a grana fine, nucleolo centrale prominente
- Linfociti nello sfondo, istiociti epitelioidi
- Fondo tigrato (schiumoso, a strisce; può essere assente o minimo nelle preparazioni su strato sottile)
- Positivo a PLAP; negativo a LCA, AFP, citocheratina
- SOMIGLIANZA: altri tumori a cellule germinali, linfoma maligno
- Carcinoma embrionale
- Presenza di necrosi
- Papillare, simil-ghiandolare o in lembi
- Nuclei pleomorfici, cromatina a grana grossa, vari nucleoli prominenti
- Positivo a PLAP e citocheratina; positivo o meno a AFP; negativo a LCA
- SOMIGLIANZA: altri tumori a cellule germinali, linfoma maligno, melanoma, carcinoma di alto grado
FNAB di ossa e tessuti molli
La FNAB di ossa e tessuti molli viene solitamente utilizzata per confermare la presenza di un tumore metastatico, in genere un carcinoma. In alcuni centri ospedalieri, la FNAB viene impiegata per formulare diagnosi di determinati tipi di sarcoma primitivo delle ossa e dei tessuti molli. La precisione della diagnosi mediante FNAB è maggiore in presenza di neoplasie metastatiche (92-100%).
Citologia della FNAB da metastasi delle ossa e dei tessuti molli
- Carcinoma metastatico
- In alcuni casi, necrosi
- Caratteristiche nucleari maligne
- Aggregati di cellule e cellule singole (mancanza di coesione)
- Differenziazione neuroendocrina: rapporti N/C elevati, nuclei ipercromici e ripiegati irregolarmente con citoplasma sottile
- Differenziazione ghiandolare: vacuoli intracitoplasmatici, gruppi di cellule, papille, ghiandole
- Differenziazione squamosa: cheratinizzazione, citoplasma rifrangente compatto
- Differenziazione uroteliale: cellule a forma di cercaria (code citoplasmatiche)
- In genere, positivo alla citocheratina
- Melanoma maligno metastatico
- Cellule singole non coese
- Caratteristiche nucleari maligne, nuclei eccentrici
- Tipi di pattern: cellule piccole, fusiformi o epitelioidi
- Variazione della dimensione dei nuclei
- Pseudoinclusioni nucleari con binucleazione o multinucleazione
- Pigmento intracitoplasmatico marrone picchiettato di melanina
- Positivo a S-100, HMB-45, Melan-A (non sempre)
- Linfoma maligno
- Cellule singole non coese
- Cromatina granulare lassa
- In alcuni sottotipi, nucleoli con base nella membrana nucleare
- Protrusioni e irregolarità della membrana nucleare
- In alcuni sottotipi, citoplasma sottile (rapporti N/C elevati).
- Corpi linfoghiandolari sul fondo
- Positivo a LCA, linea cellulare B o T
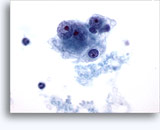
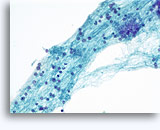
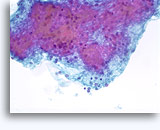
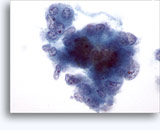
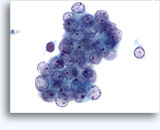
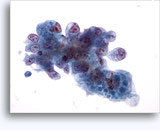
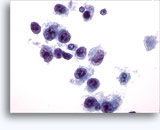
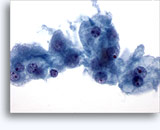
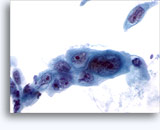
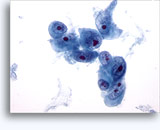
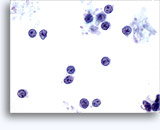
Figure 37-38: Cellule singole non coese con rapporti N/C elevati, citoplasma sottile, cromatina aperta, protrusioni della membrana e nucleoli con base nella membrana. Corpi linfoghiandolari sul fondo.
Bibliografia di riferimento
- Bommer KK, Ramzy I and Mody D. Fine-Needle Aspiration Biopsy in the Diagnosis and Management of Bone Lesions. Cancer (Cancer Cytopathology) 1997; 81:148-56.
- Caraway NP, Fanning CV, Amato RJ and Sneige N. Fine-Needle Aspiration Cytology of Seminoma: A Review of 16 Cases. Diagnostic Cytopathology 1995; 12:327-33.
- Geisinger KR et al. Modern Cytopathology. Philadelphia, Churchill Livingstone. 2004; pp 579-606, 689-700.
- Kabukcuoglu F, Kabukcuoglu Y, Kuzgun U and Evren I. Fine Needle aspiration of Malignant Bone Lesions. Acta Cytologica 1998;42:875-82.
- Liu J, Fanning CV. Can Renal Oncocytomas be Distinguished from Renal Cell Carcinoma on Fine-Needle Aspiration Specimens? Cancer (Cancer Cytopathol) 2001;93:390-7.
- Nguyen G and Akin MM. Fine Needle Aspiration Cytology of the Kidney, Renal Pelvis and Adrenal. In:Clinics in Laboratory Medicine. Stanley MW editor. Philadelphia. WB Saunders Company. 1998;18(3):429-60.
- Renshaw AA, Granter SR, Cibas ES. Fine-Needle Aspiration of the Adult Kidney. Cancer (Cancer Cytopathol) 1997;81:71-88.
- Renshaw, AA, Lee KR, Madge R, Granter SR. Accuracy of Fine Needle Aspiration in Distinguishing Subtypes of Renal Cell Carcinoma. Acta Cytol 1997;41:987-94.
- Wakely PE, Kneisl, JS. Soft Tissue Aspiration Cytopathology. Cancer (Cancer Cytopathol) 2000;90:292-8.
- Wiatrowska, BA, Zakowski MF. Fine-Needle Aspiration Biopsy of Chromophobe Renal Cell Carcinoma and Oncocytoma. Cancer (Cancer Cytopathol) 1999;87:161-7.
- Wu H H, Cramer HM, Kho J and Elsheikh, TM. Fine Needle Aspiration Cytology of Benign Adrenal Cortical Nodules. Acta Cytologica 1998;42:1352-8.
- Yang B, Syed ZA and Rosenthal DL. CD10 Facilitates the Diagnosis of Metastatic Renal Cell Carcinoma From Primary Adrenal Cortical Neoplasm in Adrenal Fine-Needle Aspiration. Diagn. Cytopathol. 2002;27:149-52.
- Zardauin IM. Renal FNAC Acta Cytol 1999;43:184-90.
- Zhang, PJ, Genega EM, Tomaszewski JE, Pasha TL, LiVolsi VA. The Role of Calretinin, Inhibin, Melan-A, BCL-2, and C-kit in Differentiating Adrenal Cortical and Medullary Tumors: An Immunohistochemical Study. Mod Pathol 2003;16(6):591-7.