Le biopsie per aspirazione con ago sottile (FNA) del fegato o del pancreas sono procedure estremamente diffuse in molti centri ospedalieri. In genere, la biopsia per aspirazione con ago sottile viene eseguita per consentire la valutazione di una massa. In passato, i patologi eseguivano frequentemente valutazioni dei tessuti delle masse del fegato mediante biopsie percutanee, mentre oggi la FNA è diventata la procedura standard nella maggior parte degli ospedali. La FNA del pancreas si è affermata al posto delle biopsie percutanee a causa del possibile verificarsi di pancreatiti in seguito a quest’ultimo tipo di intervento. Uno dei vantaggi delle biopsie per aspirazione con ago sottile del fegato o del pancreas è rappresentato dalla possibilità di ottenere vari aspirati nel corso di una singola procedura. Questo consente potenzialmente un campionamento più completo della massa.
Talvolta, durante la valutazione di una massa viene aspirato un nodulo dominante in cirrosi [1, 2] . Un’importante caratteristica citologica di un nodulo cirrotico è l’aspetto variabile piuttosto che uniforme delle cellule epatiche nei vetrini ThinPrep. In alcuni casi, sono rilevabili caratteristiche atipiche quali aumento dei nuclei, binucleazione e anisonucleosi, utili per formulare una diagnosi di cirrosi: bisogna infatti considerare che l’aspetto polimorfico della popolazione di cellule epatiche è tipico degli epatociti reattivi benigni mentre nel carcinoma epatocellulare si osserva atipia uniforme. Oltre alla cellularità variabile delle cellule epatiche in cirrosi, sono riscontrabili sottili trabecole e corde con uno spessore di non più di due cellule e le cellule hanno rapporto nucleo/citoplasmatico basso. È possibile osservare anche dotti biliari associati a sporadiche cellule infiammatorie e tessuto fibroso.[1, 2]
Gli aspirati dei carcinomi epatocellulari sottoposti alla preparazione ThinPrep mostrano cellule con rapporti nucleo/citoplasmici uniformemente elevati, diramazioni complesse e spesse trabecole anastomizzate con bordi nettamente demarcati. Le trabecole hanno uno spessore superiore alle quattro cellule e sono circondate da endotelio periferico con alcune cellule endoteliali “trasgressive”. Sono spesso visibili cellule singole sparse o in piccoli gruppi e nuclei striati atipici di epatociti. Talvolta, è rilevabile pigmento biliare [1, 2, 6, 7, 8, 9, 10, 11, 12, 13] .
È possibile imbattersi in varianti del carcinoma epatocellulare, come il carcinoma epatocellulare fibrolamellare, sottotipi a piccole cellule e cellule chiare e tumori misti carcinoma epatocellulare/colangiocarcinoma. Le caratteristiche citologiche di tali varianti vengono adeguatamente descritte nei normali libri di testo. [1, 2]
Nei vetrini ThinPrep, gli aspirati dei tumori epatocellulari benigni come l’adenoma e l’iperplasia nodulare focale presentano cellule epatiche non diverse dagli epatociti del fegato normale circostante la lesione.[1, 2].A differenza degli adenomi, l’iperplasia nodulare focale presenta frammenti di tessuto fibroso e dotti biliari.
A causa dell’assenza di atipie , non è possibile formulare una diagnosi specifica di adenoma o iperplasia nodulare focale in base all’analisi dei campioni ottenuti mediante aspirazione con ago sottile. Di conseguenza, è estremamente difficile correlare i risultati citologici con il posizionamento dell’ago nel nodulo iperplastico.
Poiché il fegato rappresenta la seconda localizzazione addominale maggiormente colpita da tumori maligni metastatici, dopo i linfonodi, gli aspirati del carcinoma metastatico del fegato sono piuttosto comuni. I carcinomi metastatici costituiscono più del 90% di tutte le neoplasie epatiche maligne. Gli adenocarcinomi rappresentano il principale tipo istologico di carcinoma metastatico del fegato, con una netta prevalenza del carcinoma colon- rettale. Le caratteristiche citomorfologiche del carcinoma metastatico sono piuttosto simili alle caratteristiche citologiche osservate nel colangiocarcinoma primitivo . Le i FNA degli adenocarcinomi sono in genere costituite da aggregati di cellule maligne coese in cui è visibile una formazione ghiandolare. Sono presenti cellule di forma da cuboide a colonnare con citoplasma fine pallido ed eccentrico, nuclei da tondi a irregolari con nucleoli prominenti. Il carcinoma colon-rettale presenta in associazione un fondo sporco necrotico , in contrasto col fondo pulito del colangiocarcinoma. Inoltre, è possibile imbattersi in tumori caratterizzati da altri tipi di cellule, come il carcinoma a piccole cellule metastatico, il melanoma, il linfoma maligno e i tumori mesenchimali.[1, 2]
Le biopsie per aspirazione con ago sottile percutanee, intraoperatorie ed eco-guidate (EUS) vengono sempre più spesso utilizzate per la valutazione di masse cistiche e solide del pancreas [1, 2, 14, 15]. La FNAB presenta chiari vantaggi rispetto alle grandi biopsie percutanee e alle resezioni a cuneo del pancreas, perché queste ultime procedure possono causare pancreatiti e/o peritoniti a causa della fuoriuscita di enzimi esocrini e bile [16]. La biopsia per aspirazione con ago sottile del pancreas può rivelarsi estremamente utile per la diagnosi di una lesione infiammatoria pancreatica ed evitare la neccessità di ricorrere all’uso di una procedura chirurgica. I citopatologi devono quindi conoscere le caratteristiche citologiche e i vari tipi di alterazioni dell’epitelio duttale benigno e pancreatico acinare [1, 2, 17]. In genere, le cellule pancreatiche duttali sono disposte in lembi piatti a nido d’ape con nuclei tondi o ovali distribuiti in modo uniforme e bordi cellulari ben definiti. Le cellule acinari tendono a disporsi in piccoli aggregati coesi, costituiti da cellule con nuclei basali piccoli e uniformi, cromatina finemente granulare o aggregata e nucleoli appena visibili circondati da una quantità moderata di citoplasma granulare. Negli aspirati non sono solitamente rilevabili cellule insulari [1, 2, 14, 18]
Gli aspirati delle pseudocisti pancreatiche sono in genere caratterizzati da scarsa cellularità con cellule epiteliali sporadiche o assenti, ma è possibile osservare cellule riconducibili a infiammazioni acute e croniche, istiociti, tessuto granulare e frammenti sul fondo con tracce di calcificazione [1, 2] . Le caratteristiche citomorfologiche della pancreatite acuta comprendono cellularità moderata o elevata con una prevalenza di neutrofili negli strisci e un fondo “sporco” [1, 2] . Le cellule duttali e/o acinari possono presentare necrosi adiposa e atipia dovuta a un processo riparatorio o infiammatorio. Al contrario, gli aspirati delle pancreatiti croniche sono in genere caratterizzati da scarsa cellularità con sporadiche cellule duttali che tendono a non mostrare il livello di caratteristiche atipiche o reattive proprie delle pancreatiti acute [1, 2] . Sono presenti cellule riconducibili a infiammazione cronica.
È essenziale riconoscere le caratteristiche citomorfologiche dell’adenocarcinoma pancreatico, perché si tratta di un tumore maligno diffuso (rappresenta circa il 3% di tutti i tumori e il 5% delle cause di mortalità per cancro). [18, 19] Circa i ¾ di tutti gli adenocarcinomi pancreatici sono di tipo duttale. Nei vetrini ThinPrep, le caratteristiche citomorfologiche degli adenocarcinomi duttali comprendono un’elevata cellularità con cellule atipiche disposte singolarmente e in gruppi e aggregati. [1, 2] Tra i gruppi di cellule, è rilevabile una disposizione sinciziale e una perdita di polarità nucleare. È possibile osservare un aumento sia nucleare che citoplasmatico. I nuclei tendono a essere ipercromici, con cromatina e bordi irregolari e alcuni solchi nucleari. Sono rilevabili una notevole variazione della dimensione nucleare e la presenza di nucleoli prominenti. Il fondo presenta di solito diatesi tumorali.
Le varianti meno frequenti dell’adenocarcinoma pancreatico comprendono il carcinoma anaplastico (carcinoma a cellule giganti pleomorfe), caratterizzato da una popolazione vistosamente pleomorfa che include cellule maligne giganti e/o fusiformi, e il raro tumore del pancreas a cellule giganti simili a osteoclasti, in cui si osservano cellule giganti con nuclei aggregati centralmente e una quantità moderata di citoplasma circostante ed altre cellule simili ma mononucleate. [1, 2] [1, 2]
Gli aspirati delle neoplasie a cellule insulari tendono a presentare una elevata cellularità ed essere costituiti da una popolazione monomorfa di cellule piccole e uniformi disposte prevalentemente in modo non coeso. Le cellule tumorali sono piccole, con nuclei tondi o ovali, cromatina dispersa finemente o vistosamente granulare e nucleoli appena visibili. I nuclei sono centrali. Al contrario, gli aspirati del raro carcinoma a cellule acinari presentano cellule disposte in modo lobulare e nuclei ipercromici con cromatina aggregata e nucleoli prominenti. [1, 2] Sia le cellule insulari che quelle acinari hanno citoplasma granulare. Le caratteristiche citomorfologiche del tumore papillare cistico comprendono strutture papillari con nocciolo fibrovascolare ricoperto da uno o più strati di cellule epiteliali con cromatina dispersa, membrane nucleari sottili e sporadici solchi nucleari longitudinali. [1, 2] I neoplasmi cistici mucinosi, al contrario, hanno nuclei che variano da regolari ad atipici, fino a chiaramente maligni [1, 2]. Le cellule possono essere disposte singolarmente, in gruppi piatti a nido d’ape o in aggregati tridimensionali e possono essere associate ad abbondante materiale mucinoso intra e/o extracellulare. Altre lesioni meno diffuse descritte nella letteratura relativa alle biopsie per aspirazione con ago sottile, comprendono aspirati del cistoadenoma sieroso e del pancreatoblastoma. [1, 2, 20] Infine, è possibile imbattersi in aspirazioni con ago sottile di tumori metastatici del pancreas [21].
Ricorda: Puoi cliccare su qualsiasi immagine per ingrandire l’immagine.
Fegato
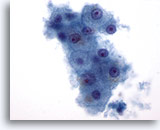
Figura 1: Aspirazione con ago sottile del fegato – Epatociti benigni
Un piccolo aggregato di epatociti benigni costituito da cellule tonde o poligonali con bordi ben definiti , nuclei centrali e citoplasma granulare. È osservabile anche pigmentazione intracitoplasmatica. Sebbene siano visibili piccoli nucleoli, non vi è traccia di atipia o incremento dei rapporti nucleo/citoplasmatici.60x
Figura 1
Aspirazione con ago sottile del fegato – Epatociti benigni
Un piccolo aggregato di epatociti benigni costituito da cellule tonde o poligonali con bordi ben definiti , nuclei centrali e citoplasma granulare. È osservabile anche pigmentazione intracitoplasmatica. Sebbene siano visibili piccoli nucleoli, non vi è traccia di atipia o incremento dei rapporti nucleo/citoplasmatici.60x
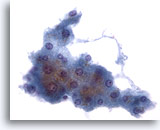
Figura 2: Aspirazione con ago sottile del fegato – Epatociti benigni.
Aggregato di epatociti reattivi benigni costituito da cellule di forma cubica con bordi ben definiti e citoplasma opaco, vacuolato e piuttosto granulare. Il gruppo presenta bordi sfilacciati. I nuclei sono caratterizzati da lievi variazioni della dimensione ed è possibile notare qualche sporadica cellula binucleata. Sono osservabili piccoli nucleoli.40x
Figura 2
Aspirazione con ago sottile del fegato – Epatociti benigni
Aggregato di epatociti reattivi benigni costituito da cellule di forma cubica con bordi ben definiti e citoplasma opaco, vacuolato e piuttosto granulare. Il gruppo presenta bordi sfilacciati. I nuclei sono caratterizzati da lievi variazioni della dimensione ed è possibile notare qualche sporadica cellula binucleata. Sono osservabili piccoli nucleoli.40x
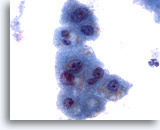
Figura 3
Aspirazione con ago sottile del fegato – Epatociti benigni
È possibile notare una lieve variazione della dimensione nucleare e rapporti nucleo/citoplasmatici bassi, tipici degli epatociti reattivi. È inoltre osservabile una leggera vacuolizzazione del citoplasma e la presenza di pigmento intracitoplasmatico.60x
Figura 3
Aspirazione con ago sottile del fegato – Epatociti benigni
È possibile notare una lieve variazione della dimensione nucleare e rapporti nucleo/citoplasmatici bassi, tipici degli epatociti reattivi. È inoltre osservabile una leggera vacuolizzazione del citoplasma e la presenza di pigmento intracitoplasmatico.60x
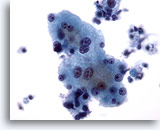
Figura 4
Aspirazione con ago sottile del fegato – Epatociti benigni
Epatociti reattivi che mostrano binucleazione e una variazione della dimensione nucleare.40x
Figura 4
Aspirazione con ago sottile del fegato – Epatociti benigni
Epatociti reattivi che mostrano binucleazione e una variazione della dimensione nucleare.40x
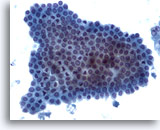
Figura 5
Aspirazione con ago sottile del fegato – Cellule duttali benigne
Un aggregato di cellule benigne del dotto biliare con disposizione a nido d’ape e piccoli nuclei uniformi.20x
Figura 5
Aspirazione con ago sottile del fegato – Cellule duttali benigne
Un aggregato di cellule benigne del dotto biliare con disposizione a nido d’ape e piccoli nuclei uniformi.20x
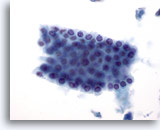
Figura 6
Aspirazione con ago sottile del fegato – Cellule duttali benigne.
Gruppo di cellule benigne del dotto biliare disposte a nido d’ape. Le cellule hanno forma cubica con piccoli nucleoli distribuiti in modo uniforme. Le cellule duttali sono caratterizzate da rapporti nucleo/citoplasmatici più elevati rispetto agli epatociti e non presentano granularità citoplasmatica, vacuolizzazione e/o pigmenti. 40x
Figura 6
Aspirazione con ago sottile del fegato – Cellule duttali benigne
Gruppo di cellule benigne del dotto biliare disposte a nido d’ape. Le cellule hanno forma cubica con piccoli nucleoli distribuiti in modo uniforme. Le cellule duttali sono caratterizzate da rapporti nucleo/citoplasmatici più elevati rispetto agli epatociti e non presentano granularità citoplasmatica, vacuolizzazione e/o pigmenti.40x
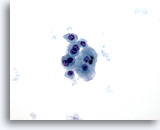
Figura 7
Aspirazione con ago sottile del fegato – Cirrosi
Aggregato disgiunto di epatociti benigni caratterizzati da binucleazione e rapporti nucleo/citoplasmatici bassi.40x
Figura 7
Aspirazione con ago sottile del fegato – Cirrosi
Aggregato disgiunto di epatociti benigni caratterizzati da binucleazione e rapporti nucleo/citoplasmatici bassi.40x
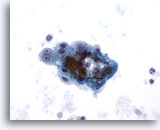
Figura 8
Aspirazione con ago sottile del fegato – Cirrosi
Aggregato disgiunto di epatociti reattivi benigni riconducibile a un nodulo cirrotico. È possibile notare la binucleazione con nucleoli prominenti, ma i rapporti nucleo/citoplasmatici rimangono bassi.40x
Figura 8
Aspirazione con ago sottile del fegato – Cirrosi
Aggregato disgiunto di epatociti reattivi benigni riconducibile a un nodulo cirrotico. È possibile notare la binucleazione con nucleoli prominenti, ma i rapporti nucleo/citoplasmatici rimangono bassi.40x
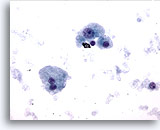
Figura 9
Aspirazione con ago sottile del fegato – Cirrosi
Epatociti benigni singoli e sparsi riconducibili a un nodulo cirrotico. È osservabile una variazione della dimensione nucleare, ma nessuna irregolarità del nucleo. Si nota un epatocita binucleato. I rapporti nucleo/citoplasmatici rimangono bassi.40x
Figura 9
Aspirazione con ago sottile del fegato – Cirrosi
Epatociti benigni singoli e sparsi riconducibili a un nodulo cirrotico. È osservabile una variazione della dimensione nucleare, ma nessuna irregolarità del nucleo. Si nota un epatocita binucleato. I rapporti nucleo/citoplasmatici rimangono bassi.40x
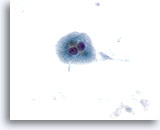
Figura 10
Aspirazione con ago sottile del fegato – Cirrosi
Epatociti benigni binucleati singoli e sparsi riconducibili a un nodulo cirrotico.40x
Figura 10
Aspirazione con ago sottile del fegato – Cirrosi
Epatociti benigni binucleati singoli e sparsi riconducibili a un nodulo cirrotico.40x
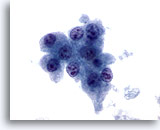
Figura 11
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Gli epatociti del carcinoma epatocellulare mostrano un’atipicità uniforme, compresi rapporti nucleo/citoplasmatici aumentati e nuclei con nucleoli multipli irregolari.60x
Figura 11
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Gli epatociti del carcinoma epatocellulare mostrano un’atipicità uniforme, compresi rapporti nucleo/citoplasmatici aumentati e nuclei con nucleoli multipli irregolari.60x
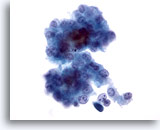
Figura 12
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aggregato disgiunto di epatociti maligni provenienti dall’aspirato di un carcinoma epatocellulare. È osservabile un’atipicità uniforme con rapporti nucleo/citoplasmatici aumentati. È inoltre possibile notare alcuni pigmenti biliari tra gli epatociti.40x
Figura 12
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aggregato disgiunto di epatociti maligni provenienti dall’aspirato di un carcinoma epatocellulare. È osservabile un’atipicità uniforme con rapporti nucleo/citoplasmatici aumentati. È inoltre possibile notare alcuni pigmenti biliari tra gli epatociti.40x
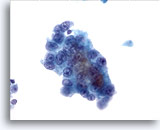
Figura 13
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Carcinoma epatocellulare ben differenziato in cui le cellule del fegato presentano rapporti nucleo/citoplasmatici aumentati e atipicità uniforme.40x
Figura 13
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Carcinoma epatocellulare ben differenziato in cui le cellule del fegato presentano rapporti nucleo/citoplasmatici aumentati e atipicità uniforme.40x
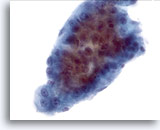
Figura 14
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Un aggregato proveniente da un carcinoma epatocellulare costituito da spesse trabecole con bordi decisamente demarcati tipici di questo tipo di carcinoma. È riscontrabile un’atipicità uniforme degli epatociti.40x
Figura 14
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Un aggregato proveniente da un carcinoma epatocellulare costituito da spesse trabecole con bordi decisamente demarcati tipici di questo tipo di carcinoma. È riscontrabile un’atipicità uniforme degli epatociti.40x
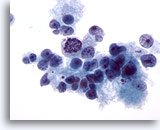
Figura 15
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Carcinoma epatocellulare scarsamente differenziato che presenta epatociti maligni scarsamente coesivi e una significativa variazione della forma e della dimensione nucleare.40x
Figura 15
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Carcinoma epatocellulare scarsamente differenziato che presenta epatociti maligni scarsamente coesivi e una significativa variazione della forma e della dimensione nucleare.40x
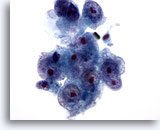
Figura 16
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Carcinoma epatocellulare scarsamente differenziato che presenta epatociti con rapporti nucleo/citoplasmatici elevati e irregolarità dei nuclei. Sono presenti nucleoli prominenti multipli.60x
Figura 16
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Carcinoma epatocellulare scarsamente differenziato che presenta epatociti con rapporti nucleo/citoplasmatici elevati e irregolarità dei nuclei. Sono presenti nucleoli prominenti multipli.60x
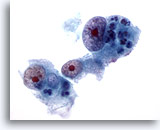
Figura 17
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Carcinoma epatocellulare scarsamente differenziato in cui gli epatociti mostrano aumento e irregolarità nucleare e nucleoli decisamente prominenti.60x
Figura 17
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Carcinoma epatocellulare scarsamente differenziato in cui gli epatociti mostrano aumento e irregolarità nucleare e nucleoli decisamente prominenti.60x
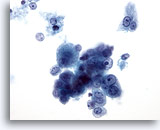
Figura 18: Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aggregato disgiunto di epatociti maligni singoli e sparsi che presentano atipicità uniforme. Le cellule del fegato conservano le caratteristiche epatocitiche e hanno forma più cubica con nucleoli in posizione centrale. È possibile notare cellule tumorali binucleate. Sono osservabili rapporti nucleo/citoplasmatici aumentati.40x
Figura 18
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aggregato disgiunto di epatociti maligni singoli e sparsi che presentano atipicità uniforme. Le cellule del fegato conservano le caratteristiche epatocitiche e hanno forma più cubica con nucleoli in posizione centrale. È possibile notare cellule tumorali binucleate. Sono osservabili rapporti nucleo/citoplasmatici aumentati.40x
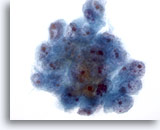
Figura 19
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aggregato di cellule maligne nell’aspirato di un carcinoma epatocellulare. È possibile notare aumento dei nuclei, distribuzione irregolare della cromatina, presenza di uno o più nucleoli e rapporti nucleo/citoplasmatici aumentati.40x
Figura 19
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aggregato di cellule maligne nell’aspirato di un carcinoma epatocellulare. È possibile notare aumento dei nuclei, distribuzione irregolare della cromatina, presenza di uno o più nucleoli e rapporti nucleo/citoplasmatici aumentati.40x
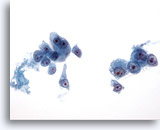
Figura 20
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Cellule maligne singole o scarsamente coesive nell’aspirato di un carcinoma epatocellulare. È presente un’atipicità uniforme in cui le cellule maligne sono caratterizzate da rapporti nucleo/citoplasmatici aumentati. Sono visibili anche nucleoli prominenti.40x
Figura 20
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Cellule maligne singole o scarsamente coesive nell’aspirato di un carcinoma epatocellulare. È presente un’atipicità uniforme in cui le cellule maligne sono caratterizzate da rapporti nucleo/citoplasmatici aumentati. Sono visibili anche nucleoli prominenti.40x
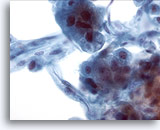
Figura 21
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aspirato di un carcinoma epatocellulare in cui è possibile notare epatociti e cellule endoteliali in posizione periferica. Le cellule endoteliali sono caratterizzate da cellule fusiformi con nuclei allungati e citoplasma indistinto.40x
Figura 21
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aspirato di un carcinoma epatocellulare in cui è possibile notare epatociti e cellule endoteliali in posizione periferica. Le cellule endoteliali sono caratterizzate da cellule fusiformi con nuclei allungati e citoplasma indistinto.40x
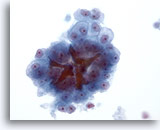
Figura 22
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Carcinoma epatocellulare costituito da epatociti atipici che presentano un’atipicità uniforme e ostruzioni biliari.40x
Figura 22
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Carcinoma epatocellulare costituito da epatociti atipici che presentano un’atipicità uniforme e ostruzioni biliari.40x
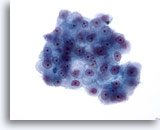
Figura 23
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aggregato di cellule maligne con rapporti nucleo/citoplasmatici aumentati e nuclei dalla forma ovale o piuttosto irregolare. Sono presenti anche nucleoli prominenti. Il citoplasma è granulare o tenue con bordi aguzzi. 40x
Figura 23
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aggregato di cellule maligne con rapporti nucleo/citoplasmatici aumentati e nuclei dalla forma ovale o piuttosto irregolare. Sono presenti anche nucleoli prominenti. Il citoplasma è granulare o tenue con bordi aguzzi.40x
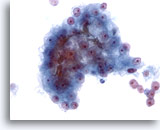
Figura 24
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aggregato di cellule maligne nell’aspirato di un carcinoma epatocellulare in cui è visibile un’ostruzione biliare. Sebbene la presenza di bile sia una caratteristica tipica del carcinoma epatocellulare, viene riscontrata solo in un ristretto numero di casi.40x
Figura 24
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aggregato di cellule maligne nell’aspirato di un carcinoma epatocellulare in cui è visibile un’ostruzione biliare. Sebbene la presenza di bile sia una caratteristica tipica del carcinoma epatocellulare, viene riscontrata solo in un ristretto numero di casi.40x
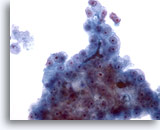
Figura 25
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Un altro esempio di ostruzione biliare nell’aspirato di un carcinoma epatocellulare.40x
Figura 25
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Un altro esempio di ostruzione biliare nell’aspirato di un carcinoma epatocellulare.40x
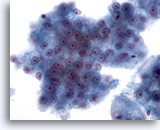
Figura 26
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aggregati di epatociti maligni con atipia uniforme.40x
Figura 26
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aggregati di epatociti maligni con atipia uniforme.40x
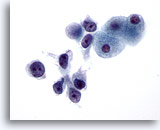
Figura 27
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Carcinoma epatocellulare scarsamente differenziato caratterizzato da pattern dissociativo con cellule maligne che presentano rapporti nucleo/citoplasmatici considerevolmente aumentati.60x
Figura 27
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Carcinoma epatocellulare scarsamente differenziato caratterizzato da pattern dissociativo con cellule maligne che presentano rapporti nucleo/citoplasmatici considerevolmente aumentati.60x
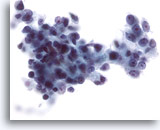
Figura 28
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Carcinoma epatocellulare scarsamente differenziato in cui le cellule maligne sono caratterizzate da rapporti nucleo/citoplasmatici considerevolmente aumentati. È inoltre possibile notare una evidente irregolarità dei nuclei.40x
Figura 28
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Carcinoma epatocellulare scarsamente differenziato in cui le cellule maligne sono caratterizzate da rapporti nucleo/citoplasmatici considerevolmente aumentati. È inoltre possibile notare una evidente irregolarità dei nuclei.40x
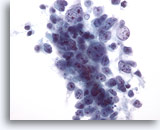
Figura 29: Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aspirato di carcinoma epatocellulare in cui le cellule tumorali sono scarsamente coesive. Poiché i carcinomi epatocellulari sono più scarsamente differenziati, presentano un minor grado di coesione e perdono alcune delle caratteristiche “epatocellulari”. Di conseguenza, spesso è molto difficile determinare se si è in presenza di un carcinoma epatocellulare primario o di un carcinoma metastatico.40x
Figura 29
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aspirato di carcinoma epatocellulare in cui le cellule tumorali sono scarsamente coesive. Poiché i carcinomi epatocellulari sono più scarsamente differenziati, presentano un minor grado di coesione e perdono alcune delle caratteristiche “epatocellulari”. Di conseguenza, spesso è molto difficile determinare se si è in presenza di un carcinoma epatocellulare primario o di un carcinoma metastatico.40x
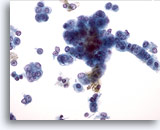
Figura 30
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Epatociti maligni in cui sono osservabili rapporti nucleo/citoplasmatici aumentati e nuclei con pattern della cromatina vescicolare e nucleoli prominenti. La disposizione lineare delle cellule tumorali sulla destra e la forma a colonne lasciano pensare che possa trattarsi anche di una combinazione carcinoma epatocellulare/colangiocarcinoma. 40x
Figura 30
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Epatociti maligni in cui sono osservabili rapporti nucleo/citoplasmatici aumentati e nuclei con pattern della cromatina vescicolare e nucleoli prominenti. La disposizione lineare delle cellule tumorali sulla destra e la forma a colonne lasciano pensare che possa trattarsi anche di una combinazione carcinoma epatocellulare/colangiocarcinoma.40x
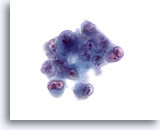
Figura 31
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aspirato di un carcinoma epatocellulare scarsamente differenziato in cui sono presenti cellule vistosamente atipiche con elevati rapporti nucleo/citoplasmatici , binucleazione o multinucleazione e aggregati irregolari di cromatina con nucleoli irregolari prominenti.60x
Figura 31
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aspirato di un carcinoma epatocellulare scarsamente differenziato in cui sono presenti cellule vistosamente atipiche con elevati rapporti nucleo/citoplasmatici , binucleazione o multinucleazione e aggregati irregolari di cromatina con nucleoli irregolari prominenti.60x
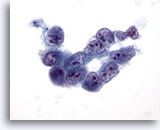
Figura 32
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aspirato di un carcinoma epatocellulare scarsamente differenziato in cui un gruppo di cellule maligne scarsamente coeso mostra rapporti nucleo/citoplasmatici estremamente elevati, irregolarità dei nuclei e della distribuzione della cromatina con nucleoli multipli. 60x
Figura 32
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aspirato di un carcinoma epatocellulare scarsamente differenziato in cui un gruppo di cellule maligne scarsamente coeso mostra rapporti nucleo/citoplasmatici estremamente elevati, irregolarità dei nuclei e della distribuzione della cromatina con nucleoli multipli.60x
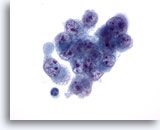
Figura 33
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aspirato di un carcinoma epatocellulare scarsamente differenziato che presenta cellule maligne con variazione della dimensione e della forma e nuclei irregolari con distribuzione non uniforme della cromatina e nucleoli multipli.60x
Figura 33
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aspirato di un carcinoma epatocellulare scarsamente differenziato che presenta cellule maligne con variazione della dimensione e della forma e nuclei irregolari con distribuzione non uniforme della cromatina e nucleoli multipli.60x
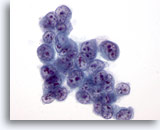
Figura 34
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aspirato di un carcinoma epatocellulare in cui le cellule tumorali sono caratterizzate da rapporti nucleo/citoplasmatici estremamente elevati.60x
Figura 34
Aspirazione con ago sottile del fegato, carcinoma epatocellulare.
Aspirato di un carcinoma epatocellulare in cui le cellule tumorali sono caratterizzate da rapporti nucleo/citoplasmatici estremamente elevati.60x
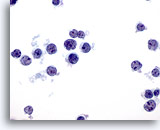
Figura 35
Aspirazione con ago sottile del fegato – Linfoma
In questa diapositiva sono presenti cellule linfoidi atipiche che mostrano la loro natura dissociativa. È possibile notare la presenza di rapporti nucleari/citoplasmici elevati con irregolarità nucleare e nucleoli piccoli ma prominenti.60x
Figura 35
Aspirazione con ago sottile del fegato – Linfoma
In questa diapositiva sono presenti cellule linfoidi atipiche che mostrano la loro natura dissociativa. È possibile notare la presenza di rapporti nucleari/citoplasmici elevati con irregolarità nucleare e nucleoli piccoli ma prominenti.60x
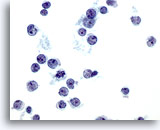
Figura 36
Aspirazione con ago sottile del fegato – Linfoma.
Aspirato di un linfoma non-Hodgkin in cui le cellule tumorali sono singole e sparse e mostrano rapporti nucleo/citoplasmatici elevati con irregolarità nucleari come fenditure e protuberanze. Alcune cellule tumorali presentano nucleoli piccoli ma prominenti. 60x
Figura 36
Aspirazione con ago sottile del fegato – Linfoma
Aspirato di un linfoma non-Hodgkin in cui le cellule tumorali sono singole e sparse e mostrano rapporti nucleo/citoplasmatici elevati con irregolarità nucleari come fenditure e protuberanze. Alcune cellule tumorali presentano nucleoli piccoli ma prominenti.60x
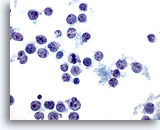
Figura 37
Aspirazione con ago sottile del fegato – Linfoma
Aspirato di un linfoma non-Hodgkin in cui sono visibili cellule linfoidi maligne singole e sparse che presentano nuclei ovali o irregolari con fenditure e protuberanze e membrane nucleari irregolari.60x
Figura 37
Aspirazione con ago sottile del fegato – Linfoma
Aspirato di un linfoma non-Hodgkin in cui sono visibili cellule linfoidi maligne singole e sparse che presentano nuclei ovali o irregolari con fenditure e protuberanze e membrane nucleari irregolari.60x
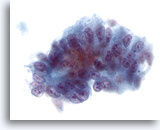
Figura 38
Aspirazione con ago sottile del fegato, adenocarcinoma metastatico.
Adenocarcinoma metastatico del fegato costituito da cellule colonnari atipiche con una significativa pseudostratificazione dei nuclei. I nuclei sono ovali con nucleoli multipli e irregolarità nucleare.40x
Figura 38
Aspirazione con ago sottile del fegato, adenocarcinoma metastatico.
Adenocarcinoma metastatico del fegato costituito da cellule colonnari atipiche con una significativa pseudostratificazione dei nuclei. I nuclei sono ovali con nucleoli multipli e irregolarità nucleare.40x
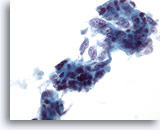
Figura 39
Aspirazione con ago sottile del fegato, adenocarcinoma metastatico.
AAggregati disgiunti riconducibili a un adenocarcinoma metastatico in cui numerose cellule tumorali presentano aspetto colonnare e nuclei vescicolari allungati e nucleoli prominenti multipli.40x
Figura 39
Aspirazione con ago sottile del fegato, adenocarcinoma metastatico.
AAggregati disgiunti riconducibili a un adenocarcinoma metastatico in cui numerose cellule tumorali presentano aspetto colonnare e nuclei vescicolari allungati e nucleoli prominenti multipli.40x
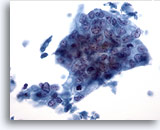
Figura 40
Aspirazione con ago sottile del fegato, adenocarcinoma metastatico.
Adenocarcinoma scarsamente differenziato in cui le cellule tumorali mostrano disposizione sinciziale, con un’evidente perdita di polarità dei nuclei. Le cellule tumorali presentano un’evidente variazione della dimensione e della forma dei nuclei.40x
Figura 40
Aspirazione con ago sottile del fegato, adenocarcinoma metastatico.
Adenocarcinoma scarsamente differenziato in cui le cellule tumorali mostrano disposizione sinciziale, con un’evidente perdita di polarità dei nuclei. Le cellule tumorali presentano un’evidente variazione della dimensione e della forma dei nuclei.40x
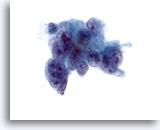
Figura 41
Aspirazione con ago sottile del fegato, adenocarcinoma metastatico.
Aspirato di un adenocarcinoma metastatico in cui le cellule maligne scarsamente differenziate mostrano una significativa variazione della dimensione e della forma dei nuclei. È rilevabile anche una multinucleazione. Si nota una distribuzione irregolare della cromatina con uno o più nucleoli prominenti. Le cellule tumorali presentano citoplasma fine. 60x
Figura 41
Aspirazione con ago sottile del fegato, adenocarcinoma metastatico.
Aspirato di un adenocarcinoma metastatico in cui le cellule maligne scarsamente differenziate mostrano una significativa variazione della dimensione e della forma dei nuclei. È rilevabile anche una multinucleazione. Si nota una distribuzione irregolare della cromatina con uno o più nucleoli prominenti. Le cellule tumorali presentano citoplasma fine.60x
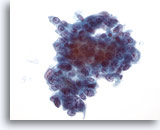
Figura 42
Aspirazione con ago sottile del fegato, adenocarcinoma metastatico.
Aspirato di un adenocarcinoma metastatico in cui la forma delle cellule tumorali varia da cubica a colonnare. I nuclei mostrano alcune alterazioni in termini di forma e dimensione e sono caratterizzati da una distribuzione vescicolare della cromatina con nucleoli prominenti.40x
Figura 42
Aspirazione con ago sottile del fegato, adenocarcinoma metastatico.
Aspirato di un adenocarcinoma metastatico in cui la forma delle cellule tumorali varia da cubica a colonnare. I nuclei mostrano alcune alterazioni in termini di forma e dimensione e sono caratterizzati da una distribuzione vescicolare della cromatina con nucleoli prominenti.40x
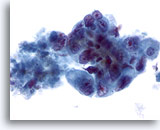
Figura 43
Aspirazione con ago sottile del fegato, adenocarcinoma metastatico.
Cellule maligne scarsamente differenziate che mostrano una significativa variazione della dimensione e della forma del nucleo, distribuzione irregolare della cromatina e nucleoli prominenti.40x
Figura 43
Aspirazione con ago sottile del fegato, adenocarcinoma metastatico.
Cellule maligne scarsamente differenziate che mostrano una significativa variazione della dimensione e della forma del nucleo, distribuzione irregolare della cromatina e nucleoli prominenti.40x
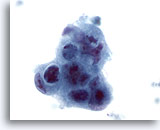
Figura 44
Aspirazione con ago sottile del fegato, adenocarcinoma metastatico.
Cellule maligne scarsamente differenziate in cui è possibile notare un sinciziale e una perdita di polarità. Sono presenti una evidente irregolarità dei nuclei, ipercromasia e nucleoli irregolari.60x
Figura 44
Aspirazione con ago sottile del fegato, adenocarcinoma metastatico.
Cellule maligne scarsamente differenziate in cui è possibile notare un sinciziale e una perdita di polarità. Sono presenti una evidente irregolarità dei nuclei, ipercromasia e nucleoli irregolari.60x
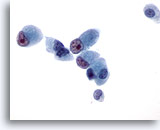
Figura 45
Aspirazione con ago sottile del fegato, colangiocarcinoma metastatico.
Le cellule maligne hanno forme cubiche o colonnari con nuclei eccentrici e nucleoli irregolari prominenti.60x
Figura 45
Aspirazione con ago sottile del fegato, colangiocarcinoma metastatico.
Le cellule maligne hanno forme cubiche o colonnari con nuclei eccentrici e nucleoli irregolari prominenti.60x
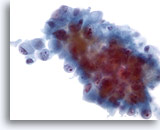
Figura 46
Aspirazione con ago sottile del fegato, colangiocarcinoma metastatico.
Aspirato di un colangiocarcinoma metastatico in cui la forma delle cellule tumorali varia da ovale a colonnare. Le cellule tumorali presentano nuclei eccentrici. È possibile notare irregolarità nucleare, distribuzione non uniforme della cromatina e nucleoli prominenti. Intorno è presente citoplasma fine anfipatico. 40x
Figura 46
Aspirazione con ago sottile del fegato, colangiocarcinoma metastatico.
Aspirato di un colangiocarcinoma metastatico in cui la forma delle cellule tumorali varia da ovale a colonnare. Le cellule tumorali presentano nuclei eccentrici. È possibile notare irregolarità nucleare, distribuzione non uniforme della cromatina e nucleoli prominenti. Intorno è presente citoplasma fine anfipatico.40x
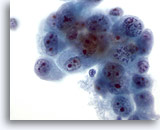
Figura 47
Aspirazione con ago sottile del fegato, colangiocarcinoma metastatico.
Aspirato di un colangiocarcinoma metastatico con cellule maligne ovali o di forma irregolare che presentano cromatina addensata distribuita in modo irregolare. Le cellule tumorali contengono nucleoli multipli. Intorno è presente citoplasma fine anfipatico. 60x
Figura 47
Aspirazione con ago sottile del fegato, colangiocarcinoma metastatico.
Aspirato di un colangiocarcinoma metastatico con cellule maligne ovali o di forma irregolare che presentano cromatina addensata distribuita in modo irregolare. Le cellule tumorali contengono nucleoli multipli. Intorno è presente citoplasma fine anfipatico.60x
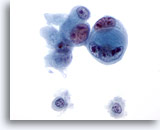
Figura 48
Aspirazione con ago sottile del fegato, colangiocarcinoma metastatico.
Adenocarcinoma scarsamente differenziato in cui si nota una disposizione a “cellula in cellula”. Sono presenti un’evidente variazione della dimensione e della forma dei nuclei e nucleoli multipli irregolari.60x
Figura 48
Aspirazione con ago sottile del fegato, colangiocarcinoma metastatico.
Adenocarcinoma scarsamente differenziato in cui si nota una disposizione a “cellula in cellula”. Sono presenti un’evidente variazione della dimensione e della forma dei nuclei e nucleoli multipli irregolari.60x
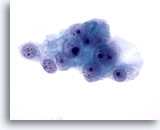
Figura 49
Aspirazione con ago sottile del fegato, carcinoma a cellule renali metastatico.
Le cellule maligne presentano nuclei tondi con nucleoli multipli e citoplasma fine pallido con bordi sfilacciati.60x
Figura 49
Aspirazione con ago sottile del fegato, carcinoma a cellule renali metastatico.
Le cellule maligne presentano nuclei tondi con nucleoli multipli e citoplasma fine pallido con bordi sfilacciati.60x
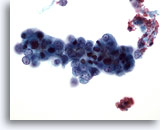
Figura 50
Aspirazione con ago sottile del fegato, adenocarcinoma endometriale metastatico.
Aspirato di un carcinoma endometriale metastatico in cui sono presenti cellule maligne relativamente piccole con rapporti nucleo/citoplasmatici estremamente elevati.40x
Figura 50
Aspirazione con ago sottile del fegato, adenocarcinoma endometriale metastatico.
Aspirato di un carcinoma endometriale metastatico in cui sono presenti cellule maligne relativamente piccole con rapporti nucleo/citoplasmatici estremamente elevati.40x
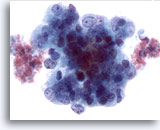
Figura 51
Aspirazione con ago sottile del fegato, adenocarcinoma endometriale metastatico.
Aspirato di un adenocarcinoma endometriale metastatico del fegato in cui le cellule tumorali mostrano un’evidente variazione della dimensione e della forma dei nuclei. Le cellule tumorali sono caratterizzate da cromatina irregolare e nucleoli prominenti.60x
Figura 51
Aspirazione con ago sottile del fegato, adenocarcinoma endometriale metastatico.
Aspirato di un adenocarcinoma endometriale metastatico del fegato in cui le cellule tumorali mostrano un’evidente variazione della dimensione e della forma dei nuclei. Le cellule tumorali sono caratterizzate da cromatina irregolare e nucleoli prominenti.60x
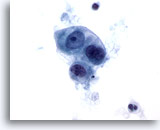
Figura 52
Carcinoma cecale metastatico
Adenocarcinoma metastatico del cieco in cui è visibile un aggregato disgiunto di cellule maligne di forma cubica o ovale. È possibile notare una variazione della dimensione e della forma dei nuclei.60x
Figura 52
Carcinoma cecale metastatico
Adenocarcinoma metastatico del cieco in cui è visibile un aggregato disgiunto di cellule maligne di forma cubica o ovale. È possibile notare una variazione della dimensione e della forma dei nuclei.60x
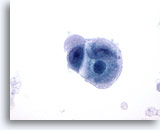
Figura 53
Carcinoma cecale metastatico
Aspirazione con ago sottile di un carcinoma metastatico scarsamente differenziato del cieco in cui le cellule tumorali mostrano una variazione della dimensione e della forma dei nuclei. Il citoplasma circostante ha un aspetto anfipatico a “bolle”.60x
Figura 53
Carcinoma cecale metastatico
Aspirazione con ago sottile di un carcinoma metastatico scarsamente differenziato del cieco in cui le cellule tumorali mostrano una variazione della dimensione e della forma dei nuclei. Il citoplasma circostante ha un aspetto anfipatico a “bolle”.60x
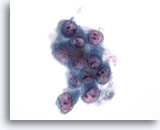
Figura 54: Aspirazione con ago sottile del fegato, carcinoma polmonare metastatico.
Aspirazione con ago sottile di un adenocarcinoma polmonare metastatico del fegato in cui un aggregato disgiunto di cellule maligne mostra una variazione evidente della forma dei nuclei. Sono osservabili rapporti nucleo/citoplasmatici elevati. Le singole cellule tumorali presentano un nucleo eccentrico circondato da citoplasma anfipatico.60x
Figura 54
Aspirazione con ago sottile del fegato, carcinoma polmonare metastatico.
Aspirazione con ago sottile di un adenocarcinoma polmonare metastatico del fegato in cui un aggregato disgiunto di cellule maligne mostra una variazione evidente della forma dei nuclei. Sono osservabili rapporti nucleo/citoplasmatici elevati. Le singole cellule tumorali presentano un nucleo eccentrico circondato da citoplasma anfipatico.60x
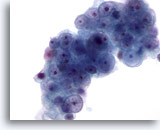
Figura 55
Aspirazione con ago sottile del fegato, carcinoma a cellule renali metastatico del fegato.
Carcinoma a cellule renali metastatico del fegato in cui le cellule tumorali presentano nuclei tondi di varie dimensioni con lievi irregolarità della membrana. I nuclei contengono nucleoli piccoli e prominenti. Intorno si nota citoplasma pallido.60x
Figura 55
Aspirazione con ago sottile del fegato, carcinoma a cellule renali metastatico del fegato.
Carcinoma a cellule renali metastatico del fegato in cui le cellule tumorali presentano nuclei tondi di varie dimensioni con lievi irregolarità della membrana. I nuclei contengono nucleoli piccoli e prominenti. Intorno si nota citoplasma pallido.60x
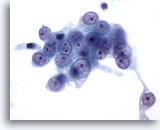
Figura 56
Aspirazione con ago sottile del fegato, carcinoma a cellule renali metastatico del fegato.
Aspirazione con ago sottile di un carcinoma a cellule renali metastatico in cui le cellule maligne presentano nuclei tondi con pattern della cromatina vescicolare e uno o più nucleoli prominenti. È possibile notare il citoplasma pallido con bordi sfilacciati. 60x
Figura 56
Aspirazione con ago sottile del fegato, carcinoma a cellule renali metastatico del fegato.
Aspirazione con ago sottile di un carcinoma a cellule renali metastatico in cui le cellule maligne presentano nuclei tondi con pattern della cromatina vescicolare e uno o più nucleoli prominenti. È possibile notare il citoplasma pallido con bordi sfilacciati.60x
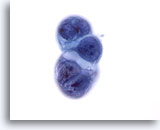
Figura 57
Aspirazione con ago sottile del fegato, carcinoma pancreatico metastatico.
Aggregato di cellule di un carcinoma duttale pancreatico metastatico al fegato. Sono presenti rapporti nucleo/citoplasmatici elevati, irregolarità dei nuclei e aggregazione della cromatina. È inoltre possibile notare una vacuolizzazione del citoplasma.60x
Figura 57
Aspirazione con ago sottile del fegato, carcinoma pancreatico metastatico.
Aggregato di cellule di un carcinoma duttale pancreatico metastatico al fegato. Sono presenti rapporti nucleo/citoplasmatici elevati, irregolarità dei nuclei e aggregazione della cromatina. È inoltre possibile notare una vacuolizzazione del citoplasma.60x
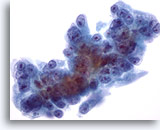
Figura 58
Aspirazione con ago sottile del fegato, carcinoma pancreatico metastatico.
Carcinoma pancreatico metastatico al fegato in cui le cellule maligne mostrano un’evidente variazione della dimensione e della forma dei nuclei. Sono visibili nucleoli eccentrici circondati da citoplasma fine anfipatico.60x
Figura 58
Aspirazione con ago sottile del fegato, carcinoma pancreatico metastatico.
Carcinoma pancreatico metastatico al fegato in cui le cellule maligne mostrano un’evidente variazione della dimensione e della forma dei nuclei. Sono visibili nucleoli eccentrici circondati da citoplasma fine anfipatico.60x
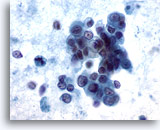
Figura 59
Aspirazione con ago sottile del fegato, carcinoma pancreatico metastatico.
Aggregati disgiunti di cellule maligne con citoplasma pallido e vacuolato e nuclei eccentrici. È possibile notare un’evidente variazione della dimensione e della forma dei nuclei. Accanto ai gruppi scarsamente coesi, sono presenti cellule tumorali singole. Sul fondo è visibile una significativa diatesi tumorale. 60x
Figura 59
Aspirazione con ago sottile del fegato, carcinoma pancreatico metastatico.
Aggregati disgiunti di cellule maligne con citoplasma pallido e vacuolato e nuclei eccentrici. È possibile notare un’evidente variazione della dimensione e della forma dei nuclei. Accanto ai gruppi scarsamente coesi, sono presenti cellule tumorali singole. Sul fondo è visibile una significativa diatesi tumorale.60x
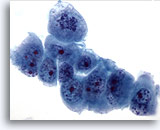
Figura 60
Aspirazione con ago sottile del fegato, carcinoma pancreatico metastatico.
Cellule maligne scarsamente differenziate caratterizzate da un’evidente variazione della dimensione e della forma dei nuclei. È possibile notare distribuzione non uniforme della cromatina e nucleoli prominenti.60x
Figura 60
Aspirazione con ago sottile del fegato, carcinoma pancreatico metastatico.
Cellule maligne scarsamente differenziate caratterizzate da un’evidente variazione della dimensione e della forma dei nuclei. È possibile notare distribuzione non uniforme della cromatina e nucleoli prominenti.60x
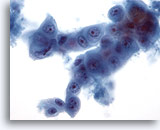
Figura 61
Aspirazione con ago sottile del fegato, carcinoma pancreatico metastatico.
Aspirato di un carcinoma pancreatico metastatico che contiene cellule ovali o cuboidi e una disposizione a “cellula in cellula”. È possibile notare un’evidente variazione della dimensione e della forma dei nuclei.40x
Figura 61
Aspirazione con ago sottile del fegato, carcinoma pancreatico metastatico.
Aspirato di un carcinoma pancreatico metastatico che contiene cellule ovali o cuboidi e una disposizione a “cellula in cellula”. È possibile notare un’evidente variazione della dimensione e della forma dei nuclei.40x
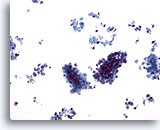
Figura 62
Aspirazione con ago sottile del fegato, carcinoma a piccole cellule metastatico.
Sono presenti aggregati di piccole cellule maligne e cellule tumorali singole e sparse. Come avviene in genere in questi casi, le cellule maligne sono di piccole dimensioni e i rapporti nucleo/citoplasmatici sono elevati.20x
Figura 62
Aspirazione con ago sottile del fegato, carcinoma a piccole cellule metastatico.
Sono presenti aggregati di piccole cellule maligne e cellule tumorali singole e sparse. Come avviene in genere in questi casi, le cellule maligne sono di piccole dimensioni e i rapporti nucleo/citoplasmatici sono elevati.20x
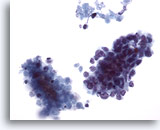
Figura 63
Aspirazione con ago sottile del fegato, carcinoma a piccole cellule metastatico.
Aggregati di cellule di un carcinoma a piccole cellule metastatico del polmone in cui le piccole cellule maligne sono caratterizzate da rapporti nucleo/citoplasmatici elevati. Sono visibili nuclei ipercromici senza nucleoli prominenti. È possibile notare materiale necrotico accanto all’aggregato maligno.40x
Figura 63
Aspirazione con ago sottile del fegato, carcinoma a piccole cellule metastatico.
Aggregati di cellule di un carcinoma a piccole cellule metastatico del polmone in cui le piccole cellule maligne sono caratterizzate da rapporti nucleo/citoplasmatici elevati. Sono visibili nuclei ipercromici senza nucleoli prominenti. È possibile notare materiale necrotico accanto all’aggregato maligno.40x
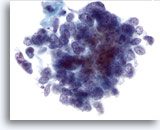
Figura 64
Aspirazione con ago sottile del fegato, carcinoma a piccole cellule metastatico.
È possibile notare una distribuzione uniforme della cromatina e l’assenza di nucleoli prominenti tipica del carcinoma a piccole cellule, oltre ai rapporti nucleo/citoplasmatici elevati.60x
Figura 64
Aspirazione con ago sottile del fegato, carcinoma a piccole cellule metastatico.
È possibile notare una distribuzione uniforme della cromatina e l’assenza di nucleoli prominenti tipica del carcinoma a piccole cellule, oltre ai rapporti nucleo/citoplasmatici elevati.60x
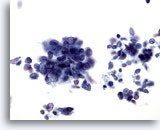
Figura 65
Aspirazione con ago sottile del fegato, carcinoma a piccole cellule metastatico.
Aspirato di un carcinoma a piccole cellule metastatico del polmone in cui sono visibili aggregati disgiunti di piccole cellule maligne con rapporti nucleo/citoplasmatici elevati. Nella maggior parte dei casi, non sono osservabili nucleoli. Si nota invece un pattern della cromatina finemente distribuito. 40x
Figura 65
Aspirazione con ago sottile del fegato, carcinoma a piccole cellule metastatico.
Aspirato di un carcinoma a piccole cellule metastatico del polmone in cui sono visibili aggregati disgiunti di piccole cellule maligne con rapporti nucleo/citoplasmatici elevati. Nella maggior parte dei casi, non sono osservabili nucleoli. Si nota invece un pattern della cromatina finemente distribuito.40x
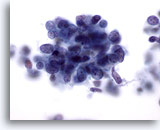
Figura 66
Aspirazione con ago sottile del fegato, carcinoma a piccole cellule metastatico.
Ingrandimento ad alta potenza di un carcinoma a piccole cellule metastatico del polmone in cui le cellule maligne presentano rapporti nucleo/citoplasmatici elevati con cromatina finemente granulare e uniformemente distribuita e assenza di nucleoli.60x
Figura 66
Aspirazione con ago sottile del fegato, carcinoma a piccole cellule metastatico.
Ingrandimento ad alta potenza di un carcinoma a piccole cellule metastatico del polmone in cui le cellule maligne presentano rapporti nucleo/citoplasmatici elevati con cromatina finemente granulare e uniformemente distribuita e assenza di nucleoli.60x
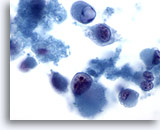
Figura 67
Aspirazione con ago sottile del fegato – Melanoma metastatico
Striscio disaggregato in cui sono visibili cellule spiccatamente atipiche con fenotipo rabdoide. Il fenotipo rabdoide è caratterizzato da grandi globuli intracitoplasmatici e da nuclei con nucleoli prominenti.60x
Figura 67
Aspirazione con ago sottile del fegato – Melanoma metastatico
Striscio disaggregato in cui sono visibili cellule spiccatamente atipiche con fenotipo rabdoide. Il fenotipo rabdoide è caratterizzato da grandi globuli intracitoplasmatici e da nuclei con nucleoli prominenti.60x
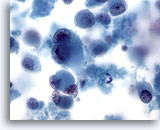
Figura 68
Aspirazione con ago sottile del fegato – Melanoma metastatico.
Aspirato di un melanoma metastatico del fegato in cui sono visibili cellule maligne singole e sparse, alcune delle quali presentano la tipica binucleazione con nucleoli prominenti. Come avviene in alcuni melanomi metastatici, è possibile notare una quantità moderata di citoplasma.60x
Figura 68
Aspirazione con ago sottile del fegato – Melanoma metastatico
Aspirato di un melanoma metastatico del fegato in cui sono visibili cellule maligne singole e sparse, alcune delle quali presentano la tipica binucleazione con nucleoli prominenti. Come avviene in alcuni melanomi metastatici, è possibile notare una quantità moderata di citoplasma.60x
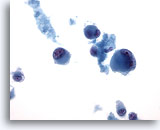
Figura 69
Aspirazione con ago sottile del fegato – Melanoma metastatico
Aspirato di un melanoma maligno metastatico del fegato in cui sono visibili cellule tumorali singole e sparse dalla forma bizzarra, alcune delle quali presentano binucleazione.40x
Figura 69
Aspirazione con ago sottile del fegato – Melanoma metastatico
Aspirato di un melanoma maligno metastatico del fegato in cui sono visibili cellule tumorali singole e sparse dalla forma bizzarra, alcune delle quali presentano binucleazione.40x
Pancreas
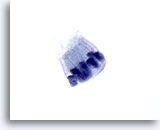
Figura 70
Aspirazione con ago sottile del pancreas, cellule duttali benigne.
È possibile notare le cellule a forma colonnare disposte a palizzata. I rapporti nucleo/citoplasmatici rimangono bassi. I nuclei sono ovali e circondati da citoplasma pallido anfipatico.60x
Figura 70
Aspirazione con ago sottile del pancreas, cellule duttali benigne.
È possibile notare le cellule a forma colonnare disposte a palizzata. I rapporti nucleo/citoplasmatici rimangono bassi. I nuclei sono ovali e circondati da citoplasma pallido anfipatico.60x
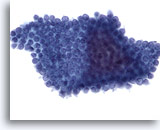
Figura 71
Aspirazione con ago sottile del pancreas, cellule duttali benigne.
Aspirato di cellule duttali benigne del pancreas in cui le cellule hanno una disposizione a nido d’ape con nuclei distribuiti in modo uniforme.40x
Figura 71
Aspirazione con ago sottile del pancreas, cellule duttali benigne.
Aspirato di cellule duttali benigne del pancreas in cui le cellule hanno una disposizione a nido d’ape con nuclei distribuiti in modo uniforme.40x
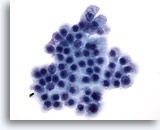
Figura 72
Aspirazione con ago sottile del pancreas, cellule duttali benigne.
Le cellule duttali benigne di questo aspirato hanno una disposizione a nido d’ape e hanno un aspetto uniforme con nuclei tondi e bordi ben definiti.60x
Figura 72
Aspirazione con ago sottile del pancreas, cellule duttali benigne.
Le cellule duttali benigne di questo aspirato hanno una disposizione a nido d’ape e hanno un aspetto uniforme con nuclei tondi e bordi ben definiti.60x

Figura 73
Aspirazione con ago sottile del pancreas – Muscolo scheletrico
È presente un frammento di muscolo scheletrico, inavvertitamente prelevato durante un’aspirazione percutanea del pancreas. Sono visibili nuclei fusiformi dall’aspetto regolare.40x
Figura 73
Aspirazione con ago sottile del pancreas – Muscolo scheletrico
È presente un frammento di muscolo scheletrico, inavvertitamente prelevato durante un’aspirazione percutanea del pancreas. Sono visibili nuclei fusiformi dall’aspetto regolare.40x
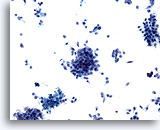
Figura 74
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Aspirato di un adenocarcinoma pancreatico costituito da aggregati disgiunti di cellule maligne e da numerose cellule atipiche singole e sparse.20x
Figura 74
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Aspirato di un adenocarcinoma pancreatico costituito da aggregati disgiunti di cellule maligne e da numerose cellule atipiche singole e sparse.20x
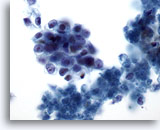
Figura 75
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Aspirato di un adenocarcinoma pancreatico in cui sono visibili aggregati disgiunti di cellule maligne con forma ovale e rapporti nucleo/citoplasmatici elevati. Sul fondo sono presenti alcuni frammenti necrotici.60x
Figura 75
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Aspirato di un adenocarcinoma pancreatico in cui sono visibili aggregati disgiunti di cellule maligne con forma ovale e rapporti nucleo/citoplasmatici elevati. Sul fondo sono presenti alcuni frammenti necrotici.60x
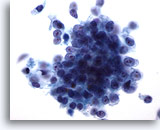
Figura 76
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Ingrandimento ad alta potenza di un carcinoma duttale pancreatico costituito da un aggregato disgiunto di cellule maligne disposte a sincizio e da cellule maligne singole e sparse. La forma delle cellule varia da cubica a colonnare. I rapporti nucleo/citoplasmatici sono elevati. 60x
Figura 76
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Ingrandimento ad alta potenza di un carcinoma duttale pancreatico costituito da un aggregato disgiunto di cellule maligne disposte a sincizio e da cellule maligne singole e sparse. La forma delle cellule varia da cubica a colonnare. I rapporti nucleo/citoplasmatici sono elevati.60x
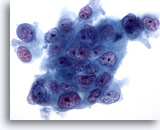
Figura 77
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Ingrandimento ad alta potenza di adenocarcinomi duttali pancreatici moderatamente differenziati costituiti da cellule tumorali con aspetto sinciziale caratterizzate da una grande variabilità di dimensioni e forme. Vi sono tracce di perdita di polarità. I nuclei sono ipercromici con nucleoli multipli irregolari. 60x
Figura 77
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Ingrandimento ad alta potenza di adenocarcinomi duttali pancreatici moderatamente differenziati costituiti da cellule tumorali con aspetto sinciziale caratterizzate da una grande variabilità di dimensioni e forme. Vi sono tracce di perdita di polarità. I nuclei sono ipercromici con nucleoli multipli irregolari.60x
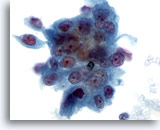
Figura 78
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Aspirato di un carcinoma pancreatico moderatamente differenziato in cui è presente un aggregato sinciziale di cellule maligne con una notevole variazione della dimensione e della forma dei nuclei.60x
Figura 78
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Aspirato di un carcinoma pancreatico moderatamente differenziato in cui è presente un aggregato sinciziale di cellule maligne con una notevole variazione della dimensione e della forma dei nuclei.60x
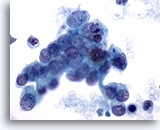
Figura 79
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Cellule maligne singole e sparse ed aggregati disgiunti di tali cellule nell’aspirato di un carcinoma duttale pancreatico. Le cellule tumorali sono caratterizzate da una notevole variazione della dimensione e della forma dei nuclei. Numerose cellule tumorali hanno rapporti nucleo/citoplasmatici elevati e cromatina irregolare. 60x
Figura 79
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Cellule maligne singole e sparse ed aggregati disgiunti di tali cellule nell’aspirato di un carcinoma duttale pancreatico. Le cellule tumorali sono caratterizzate da una notevole variazione della dimensione e della forma dei nuclei. Numerose cellule tumorali hanno rapporti nucleo/citoplasmatici elevati e cromatina irregolare.60x
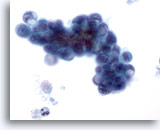
Figura 80
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Aspirato di un carcinoma duttale pancreatico in cui sono visibili cellule maligne di forma ovale e alcune cellule ad “anello con castone”. I grandi vacuoli presenti nel citoplasma hanno provocato uno spostamento e una deformazione dei nuclei.60x
Figura 80
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Aspirato di un carcinoma duttale pancreatico in cui sono visibili cellule maligne di forma ovale e alcune cellule ad “anello con castone”. I grandi vacuoli presenti nel citoplasma hanno provocato uno spostamento e una deformazione dei nuclei.60x
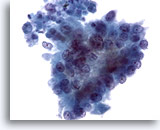
Figura 81
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Aspirato di un adenocarcinoma pancreatico con cellule tumorali colonnari. Si osserva un’evidente variazione della dimensione e della forma dei nuclei e la perdita della polarità.40x
Figura 81
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Aspirato di un adenocarcinoma pancreatico con cellule tumorali colonnari. Si osserva un’evidente variazione della dimensione e della forma dei nuclei e la perdita della polarità.40x
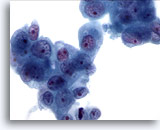
Figura 82
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Aggregati disgiunti di cellule maligne caratterizzate da nuclei più grandi del normale con cromatina irregolare e nucleoli prominenti. È possibile notare la presenza di citoplasma anfipatico o leggermente vacuolato.60x
Figura 82
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Aggregati disgiunti di cellule maligne caratterizzate da nuclei più grandi del normale con cromatina irregolare e nucleoli prominenti. È possibile notare la presenza di citoplasma anfipatico o leggermente vacuolato.60x
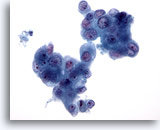
Figura 83
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Aspirato di un adenocarcinoma pancreatico in cui sono presenti aggregati di cellule maligne caratterizzati da notevole variazione della dimensione dei nuclei. Sono visibili sporadiche cellule binucleate.40x
Figura 83
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Aspirato di un adenocarcinoma pancreatico in cui sono presenti aggregati di cellule maligne caratterizzati da notevole variazione della dimensione dei nuclei. Sono visibili sporadiche cellule binucleate.40x
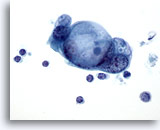
Figura 84
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Un aggregato di cellule maligne con grandi vacuoli intracitoplasmatici caratterizzati da presenza tipica digocce di mucina.60x
Figura 84
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Un aggregato di cellule maligne con grandi vacuoli intracitoplasmatici caratterizzati da presenza tipica digocce di mucina.60x
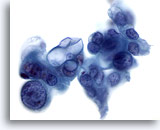
Figura 85
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Aspirato di un adenocarcinoma scarsamente differenziato in cui le cellule tumorali hanno una forma bizzarra e mostrano una significativa variazione della dimensione e della forma dei nuclei. Inoltre, alcune cellule tumorali presentano grandi vacuoli intracitoplasmatici. 60x
Figura 85
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Aspirato di un adenocarcinoma scarsamente differenziato in cui le cellule tumorali hanno una forma bizzarra e mostrano una significativa variazione della dimensione e della forma dei nuclei. Inoltre, alcune cellule tumorali presentano grandi vacuoli intracitoplasmatici.60x
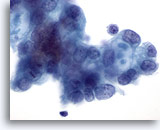
Figura 86
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Cellule maligne con alcuni vacuoli tipici contenenti mucina.60x
Figura 86
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Cellule maligne con alcuni vacuoli tipici contenenti mucina.60x
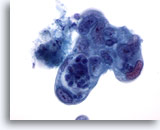
Figura 87
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Adenocarcinoma pancreatico scarsamente differenziato che presenta un pleomorfismo delle cellule con un’evidente variazione della dimensione e della forma dei nuclei e rapporti nucleo/citoplasmatici elevati.60x
Figura 87
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Adenocarcinoma pancreatico scarsamente differenziato che presenta un pleomorfismo delle cellule con un’evidente variazione della dimensione e della forma dei nuclei e rapporti nucleo/citoplasmatici elevati.60x
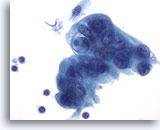
Figura 88
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Cellule maligne scarsamente differenziate, alcune delle quali hanno aspetto sinciziale. Le cellule presentano nuclei ipercromici circondati da citoplasma fine anfipatico con bordi sfilacciati. Una delle cellule tumorali contiene un tipico vacuolo contenente mucina. 60x
Figura 88
Aspirazione con ago sottile del pancreas, adenocarcinoma pancreatico.
Cellule maligne scarsamente differenziate, alcune delle quali hanno aspetto sinciziale. Le cellule presentano nuclei ipercromici circondati da citoplasma fine anfipatico con bordi sfilacciati. Una delle cellule tumorali contiene un tipico vacuolo contenente mucina.60x
Torna a inizio pagina
Ritorna alla Indice dei contenuti
























































































