Feinnadelaspirationsbiopsien (FNA-Biopsien) von Leber oder Pankreas gehören in vielen medizinischen Zentren zur Alltagspraxis. Die übliche Indikation für eine Feinnadelaspiration der Leber oder des Pankreas ist die Untersuchung eines Tumors. Früher waren Pathologen eher damit vertraut, durch Stanzbiopsie entnommenes Gewebe von Lebertumoren zu untersuchen, aber inzwischen ist die FNA-Biopsie das Standardverfahren in den meisten Kliniken. Im Gegensatz dazu sind FNA-Biopsien beim Pankreas gebräuchlicher als Stanzbiopsien, die potenziell zu Komplikationen wie einer Pankreatitis führen können. Einer der Vorteile einer FNA-Biopsie von Leber oder Pankreas besteht darin, dass in einem einzigen Verfahren multiple Aspirate entnommen werden können, wodurch eine umfassendere Probenentnahme aus dem Tumor möglich ist.
Gelegentlich wird bei der Untersuchung eines Tumors ein dominanter Zirrhoseknoten aspiriert [1, 2] . Ein wesentliches zytologisches Merkmal eines Zirrhoseknotens ist das eher polymorphe als unimorphe Erscheinungsbild der Leberzellen auf ThinPrep-Objektträgern. Gelegentlich können atypische Merkmale wie Zellkernvergrößerung, Doppelkernigkeit und Anisonukleose erkennbar sein, die einen Zirrhose-Befund unterstützen, da das polymorphe Aussehen der Leberzellenpopulation im Gegensatz zur einheitlichen Atypie beim hepatozellulären Karzinom ein Merkmal benigner, reaktiver Leberzellen ist. Über die variable Zellstruktur der Leberzellen bei Zirrhose hinaus sind dünne Trabekel und höchstens zwei Zellen dicke Stränge zu sehen; die Zellen weisen eine niedrige Kern-Plasma-Relation auf. Es können sowohl vereinzelte Entzündungszellen und Bindegewebsfasern als auch Gallengänge gefunden werden.[1, 2] .
Auf ThinPrep präparierte Aspirate von hepatozellulären Karzinomen weisen Zellen mit einer einheitlich hohen Kern-Plasma-Relation auf, die in komplexen verzweigten, anastomosierenden dicken Trabekeln angeordnet sind und scharf abgegrenzte Ränder aufweisen. Die Trabekel sind mehr als vier Zellen dick, und sind an der Peripherie von Endothelzellen eingeschlossen, ferner sind so genannte ‚eindringende’ Endothelzellen vorhanden. Häufig sind verstreute Einzelzellen und kleine Verbände zu sehen, ferner nackte atypische Zellkerne von Leberzellen. Gelegentlich wird Gallenpigment beobachtet [1, 2, 6, 7, 8, 9, 10, 11, 12, 13] .
Gelegentlich trifft man auf Varianten hepatozellulärer Karzinome wie das fibrolamelläre Leberzellkarzinom, Untertypen kleinzelliger und Klarzell-Karzinome sowie das kombinierte hepatozelluläre Karzinom/Gallengangskarzinom. Die zytologischen Merkmale dieser Varianten sind in der Standardliteratur ausführlich beschrieben. [1, 2]
Aspirate benigner hepatozellulärer Tumore, beispielsweise Adenome und die fokal noduläre Hyperplasie, enthalten Leberzellen, die sich nicht von den Leberzellen im umgebenden unauffälligen Lebergewebe auf ThinPrep-Objektträgern unterscheiden. [1, 2] . Bei der fokal nodulären Hyperplasie sind Fragmente von Bindegewebe und Gallengängen vorhanden, die bei Adenomen dagegen fehlen.
Da Atypiekriterien fehelen, ist die exakte Diagnostik von Adenomen oder der fokal nodulären Hyperplasie mittels Feinnadelaspiration nicht möglicht. Daher müssen die zytologischen Befunde unbedingt mit der Nadelposition korrelieren.
Schließlich sind Leberaspirate von Karzinommetastasen sehr häufig, da Metastasen im Abdomen, nach den Lymphknoten, am zweithäufigsten in der Leber auftreten. Karzinommetastasen repräsentieren mehr als 90 % aller malignen Leberneoplasien. Die Adenokarzinome sind, unter den die Leber betreffenden Metastasen, histologisch am häufigsten, wobei das kolorektale Karzinom eine hohe Prävalenz hat. Die zytomorphologischen Kriterien einer Adenokarzinommetastase haben große Ähnlichkeit mit denjenigen eines primären Gallengangskarzinom. In der Regel enthalten Feinnadelaspirationspräparate von Adenokarzinomen kohärente Verbände maligner Zellen, bei denen eine Drüsenformation erkennbar sein kann. Die kubischen bis zylindrisch geformten Zellen weisen ein zartes blasses Zytoplasma und exzentrisch gelegene, runde bis unregelmäßige Zellkerne mit prominenten Nukleolen auf. Das kolorektale Karzinom ist häufig mit einer „schmutzigen Nekrose“ im Hintergrund assoziiert, im Gegensatz dazu, der saubere Hintergrund beim Gallengangskarzinom. Darüber hinaus können auch Karzinome anderer Zelltypen vorkommen, darunter Metastasen von kleinzelligen Karzinomen, Melanomen, malignen Lymphomen und von Mesenchymtumoren. [1, 2].
Zur Untersuchung zystischer und solider Pankreastumore werden zunehmend perkutane, intraoperative und endoskopische FNA-Biopsien unter Ultraschallkontrolle eingesetzt [1, 2, 14, 15]. Die FNA hat eindeutige Vorteile gegenüber großen Stanzbiopsien und Pankreas-Keilresektionen, die durch das Ausfließen von exokrinen Enzymen und Galle, potenziell eine Pankreatitis bzw. Peritonitis auslösen können [16]. FNA-Biopsien des Pankreas eignen sich auch für die Diagnostik entzündlicher Pankreasläsionen, indem sie chirurgische Eingriffe überflüssig machen. Daher muss der Zytopathologe mit den zytologischen Merkmalen und dem Spektrum, der im benignen duktualen und azinären Pankreasepithel vorkommenden, Veränderungen vertraut sein [1, 2, 17]. Charakteristischerweise sind die duktalen Pankreaszellen in flachen, bienenwabenförmigen Verbänden mit gleichmäßig verteilten, runden bis ovalen Zellkernen und klar definierten Zellgrenzen angeordnet. Azinuszellen treten gerne in kleinen kohärenten Verbänden auf. Diese bestehen aus Zellen mit mäßig weitem, granulärem Zytoplasma und enthalten kleine, unimorphe, basal angeordnete Zellkerne, die ein feingranuläres bis klumpiges Chromatin und unauffällige Nukleoli besitzen. Inselzellen werden in Aspiraten in der Regel nicht beobachtet [1, 2, 14, 18].
Aspirate von Pseudozysten des Pankreas weisen gewöhnlich eine spärliche Zellularität, mit wenigen oder fehlenden epithelialen Zellen auf, obwohl Entzündungszellen akuter und chronischer Inflammationen, Histiozyten, Granulationsgewebe, Detritus im Hintergrund sowie Kalkfragmente vorhanden sein können [1, 2] . Zu den zytologischen Merkmalen der akuten Pankreatitis gehören mäßiger bis hoher Zellreichtum, wobei in den Ausstrichen vorwiegend neutrophile Granulozyten vorhanden sind sowie mit ein „schmutziger“ Hintergrund [1, 2] . Duktus- bzw. Azinuszellen können reparative bzw. entzündliche Abnormitäten aufweisen, außerdem kann Fettnekrose erkennbar sein.
Im Gegensatz dazu sind die Aspirate bei einer chronischen Pankreatitis im Allgemeinen relativ zellarm und weisen nur wenige Duktuszellen auf, die zumeist nicht die, bei einer akuten Pankreatitis zu beobachtenden, abnormen bzw. reaktiven Merkmale zeigen [1, 2]. Es sind außerdem Entzündungszellen einer chronischen Entzündung vorhanden.
Die zytomorphologischen Merkmale eines Adenokarzinoms des Pankreas dürfen nicht übersehen werden, da es sich hier um ein verbreitetes Malignom handelt, das für etwa 3 % aller Krebsfälle und 5 % der gesamten Krebssterblichkeit verantwortlich ist. [18, 19]. Fast drei Viertel aller Adenokarzinome des Pankreas gehören dem duktalen Typ an. Zytomorphologische Merkmale duktaler Adenokarzinome auf ThinPrep-Objektträgern sind Zellreichtum mit atypischen einzelnen bzw. in Gruppen und Verbänden angeordneten Zellen. [1, 2 2 Innerhalb der Zellverbände ist eine synzytiale Anordnung der Zellen erkennbar, verbunden mit einem Verlust der Kernpolarität. Es kann sowohl eine Zellkernvergrößerung als auch eine Hypertrophie des Zytoplasmas auftreten. Die Zellkerne sind zumeist hyperchromatisch mit ungleichmäßig verteiltem Chromatin und unregelmäßigen Kernmembranen, gelegentlich sind Kernfurchen erkennbar. Erhebliche Anisokaryose sind ebenso zu sehen wie prominente Nukleolen. Im Hintergrund ist in der Regel eine nekrotische Tumordiathese zu erkennen.
Zu den ungewöhnlichen Varianten des Adenokarzinoms des Pankreas gehört das anaplastische Karzinom (pleomorphes Riesenzellkarzinom), das eine auffallend pleomorphe Zellpopulation mit malignen Riesenzellen bzw. spindelförmigen Zellen aufweist, Außerdem der sehr seltene, osteoklastenartige Riesenzelltumor des Pankreas, der sich mit verstreut liegenden, mehrkernigen osteoklastenartigen Riesenzellen darstellt, mit zentralen geclusterten Zellkernen, die von einem mäßig weiten Zytoplasma umgeben sind sowie ähnlich erscheinenden einkernigen Zellen.[1, 2].
Aspirate von Inselzellneoplasien sind meistens zellreich und bestehen aus einer monomorphen Population unimorpher kleiner Zellen, die vorwiegend in einem inkohärenten Muster angeordnet sind. Die Tumorzellen sind klein mit runden bis ovalen Zellkernen, gleichmäßig verteiltem fein- bis grobgranulärem Chromatin und unauffälligen Nukleolen. In diesen Zellen liegen die Zellkerne exzentrisch. Dagegen sind die Zellen in Aspiraten des sehr seltenen Azinuszellenkarzinoms lobulär angeordnet und zeigen hyperchromatische Zellkerne, verklumptes Chromatin und prominente Nukleolen. [1, 2] Sowohl bei Inselzellen als auch bei Azinuszellen ist das Zytoplasma granulär. Zytomorphologische Merkmale papillär-zystischer Tumoren sind papilläre Strukturen mit fibrovaskulären Zentren, die von einer oder mehreren Schichten epthelialer Zellen umgeben sind, die ein blasses Chromatin, zarte Kernmembranen und vereinzelte Kerneinfurchungen in Längsrichtung aufweisen. [1, 2] Muzinös zystische Neoplasien dagegen weisen Zellkerne auf, die von blande, atypisch bis eindeutig maligne variiern können [1, 2] . Die Anordnung der Zellen kann aus Einzelzellen, flachen bienenwabenförmigen Verbänden oder dreidimensionalen Clustern bestehen, die mit einer großen Menge an intrazellulärem bzw. extrazellulärem muzinösem Material assoziiert sind. Aspirate von serösen Zystadenomen und Pankreatoblastomen sind weitere seltene Tumoren, die in der Literatur zur Feinnadelaspiration beschrieben sind. [1, 2, 20] Schließlich können durch FNA-Biopsien noch metastatische Malignome im Pankreas nachgewiesen werden [21]
Erinnerung: Sie können auf jedes Bild klicken, um dieses vergrößert zu betrachten.
Leber
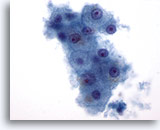
Abbildung 1: Feinnadelaspiration Leber – Benigne Leberzellen.
Kleiner Verband benigner Leberzellen, bei denen es sich um polygonale bis runde Zellen mit gut abgrenzbaren Zellgrenzen und zentralen, von granulärem Zytoplasma umgebenen Zellkernen handelt. Ferner ist eine intrazytoplasmatische Pigmentierung zu erkennen. Obwohl kleine Nukleolen zu sehen sind, liegen keine Anzeichen für eine Atypie oder eine erhöhte Kern-Plasma-Relation vor..
60x
Abbildung 1
Feinnadelaspiration Leber – Benigne Leberzellen
Kleiner Verband benigner Leberzellen, bei denen es sich um polygonale bis runde Zellen mit gut abgrenzbaren Zellgrenzen und zentralen, von granulärem Zytoplasma umgebenen Zellkernen handelt. Ferner ist eine intrazytoplasmatische Pigmentierung zu erkennen. Obwohl kleine Nukleolen zu sehen sind, liegen keine Anzeichen für eine Atypie oder eine erhöhte Kern-Plasma-Relation vor..
60x
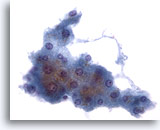
Abbildung 2: Feinnadelaspiration Leber – Benigne Leberzellen.
Cluster benigner, reaktiver Leberzellen, der aus kubischen Zellen mit gut abgrenzbaren Zellgrenzen und vakuolisiertem bis leicht granulärem, opakem Zytoplasma besteht. Bei diesem Verband sind die ausgefransten Ränder zu beachten. Die Zellkerne weisen eine leichte Anisonukleose auf; einzelne doppelkernige Zellen sind zu sehen. Ebenfalls erkennbar sind kleine Nukleolen.
40x
Abbildung 2
Feinnadelaspiration Leber – Benigne Leberzellen
Cluster benigner, reaktiver Leberzellen, der aus kubischen Zellen mit gut abgrenzbaren Zellgrenzen und vakuolisiertem bis leicht granulärem, opakem Zytoplasma besteht. Bei diesem Verband sind die ausgefransten Ränder zu beachten. Die Zellkerne weisen eine leichte Anisonukleose auf; einzelne doppelkernige Zellen sind zu sehen. Ebenfalls erkennbar sind kleine Nukleolen.
40x
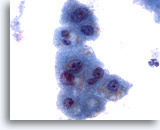
Abbildung 3
Feinnadelaspiration Leber – Benigne Leberzellen
Zu sehen ist die, für reaktive Leberzellen typische, Anisonukleose der Zellkerne und niedrige Kern-Plasma-Relation. Ferner sind Anhaltspunkte für eine schwache Vakuolisierung des Zytoplasmas und intrazytoplasmatisches Pigment vorhanden.
60x
Abbildung 3
Feinnadelaspiration Leber – Benigne Leberzellen
Zu sehen ist die, für reaktive Leberzellen typische, Anisonukleose der Zellkerne und niedrige Kern-Plasma-Relation. Ferner sind Anhaltspunkte für eine schwache Vakuolisierung des Zytoplasmas und intrazytoplasmatisches Pigment vorhanden.
60x
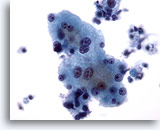
Abbildung 4
Feinnadelaspiration Leber – Benigne Leberzellen
Reaktive Leberzellen, die Anisonukleose sowie Doppelkernigkeit aufweisen. 40x
Abbildung 4
Feinnadelaspiration Leber – Benigne Leberzellen
Reaktive Leberzellen, die Anisonukleose sowie Doppelkernigkeit aufweisen. 40x
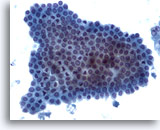
Abbildung 5
Feinnadelaspiration Leber – Benigne Duktuszellen
Bienenwabenförmig angeordneter Zellverband benigner Gallengangszellen mit unimorphen kleinen Zellkernen..
20x
Abbildung 5
Feinnadelaspiration Leber – Benigne Duktuszellen
Bienenwabenförmig angeordneter Zellverband benigner Gallengangszellen mit unimorphen kleinen Zellkernen..
20x
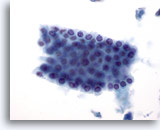
Abbildung 6
Feinnadelaspiration Leber – Benigne Duktuszellen.
Zellverband benigner Gallengangszellen mit Bienenwabenstruktur. Die kubischen Zellen weisen kleine, gleichmäßig verteilte Zellkerne auf. Duktuszellen haben eine höhere Kern-Plasma-Relation als Leberzellen; sie zeigen ferner weder körniges Zytoplasma noch Vakuolisierung bzw. Pigment.
40x
Abbildung 6
Feinnadelaspiration Leber – Benigne Duktuszellen
Zellverband benigner Gallengangszellen mit Bienenwabenstruktur. Die kubischen Zellen weisen kleine, gleichmäßig verteilte Zellkerne auf. Duktuszellen haben eine höhere Kern-Plasma-Relation als Leberzellen; sie zeigen ferner weder körniges Zytoplasma noch Vakuolisierung bzw. Pigment.
40x
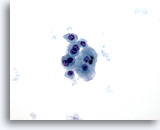
Abbildung 7
Feinnadelaspiration Leber – Zirrhose
Lockerer Verband benigner Leberzellen mit Doppelkernigkeit und niedriger Kern-Plasma-Relation.
40x
Abbildung 7
Feinnadelaspiration Leber – Zirrhose
Lockerer Verband benigner Leberzellen mit Doppelkernigkeit und niedriger Kern-Plasma-Relation.
40x
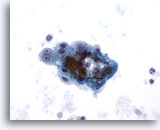
Abbildung 8
Feinnadelaspiration Leber – Zirrhose
Lockerer Verband benigner reaktiver Leberzellen aus einem Zirrhoseknoten. Zu sehen ist Doppelkernigkeit mit prominenten Nukleolen, allerdings bleibt die Kern-Plasma-Relation niedrig.
40x
Abbildung 8
Feinnadelaspiration Leber – Zirrhose
Lockerer Verband benigner reaktiver Leberzellen aus einem Zirrhoseknoten. Zu sehen ist Doppelkernigkeit mit prominenten Nukleolen, allerdings bleibt die Kern-Plasma-Relation niedrig.
40x
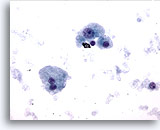
Abbildung 9
Feinnadelaspiration Leber – Zirrhose
Einzelne verstreute liegendebenigne Leberzellen aus einem Zirrhoseknoten. Anisonukleose ist zwar erkennbar, allerdings fehlen Kernunregelmäßigkeiten. Eine doppelkernige Leberzelle ist zu sehen. Die Kern-Plasma-Relation bleibt niedrig.
40x
Abbildung 9
Feinnadelaspiration Leber – Zirrhose
Einzelne verstreute liegendebenigne Leberzellen aus einem Zirrhoseknoten. Anisonukleose ist zwar erkennbar, allerdings fehlen Kernunregelmäßigkeiten. Eine doppelkernige Leberzelle ist zu sehen. Die Kern-Plasma-Relation bleibt niedrig.
40x
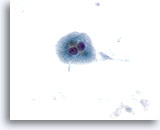
Abbildung 10
Feinnadelaspiration Leber – Zirrhose
Einzelne verstreut liegende, benigne doppelkernige Leberzellen aus einem Zirrhoseknoten. 40x
Abbildung 10
Feinnadelaspiration Leber – Zirrhose
Einzelne verstreut liegende, benigne doppelkernige Leberzellen aus einem Zirrhoseknoten. 40x
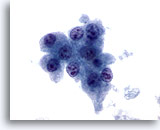
Abbildung 11
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Leberzellen aus einem hepatozellulären Karzinom mit unimorphen Atypien, erhöhter Kern-Plasma-Relation und Zellkernen, die multiple irreguläre Nukleolen aufweisen.
60x
Abbildung 11
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Leberzellen aus einem hepatozellulären Karzinom mit unimorphen Atypien, erhöhter Kern-Plasma-Relation und Zellkernen, die multiple irreguläre Nukleolen aufweisen.
60x
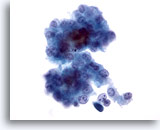
Abbildung 12
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Lockerer Zellverband maligner Leberzellen aus dem Aspirat eines hepatozellulären Karzinoms. Zu sehen sind unimorphe Atypien und eine erhöhte Kern-Plasma-Relation. Zwischen den Leberzellen ist etwas Gallenpigment erkennbar.
40x
Abbildung 12
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Lockerer Zellverband maligner Leberzellen aus dem Aspirat eines hepatozellulären Karzinoms. Zu sehen sind unimorphe Atypien und eine erhöhte Kern-Plasma-Relation. Zwischen den Leberzellen ist etwas Gallenpigment erkennbar.
40x
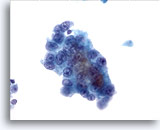
Abbildung 13
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Gut differenziertes hepatozelluläres Karzinom, bei dem die Leberzellen eine erhöhte Kern-Plasma-Relation und unimorphe Atypien aufweisen.
40x
Abbildung 13
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Gut differenziertes hepatozelluläres Karzinom, bei dem die Leberzellen eine erhöhte Kern-Plasma-Relation und unimorphe Atypien aufweisen.
40x
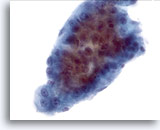
Abbildung 14
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Zellverband aus Zellen eines hepatozellulären Karzinoms, der die, für hepatozelluläre Karzinome typische, verbreiterte Trabekelform, mit scharf abgegrenzten peripheren Grenzen aufweist. Erkennbar ist die monomorphe Atypie der Leberzellen.
40x
Abbildung 14
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Zellverband aus Zellen eines hepatozellulären Karzinoms, der die, für hepatozelluläre Karzinome typische, verbreiterte Trabekelform, mit scharf abgegrenzten peripheren Grenzen aufweist. Erkennbar ist die monomorphe Atypie der Leberzellen.
40x
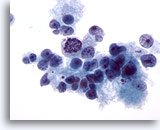
Abbildung 15
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Gering differenziertes hepatozelluläres Karzinom, das locker zusammenhängende maligne Leberzellen sowie beträchtliche Anisonukleose und Kernpolymorphie aufweist.
40x
Abbildung 15
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Gering differenziertes hepatozelluläres Karzinom, das locker zusammenhängende maligne Leberzellen sowie beträchtliche Anisonukleose und Kernpolymorphie aufweist.
40x
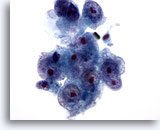
Abbildung 16
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Gering differenziertes hepatozelluläres Karzinom, bei dem Leberzellen mit hoher Kern-Plasma-Relation und Kernunregelmäßigkeiten erkennbar sind. Zu sehen sind mehrere sehr prominente Nukleolen..
60x
Abbildung 16
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Gering differenziertes hepatozelluläres Karzinom, bei dem Leberzellen mit hoher Kern-Plasma-Relation und Kernunregelmäßigkeiten erkennbar sind. Zu sehen sind mehrere sehr prominente Nukleolen..
60x
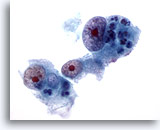
Abbildung 17
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Wenig differenziertes hepatozelluläres Karzinom, bei dem die Leberzellen ausgeprägte Kernvergrößerungen mit irregulären Kernen und sehr prominenten Nukleolen aufweisen.
60x
Abbildung 17
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Wenig differenziertes hepatozelluläres Karzinom, bei dem die Leberzellen ausgeprägte Kernvergrößerungen mit irregulären Kernen und sehr prominenten Nukleolen aufweisen.
60x
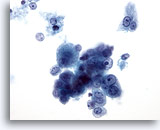
Abbildung 18: Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Lockerer Cluster aus einzelnen, verstreut liegenden, malignen Leberzellen die eine monomorphe Atypie aufweisen.. Die typischen Merkmale der Leberzellen, d.h. eine eher kubische Form mit zentralen Nukleolen, sind erhalten. Zu sehen sind doppelkernige Tumorzellen. Eine erhöhte Kern-Plasma-Relation ist erkennbar.
40x
Abbildung 18
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Lockerer Cluster aus einzelnen, verstreut liegenden, malignen Leberzellen die eine monomorphe Atypie aufweisen.. Die typischen Merkmale der Leberzellen, d.h. eine eher kubische Form mit zentralen Nukleolen, sind erhalten. Zu sehen sind doppelkernige Tumorzellen. Eine erhöhte Kern-Plasma-Relation ist erkennbar.
40x
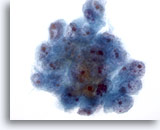
Abbildung 19
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Cluster maligner Zellen aus dem Aspirat eines hepatozellulären Karzinoms. Zu beachten sind die Kernvergrößerung, die irreguläre Chromatinverteilung, und die Präsenz von mindestens einem Nukleolus sowie eine erhöhte Kern-Plasma-Relation.
40x
Abbildung 19
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Cluster maligner Zellen aus dem Aspirat eines hepatozellulären Karzinoms. Zu beachten sind die Kernvergrößerung, die irreguläre Chromatinverteilung, und die Präsenz von mindestens einem Nukleolus sowie eine erhöhte Kern-Plasma-Relation.
40x
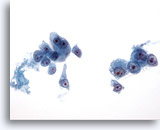
Abbildung 20
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
In lockeren Verbänden bzw. vereinzelt auftretende, maligne Zellen aus dem Aspirat eines hepatozellulären Karzinoms. Zu erkennen ist eine monomorphe Atypie mit einer erhöhten Kern-Plasma-Relation der malignen Zellen. Es sind die prominenten Nukleolen zu beachten.
40x
Abbildung 20
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
In lockeren Verbänden bzw. vereinzelt auftretende, maligne Zellen aus dem Aspirat eines hepatozellulären Karzinoms. Zu erkennen ist eine monomorphe Atypie mit einer erhöhten Kern-Plasma-Relation der malignen Zellen. Es sind die prominenten Nukleolen zu beachten.
40x
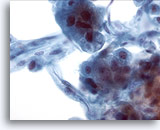
Abbildung 21
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Aspirat eines hepatozellulären Karzinoms, bei dem Leberzellen und im peripheren Bereich auch Endothelzellen erkennbar sind. Charakteristisch für Endothelzellen ist eine Spindelform mit lang gestreckten Zellkernen und verwaschenem Zytoplasma.
40x
Abbildung 21
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Aspirat eines hepatozellulären Karzinoms, bei dem Leberzellen und im peripheren Bereich auch Endothelzellen erkennbar sind. Charakteristisch für Endothelzellen ist eine Spindelform mit lang gestreckten Zellkernen und verwaschenem Zytoplasma.
40x
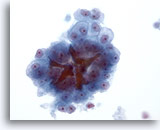
Abbildung 22
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Atypische Leberzellen eines hepatozelluläres Karzinom; es sind die monomorphe Atypie sowie Gallepfropfen erkennbar.
40x
Abbildung 22
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Atypische Leberzellen eines hepatozelluläres Karzinom; es sind die monomorphe Atypie sowie Gallepfropfen erkennbar.
40x
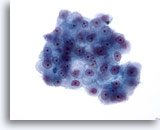
Abbildung 23
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Verband maligner Zellen mit erhöhter Kern-Plasma-Relation und ovalen oder leicht unregelmäßigen Zellkernen. Ebenfalls erkennbar sind prominente Nukleolen. Das Zytoplasma variiert von granulär bis blass, wobei die Grenzen zum Zytoplasma scharf abgegrenzt sind.
40x
Abbildung 23
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Verband maligner Zellen mit erhöhter Kern-Plasma-Relation und ovalen oder leicht unregelmäßigen Zellkernen. Ebenfalls erkennbar sind prominente Nukleolen. Das Zytoplasma variiert von granulär bis blass, wobei die Grenzen zum Zytoplasma scharf abgegrenzt sind.
40x
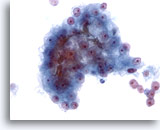
Abbildung 24
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Verband maligner Zellen aus dem Aspirat eines hepatozellulären Karzinoms mit erkennbarer Gallepfropfbildung. Der Nachweis von Galle ist zwar ein spezifisches Merkmal hepatozellulärer Karzinome, wird aber nur in einer Minderheit der Fälle beobachtet.
40x
Abbildung 24
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Verband maligner Zellen aus dem Aspirat eines hepatozellulären Karzinoms mit erkennbarer Gallepfropfbildung. Der Nachweis von Galle ist zwar ein spezifisches Merkmal hepatozellulärer Karzinome, wird aber nur in einer Minderheit der Fälle beobachtet.
40x
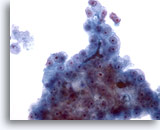
Abbildung 25
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Ein weiteres Beispiel für die Gallepfropfbildung aus dem Aspirat eines hepatozellulären Karzinoms.
40x
Abbildung 25
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Ein weiteres Beispiel für die Gallepfropfbildung aus dem Aspirat eines hepatozellulären Karzinoms.
40x
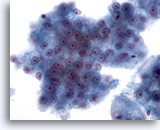
Abbildung 26
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Verband maligner Leberzellen mit monomorpher Atypie.
40x
Abbildung 26
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Verband maligner Leberzellen mit monomorpher Atypie.
40x
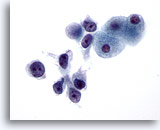
Abbildung 27
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Gering differenziertes hepatozelluläres Karzinom mit Zelldissoziation, die malignen Zellen weisen eine deutlich erhöhte Kern-Plasma-Relation auf.
60x
Abbildung 27
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Gering differenziertes hepatozelluläres Karzinom mit Zelldissoziation, die malignen Zellen weisen eine deutlich erhöhte Kern-Plasma-Relation auf.
60x
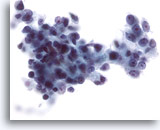
Abbildung 28
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Gering differenziertes hepatozelluläres Karzinom, bei dem die malignen Zellen eine deutlich erhöhte Kern-Plasma-Relation aufweisen. Zu sehen sind ferner erhebliche Kernpolymorphie.
40x
Abbildung 28
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Gering differenziertes hepatozelluläres Karzinom, bei dem die malignen Zellen eine deutlich erhöhte Kern-Plasma-Relation aufweisen. Zu sehen sind ferner erhebliche Kernpolymorphie.
40x
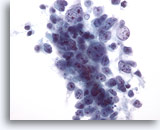
Abbildung 29: Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Aspirat eines hepatozellulären Karzinoms mit locker kohärenten Tumorzellen. Bei zunehmender Entdifferenzierung weisen hepatozelluläre Karzinome einen zunehmenden Verlust der Zellkohäsion auf und verlieren einige der „hepatozellulären“ Merkmale. Aus diesem Grund ist die Differenzialdiagnose zwischen einem hepatozellulären Primärkarzinom und einer Karzinommetastase häufig schwierig.
40x
Abbildung 29
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Aspirat eines hepatozellulären Karzinoms mit locker kohärenten Tumorzellen. Bei zunehmender Entdifferenzierung weisen hepatozelluläre Karzinome einen zunehmenden Verlust der Zellkohäsion auf und verlieren einige der „hepatozellulären“ Merkmale. Aus diesem Grund ist die Differenzialdiagnose zwischen einem hepatozellulären Primärkarzinom und einer Karzinommetastase häufig schwierig.
40x
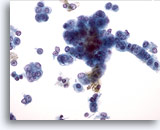
Abbildung 30
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Maligne Leberzellen mit erhöhter Kern-Plasma-Relation mit Bläschenkernen und prominenten Nukleolen. Die lineare Anordnung der Tumorzellen auf der rechten Seite sowie deren eher zylindrische Form erhöhen die Wahrscheinlichkeit, dass eine Mischform aus einem hepatozellulären Karzinom und einem Gallengangskarzinom vorliegt.
40x
Abbildung 30
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Maligne Leberzellen mit erhöhter Kern-Plasma-Relation mit Bläschenkernen und prominenten Nukleolen. Die lineare Anordnung der Tumorzellen auf der rechten Seite sowie deren eher zylindrische Form erhöhen die Wahrscheinlichkeit, dass eine Mischform aus einem hepatozellulären Karzinom und einem Gallengangskarzinom vorliegt.
40x
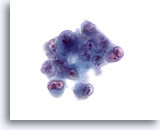
Abbildung 31
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Aspirat eines wenig differenzierten hepatozellulären Karzinoms mit stark atypischen Zellen, die eine hohe Kern-Plasma-Relation, Doppel- bis Mehrkernigkeit und ungleichmäßige Chromatinverklumpung mit prominenten irregulären Nukleolen aufweisen.
60x
Abbildung 31
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Aspirat eines wenig differenzierten hepatozellulären Karzinoms mit stark atypischen Zellen, die eine hohe Kern-Plasma-Relation, Doppel- bis Mehrkernigkeit und ungleichmäßige Chromatinverklumpung mit prominenten irregulären Nukleolen aufweisen.
60x
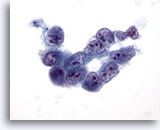
Abbildung 32
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Aspirat eines wenig differenzierten hepatozellulären Karzinoms mit einer locker zusammenhängenden Verbandsstruktur maligner Zellen, die eine sehr hohe Kern-Plasma-Relation, Polymorphie der Kerne und eine ungleichmäßige Chromatinverteilung mit multiplen Nukleolen aufweisen.
60x
Abbildung 32
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Aspirat eines wenig differenzierten hepatozellulären Karzinoms mit einer locker zusammenhängenden Verbandsstruktur maligner Zellen, die eine sehr hohe Kern-Plasma-Relation, Polymorphie der Kerne und eine ungleichmäßige Chromatinverteilung mit multiplen Nukleolen aufweisen.
60x
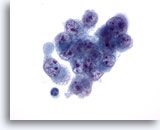
Abbildung 33
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Aspirat eines wenig differenzierten hepatozellulären Karzinoms; dargestellt sind maligne Zellen mit Anisozytose und Polymorphie und irregulären Zellkernen, die ebenfalls eine ungleichmäßige Chromatinverteilung und mehrere Nukleolen aufweisen.
60x
Abbildung 33
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Aspirat eines wenig differenzierten hepatozellulären Karzinoms; dargestellt sind maligne Zellen mit Anisozytose und Polymorphie und irregulären Zellkernen, die ebenfalls eine ungleichmäßige Chromatinverteilung und mehrere Nukleolen aufweisen.
60x
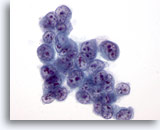
Abbildung 34
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Aspirat eines hepatozellulären Karzinoms, bei dem die Tumorzellen eine stark erhöhte Kern-Plasma-Relation aufweisen.
60x
Abbildung 34
Feinnadelaspiration Leber, Hepatozelluläres Karzinom.
Aspirat eines hepatozellulären Karzinoms, bei dem die Tumorzellen eine stark erhöhte Kern-Plasma-Relation aufweisen.
60x
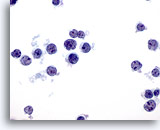
Abbildung 35
Feinnadelaspiration Leber – Lymphom
Auf diesem Objektträger sind atypische, dissoziierte, lymphatische Zellen zu sehen. Erkennbar ist die hohe Kern-Plasma-Relation der irregulären Kerne mit den kleinen, aber prominenten Nukleolen.
60x
Abbildung 35
Feinnadelaspiration Leber – Lymphom
Auf diesem Objektträger sind atypische, dissoziierte, lymphatische Zellen zu sehen. Erkennbar ist die hohe Kern-Plasma-Relation der irregulären Kerne mit den kleinen, aber prominenten Nukleolen.
60x
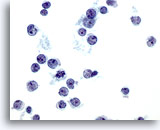
Abbildung 36
Feinnadelaspiration Leber – Lymphom.
Aspirat eines Non-Hodgkin-Lymphoms, bei dem die Tumorzellen vereinzelt und verstreut vorliegen und eine hohe Kern-Plasma-Relation mit Kernpolymorphie wie Einkerbungen und Protrussionen aufweisen. Bei einigen Tumorzellen sind kleine, aber markante Nukleolen erkennbar.
60x
Abbildung 36
Feinnadelaspiration Leber – Lymphom
Aspirat eines Non-Hodgkin-Lymphoms, bei dem die Tumorzellen vereinzelt und verstreut vorliegen und eine hohe Kern-Plasma-Relation mit Kernpolymorphie wie Einkerbungen und Protrussionen aufweisen. Bei einigen Tumorzellen sind kleine, aber markante Nukleolen erkennbar.
60x
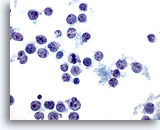
Abbildung 37
Feinnadelaspiration Leber – Lymphom
Aspirat eines Non-Hodgkin-Lymphoms mit vereinzelten und dissoziierten malignen Lymphomzellen, die ovale bis unregelmäßige Zellkerne mit Einkerbungen und Protrussionen und unregelmäßige Kernmembranen aufweisen.
60x
Abbildung 37
Feinnadelaspiration Leber – Lymphom
Aspirat eines Non-Hodgkin-Lymphoms mit vereinzelten und dissoziierten malignen Lymphomzellen, die ovale bis unregelmäßige Zellkerne mit Einkerbungen und Protrussionen und unregelmäßige Kernmembranen aufweisen.
60x
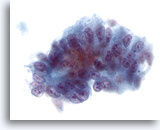
Abbildung 38
Feinnadelaspiration Leber, Metastatisches Adenokarzinom.
Aus atypischen zylinderförmigen Zellen mit Zellkern-Pseudoschichtung bestehendes metastatisches Adenokarzinom der Leber. Die Zellkerne sind oval und weisen mehrere Nukleolen sowie irreguläre Kerne auf.
40x
Abbildung 38
Feinnadelaspiration Leber, Metastatisches Adenokarzinom.
Aus atypischen zylinderförmigen Zellen mit Zellkern-Pseudoschichtung bestehendes metastatisches Adenokarzinom der Leber. Die Zellkerne sind oval und weisen mehrere Nukleolen sowie irreguläre Kerne auf.
40x
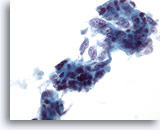
Abbildung 39
Feinnadelaspiration Leber, Metastatisches Adenokarzinom.
Lockere Zellverbände eines metastatischen Adenokarzinoms, viele der Tumorzellen sind zylinderförmig, mit elongierten Bläschenkerne sowie mehreren prominenten Nukleolen.
40x
Abbildung 39
Feinnadelaspiration Leber, Metastatisches Adenokarzinom.
Lockere Zellverbände eines metastatischen Adenokarzinoms, viele der Tumorzellen sind zylinderförmig, mit elongierten Bläschenkerne sowie mehreren prominenten Nukleolen.
40x
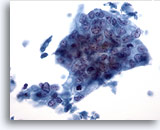
Abbildung 40
Feinnadelaspiration Leber, Metastatisches Adenokarzinom.
Wenig differenziertes Adenokarzinom mit synzytial angeordneten Tumorzellen, deren Zellkerne einen Polaritätsverlust erkennen lassen. Die Zellkerne der Tumorzellen zeigen eine ausgeprägte Anisokaryose und Polymorphie.
40x
Abbildung 40
Feinnadelaspiration Leber, Metastatisches Adenokarzinom.
Wenig differenziertes Adenokarzinom mit synzytial angeordneten Tumorzellen, deren Zellkerne einen Polaritätsverlust erkennen lassen. Die Zellkerne der Tumorzellen zeigen eine ausgeprägte Anisokaryose und Polymorphie.
40x
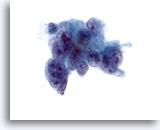
Abbildung 41
Feinnadelaspiration Leber, Metastatisches Adenokarzinom.
Aspirat eines metastatischen Adenokarzinoms, bei dem wenig differenzierte maligne Zellen erkennbar sind, deren Zellkerne erhebliche Anisokaryose und Polymorphie aufweisen. Auch Mehrkernigkeit ist erkennbar. Es ist außerdem eine ungleichmäßige Chromatinverteilung mit einem oder mehreren prominenten Nukleolen zu sehen. Die Tumorzellen weisen ein zartes Zytoplasma auf.
60x
Abbildung 41
Feinnadelaspiration Leber, Metastatisches Adenokarzinom.
Aspirat eines metastatischen Adenokarzinoms, bei dem wenig differenzierte maligne Zellen erkennbar sind, deren Zellkerne erhebliche Anisokaryose und Polymorphie aufweisen. Auch Mehrkernigkeit ist erkennbar. Es ist außerdem eine ungleichmäßige Chromatinverteilung mit einem oder mehreren prominenten Nukleolen zu sehen. Die Tumorzellen weisen ein zartes Zytoplasma auf.
60x
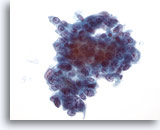
Abbildung 42
Feinnadelaspiration Leber, Metastatisches Adenokarzinom.
Aspirat eines metastatischen hepatozellulären Karzinoms, bei dem die Tumorzellen kubisch bis leicht zylindrisch geformt sind. Die Zellkerne zeigen eine geringe Anisokaryose und Polymorphie der Bläschenkerne mit prominenten Nukleolen.
40x
Abbildung 42
Feinnadelaspiration Leber, Metastatisches Adenokarzinom.
Aspirat eines metastatischen hepatozellulären Karzinoms, bei dem die Tumorzellen kubisch bis leicht zylindrisch geformt sind. Die Zellkerne zeigen eine geringe Anisokaryose und Polymorphie der Bläschenkerne mit prominenten Nukleolen.
40x
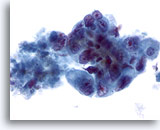
Abbildung 43
Feinnadelaspiration Leber, Metastatisches Adenokarzinom.
Gering differenzierte maligne Zellen mit beträchtlicher Anisokaryose und Polymorphie der Zellkerne, die eine unregelmäßige Chromatinverteilung und prominente Nukleolen aufweisen.
40x
Abbildung 43
Feinnadelaspiration Leber, Metastatisches Adenokarzinom.
Gering differenzierte maligne Zellen mit beträchtlicher Anisokaryose und Polymorphie der Zellkerne, die eine unregelmäßige Chromatinverteilung und prominente Nukleolen aufweisen.
40x
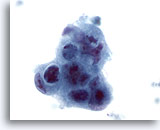
Abbildung 44
Feinnadelaspiration Leber, Metastatisches Adenokarzinom.
Gering differenzierte maligne Zellen, die eine synzytiale Anordnung und Polaritätsverlust erkennen lassen. Zu sehen sind ausgeprägte Kernpolymorphie, Hyperchromasie und irreguläre Nukleolen.
60x
Abbildung 44
Feinnadelaspiration Leber, Metastatisches Adenokarzinom.
Gering differenzierte maligne Zellen, die eine synzytiale Anordnung und Polaritätsverlust erkennen lassen. Zu sehen sind ausgeprägte Kernpolymorphie, Hyperchromasie und irreguläre Nukleolen.
60x
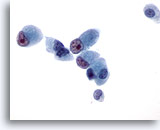
Abbildung 45
Feinnadelaspiration Leber, Metastatisches Gallengangskarzinom.
Die malignen Zellen sind kubisch bis zylindrisch geformt und weisen eine exzentrische Kernlage sowie prominente irreguläre Nukleolen auf.
60x
Abbildung 45
Feinnadelaspiration Leber, Metastatisches Gallengangskarzinom.
Die malignen Zellen sind kubisch bis zylindrisch geformt und weisen eine exzentrische Kernlage sowie prominente irreguläre Nukleolen auf.
60x
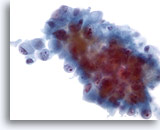
Abbildung 46
Feinnadelaspiration Leber, Metastatisches Gallengangskarzinom.
Aspirat eines metastatischen Gallengangskarzinoms mit oval bis zylindrisch geformten Tumorzellen. Die Zellkerne der Tumorzellen weisen eine exzentrische Kernlage auf. Zu sehen sind irreguläre Kerne, ungleichmäßige Chromatinverteilung und markante Nukleolen. Das umgebende zarte Zytoplasma ist amphophil.
40x
Abbildung 46
Feinnadelaspiration Leber, Metastatisches Gallengangskarzinom.
Aspirat eines metastatischen Gallengangskarzinoms mit oval bis zylindrisch geformten Tumorzellen. Die Zellkerne der Tumorzellen weisen eine exzentrische Kernlage auf. Zu sehen sind irreguläre Kerne, ungleichmäßige Chromatinverteilung und markante Nukleolen. Das umgebende zarte Zytoplasma ist amphophil.
40x
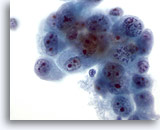
Abbildung 47
Feinnadelaspiration Leber, Metastatisches Gallengangskarzinom.
Aspirat eines metastatischen Gallengangskarzinoms mit oval bis unregelmäßig geformten malignen Zellen, die ungleichmäßig verteiltes, verklumptes Chromatin aufweisen. Die Tumorzellen enthalten mehrere Nukleolen. Das umhüllende, zarte Zytoplasma ist amphophil.
60x
Abbildung 47
Feinnadelaspiration Leber, Metastatisches Gallengangskarzinom.
Aspirat eines metastatischen Gallengangskarzinoms mit oval bis unregelmäßig geformten malignen Zellen, die ungleichmäßig verteiltes, verklumptes Chromatin aufweisen. Die Tumorzellen enthalten mehrere Nukleolen. Das umhüllende, zarte Zytoplasma ist amphophil.
60x
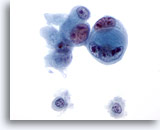
Abbildung 48
Feinnadelaspiration Leber, Metastatisches Gallengangskarzinom.
Gering differenziertes Gallengangskarzinom bei dem Zellkannibalismus zu erkennen ist. Erhebliche Anisokaryose und Kernpolymorphie sind ebenso zu sehen wie multiple, irreguläre Nukleolen.
60x
Abbildung 48
Feinnadelaspiration Leber, Metastatisches Gallengangskarzinom.
Gering differenziertes Gallengangskarzinom bei dem Zellkannibalismus zu erkennen ist. Erhebliche Anisokaryose und Kernpolymorphie sind ebenso zu sehen wie multiple, irreguläre Nukleolen.
60x
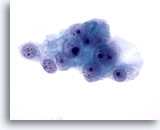
Abbildung 49
Feinnadelaspiration Leber, Metastase eines Nierenzellkarzinoms.
Die malignen Zellen weisen runde Zellkerne mit mehreren Nukleolen auf, die von blassem zartem Zytoplasma mit ausgefransten Rändern umgeben sind.
60x
Abbildung 49
Feinnadelaspiration Leber, Metastase eines Nierenzellkarzinoms.
Die malignen Zellen weisen runde Zellkerne mit mehreren Nukleolen auf, die von blassem zartem Zytoplasma mit ausgefransten Rändern umgeben sind.
60x
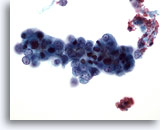
Abbildung 50
Feinnadelaspiration Leber, Metastase eines endometrialen Adenokarzinoms.
Aspirat eines metastatischen Adenokarzinoms des Endometrium mit relativ kleinen malignen Zellen, die eine sehr hohe Kern-Plasma-Relation aufweisen.
40x
Abbildung 50
Feinnadelaspiration Leber, Metastase eines endometrialen Adenokarzinoms.
Aspirat eines metastatischen Adenokarzinoms des Endometrium mit relativ kleinen malignen Zellen, die eine sehr hohe Kern-Plasma-Relation aufweisen.
40x
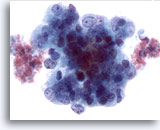
Abbildung 51
Feinnadelaspiration Leber, Metastase eines endometrialen Adenokarzinoms.
Adenokarzinoms .Aspirat der Lebermetastase eines Endometriumkarzinoms mit deutlicher Anisokaryose und Polymorphie der Tumorzellkerne. Die Tumorzellen zeigen irreguläres Chromatin und prominente Nukleolen.
60x
Abbildung 51
Feinnadelaspiration Leber, Metastase eines endometrialen Adenokarzinoms.
Adenokarzinoms .Aspirat der Lebermetastase eines Endometriumkarzinoms mit deutlicher Anisokaryose und Polymorphie der Tumorzellkerne. Die Tumorzellen zeigen irreguläres Chromatin und prominente Nukleolen.
60x
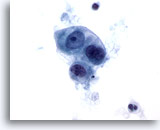
Abbildung 52
Metastatisches Zökumkarzinom
Metastatisches Adenokarzinom des Zökums mit einem lockeren Verband kubischer bis ovaler maligner Zellen. Es sind Anisokaryose und Kernpolymorphie erkennbar.
60x
Abbildung 52
Metastatisches Zökumkarzinom
Metastatisches Adenokarzinom des Zökums mit einem lockeren Verband kubischer bis ovaler maligner Zellen. Es sind Anisokaryose und Kernpolymorphie erkennbar.
60x
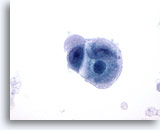
Abbildung 53
Metastatisches Zökumkarzinom
Feinnadelaspiration eines metastatischen, wenig differenzierten Zökumkarzinoms mit Tumorzellkernen in unterschiedlichen Größen und Formen. Das umhüllende Zytoplasma hat ein blasig-amphophiles Aussehen.
60x
Abbildung 53
Metastatisches Zökumkarzinom
Feinnadelaspiration eines metastatischen, wenig differenzierten Zökumkarzinoms mit Tumorzellkernen in unterschiedlichen Größen und Formen. Das umhüllende Zytoplasma hat ein blasig-amphophiles Aussehen.
60x
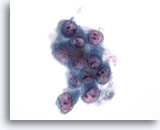
Abbildung 54: Feinnadelaspiration Leber, Metastatisches Lungenkarzinom.
Feinnadelaspiration der Lebermetastase eines Adenokarzinoms der Lunge, wobei in einem lockeren Verband maligner Zellen eine erhebliche Anisokaryose erkennbar ist. Zu sehen ist eine hohe Kern-Plasma-Relation. Die einzelnen Tumorzellkerne sind exzentrisch gelegen und von amphophilem Zytoplasma umgeben.
60x
Abbildung 54
Feinnadelaspiration Leber, Metastatisches Lungenkarzinom.
Feinnadelaspiration der Lebermetastase eines Adenokarzinoms der Lunge, wobei in einem lockeren Verband maligner Zellen eine erhebliche Anisokaryose erkennbar ist. Zu sehen ist eine hohe Kern-Plasma-Relation. Die einzelnen Tumorzellkerne sind exzentrisch gelegen und von amphophilem Zytoplasma umgeben.
60x
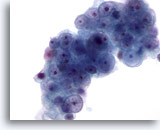
Abbildung 55
Feinnadelaspiration Leber, Lebermetastase eines Nierenzellkarzinoms.
Zellverband einerLebermetastase eines Nierenzellkarzinoms, bei dem die runden, unterschiedlich großen Zellkerne der Tumorzellen nur geringe Unregelmäßigkeit der Kernmembran zeigen. Die Zellkerne weisen kleine bis prominente Nukleolen auf. Das umgebende Zytoplasma ist blass.
60x
Abbildung 55
Feinnadelaspiration Leber, Lebermetastase eines Nierenzellkarzinoms.
Zellverband einerLebermetastase eines Nierenzellkarzinoms, bei dem die runden, unterschiedlich großen Zellkerne der Tumorzellen nur geringe Unregelmäßigkeit der Kernmembran zeigen. Die Zellkerne weisen kleine bis prominente Nukleolen auf. Das umgebende Zytoplasma ist blass.
60x
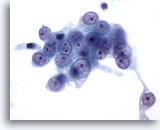
Abbildung 56
Feinnadelaspiration Leber, Lebermetastase eines Nierenzellkarzinoms.
Feinnadelaspiration eines metastatischen Nierenzellkarzinoms, dessen maligne Zellen runde Bläschenkerne und mindestens einen prominenten Nukleolus aufweisen. Die Grenzen zum umgebenden blassen Zytoplasma sind ausgefranst.
60x
Abbildung 56
Feinnadelaspiration Leber, Lebermetastase eines Nierenzellkarzinoms.
Feinnadelaspiration eines metastatischen Nierenzellkarzinoms, dessen maligne Zellen runde Bläschenkerne und mindestens einen prominenten Nukleolus aufweisen. Die Grenzen zum umgebenden blassen Zytoplasma sind ausgefranst.
60x
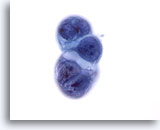
Abbildung 57
Feinnadelaspiration Leber, Metastatisches Pankreaskarzinom.
Zellverband einer Lebermetastase eines Pankreasgangkarzinoms. Zu sehen sind eine hohe Kern-Plasma-Relation sowie Kernunregelmäßigkeiten und verklumptes Chromatin. Auch eine Vakuolisierung des Zytoplasmas ist erkennbar.
60x
Abbildung 57
Feinnadelaspiration Leber, Metastatisches Pankreaskarzinom.
Zellverband einer Lebermetastase eines Pankreasgangkarzinoms. Zu sehen sind eine hohe Kern-Plasma-Relation sowie Kernunregelmäßigkeiten und verklumptes Chromatin. Auch eine Vakuolisierung des Zytoplasmas ist erkennbar.
60x
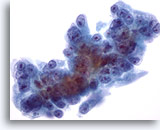
Abbildung 58
Feinnadelaspiration Leber, Metastatisches Pankreaskarzinom.
Lebermetastase eines Pankreaskarzinoms mit deutlicher Anisokaryose und Polymorphie der malignen Zellkerne. Man sieht exzentrisch gelegene Kerne , die von einem amphophilen, zarten Zytoplasma umgeben sind.
60x
Abbildung 58
Feinnadelaspiration Leber, Metastatisches Pankreaskarzinom.
Lebermetastase eines Pankreaskarzinoms mit deutlicher Anisokaryose und Polymorphie der malignen Zellkerne. Man sieht exzentrisch gelegene Kerne , die von einem amphophilen, zarten Zytoplasma umgeben sind.
60x
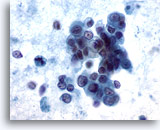
Abbildung 59
Feinnadelaspiration Leber, Metastatisches Pankreaskarzinom.
Lockere Verbände maligner Zellen mit blassem bis vakuolisiertem Zytoplasma und exzentrisch gelegenen Kernen. Es sind beträchtliche Unterschiede in Zellkerngröße und -form erkennbar. Neben Verbänden mit einer lockeren Verbandsstruktur sind auch einige vereinzelte Tumorzellen zu sehen. Im Hintergrund ist eine erhebliche Tumordiathese erkennbar.
60x
Abbildung 59
Feinnadelaspiration Leber, Metastatisches Pankreaskarzinom.
Lockere Verbände maligner Zellen mit blassem bis vakuolisiertem Zytoplasma und exzentrisch gelegenen Kernen. Es sind beträchtliche Unterschiede in Zellkerngröße und -form erkennbar. Neben Verbänden mit einer lockeren Verbandsstruktur sind auch einige vereinzelte Tumorzellen zu sehen. Im Hintergrund ist eine erhebliche Tumordiathese erkennbar.
60x
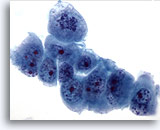
Abbildung 60
Feinnadelaspiration Leber, Metastatisches Pankreaskarzinom.
Gering differenzierte maligne Zellen mit ausgeprägter Anisokaryose und Polymorphie der Zellkerne. Man sieht ferner eine ungleichmäßige Chromatinverteilung und prominente Nukleolen.
60x
Abbildung 60
Feinnadelaspiration Leber, Metastatisches Pankreaskarzinom.
Gering differenzierte maligne Zellen mit ausgeprägter Anisokaryose und Polymorphie der Zellkerne. Man sieht ferner eine ungleichmäßige Chromatinverteilung und prominente Nukleolen.
60x
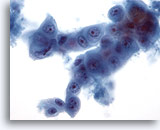
Abbildung 61
Feinnadelaspiration Leber, Metastatisches Pankreaskarzinom.
Aspirat eines metastatischen Pankreaskarzinoms, bei dem ovale bis kubische Zellen sowie Zellkannibalismus erkennbar sind. Die Anisokaryose und Kernpolymorphie sind beträchtlich.
40x
Abbildung 61
Feinnadelaspiration Leber, Metastatisches Pankreaskarzinom.
Aspirat eines metastatischen Pankreaskarzinoms, bei dem ovale bis kubische Zellen sowie Zellkannibalismus erkennbar sind. Die Anisokaryose und Kernpolymorphie sind beträchtlich.
40x
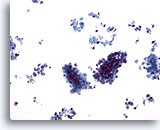
Abbildung 62
Feinnadelaspiration Leber, Metastatisches kleinzelliges Karzinom.
Zu sehen sind Verbände kleiner maligner Zellen und vereinzelte verstreute Tumorzellen. Zu beachten sind die charakteristisch geringe Größe der malignen Zellen und die hohe Kern-Plasma-Relation.
20x
Abbildung 62
Feinnadelaspiration Leber, Metastatisches kleinzelliges Karzinom.
Zu sehen sind Verbände kleiner maligner Zellen und vereinzelte verstreute Tumorzellen. Zu beachten sind die charakteristisch geringe Größe der malignen Zellen und die hohe Kern-Plasma-Relation.
20x
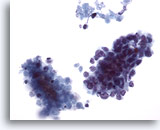
Abbildung 63
Feinnadelaspiration Leber, Metastatisches kleinzelliges Karzinom.
Verbände eines metastatischen kleinzelligen Lungenkarzinoms mit kleinen malignen Zellen, die eine hohe Kern-Plasma-Relation aufweisen. Erkennbar sind hyperchromatische Zellkerne ohne prominente Nukleolen. Zu beachten ist das an die malignen Verbände angrenzende nekrotische Material.
40x
Abbildung 63
Feinnadelaspiration Leber, Metastatisches kleinzelliges Karzinom.
Verbände eines metastatischen kleinzelligen Lungenkarzinoms mit kleinen malignen Zellen, die eine hohe Kern-Plasma-Relation aufweisen. Erkennbar sind hyperchromatische Zellkerne ohne prominente Nukleolen. Zu beachten ist das an die malignen Verbände angrenzende nekrotische Material.
40x
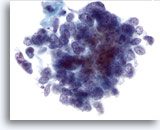
Abbildung 64
Feinnadelaspiration Leber, Metastatisches kleinzelliges Karzinom.
Erkennbar sind das, für kleinzellige Karzinome typische, gleichmäßig verteilte Chromatin und das Fehlen prominenter Nukleolen, in Verbindung mit der hohen Kern-Plasma-Relation.
60x
Abbildung 64
Feinnadelaspiration Leber, Metastatisches kleinzelliges Karzinom.
Erkennbar sind das, für kleinzellige Karzinome typische, gleichmäßig verteilte Chromatin und das Fehlen prominenter Nukleolen, in Verbindung mit der hohen Kern-Plasma-Relation.
60x
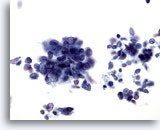
Abbildung 65
Feinnadelaspiration Leber, Metastatisches kleinzelliges Karzinom.
Im Aspirat eines metastatischen kleinzelligen Lungenkarzinoms sind lockere Cluster kleiner maligner Zellen zu sehen, die eine hohe Kern-Plasma-Relation aufweisen. Nukleolen sind meistens nicht vorhanden. Erkennbar ist ein feines reguläres Chromatinmuster.
40x
Abbildung 65
Feinnadelaspiration Leber, Metastatisches kleinzelliges Karzinom.
Im Aspirat eines metastatischen kleinzelligen Lungenkarzinoms sind lockere Cluster kleiner maligner Zellen zu sehen, die eine hohe Kern-Plasma-Relation aufweisen. Nukleolen sind meistens nicht vorhanden. Erkennbar ist ein feines reguläres Chromatinmuster.
40x
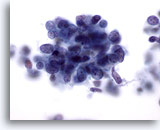
Abbildung 66
Feinnadelaspiration Leber, Metastatisches kleinzelliges Karzinom.
Starke Vergrößerung eines metastatischen kleinzelligen Lungenkarzinoms mit kleinen malignen Zellen, die eine hohe Kern-Plasma-Relation aufweisen. Die Zellkerne weisen feingranuläres, gleichmäßig verteiltes Chromatin auf, prominente Nukleolen fehlen.
60x
Abbildung 66
Feinnadelaspiration Leber, Metastatisches kleinzelliges Karzinom.
Starke Vergrößerung eines metastatischen kleinzelligen Lungenkarzinoms mit kleinen malignen Zellen, die eine hohe Kern-Plasma-Relation aufweisen. Die Zellkerne weisen feingranuläres, gleichmäßig verteiltes Chromatin auf, prominente Nukleolen fehlen.
60x
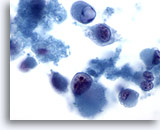
Abbildung 67
Feinnadelaspiration Leber – Melanommetastase
Abstrich mit Zelldissoziation, in dem deutlich atypische Zellen vom epithelioide Phänotyp zu erkennen sind. Der epithelioide Phänotyp ist durch große intrazytoplasmatische Globuli, und Zellkerne, die prominente Nukleolen aufweisen, charakterisiert.
60x
Abbildung 67
Feinnadelaspiration Leber – Melanommetastase
Abstrich mit Zelldissoziation, in dem deutlich atypische Zellen vom epithelioide Phänotyp zu erkennen sind. Der epithelioide Phänotyp ist durch große intrazytoplasmatische Globuli, und Zellkerne, die prominente Nukleolen aufweisen, charakterisiert.
60x
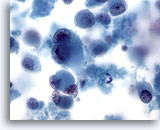
Abbildung 68
Feinnadelaspiration Leber – Melanommetastase.
Aspirat der Lebermetastase eines Melanoms, bei dem vereinzelte, versprengte maligne Zellen ebenso erkennbar sind wie Zellen, bei denen die charakteristische Doppelkernigkeit mit prominenten Nukleolen vorliegt. Wie bei manchen Melanommetastasen, ist ein mäßig weites Zytoplasma vorhanden.
60x
Abbildung 68
Feinnadelaspiration Leber – Melanommetastase
Aspirat der Lebermetastase eines Melanoms, bei dem vereinzelte, versprengte maligne Zellen ebenso erkennbar sind wie Zellen, bei denen die charakteristische Doppelkernigkeit mit prominenten Nukleolen vorliegt. Wie bei manchen Melanommetastasen, ist ein mäßig weites Zytoplasma vorhanden.
60x
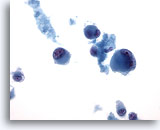
Abbildung 69
Feinnadelaspiration Leber – Melanommetastase
Aspirat der Lebermetastase eines Melanoms, bei dem vereinzelte, versprengte, bizarr geformte Tumorzellen sowie einzelne doppelkernige Zellen erkennbar sind. 40x
Abbildung 69
Feinnadelaspiration Leber – Melanommetastase
Aspirat der Lebermetastase eines Melanoms, bei dem vereinzelte, versprengte, bizarr geformte Tumorzellen sowie einzelne doppelkernige Zellen erkennbar sind. 40x
Pankreas
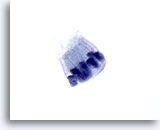
Abbildung 70
Feinnadelaspiration Pankreas, Benigne Duktuszellen.
Zu erkennen sind zylindrisch geformte Zellen die in Palisaden-Struktur angeordnet sind. Die Kern-Plasma-Relation bleibt niedrig. Die Zellkerne sind oval geformt und von amphophilem, blassem Zytoplasma umgeben.
60x
Abbildung 70
Feinnadelaspiration Pankreas, Benigne Duktuszellen.
Zu erkennen sind zylindrisch geformte Zellen die in Palisaden-Struktur angeordnet sind. Die Kern-Plasma-Relation bleibt niedrig. Die Zellkerne sind oval geformt und von amphophilem, blassem Zytoplasma umgeben.
60x
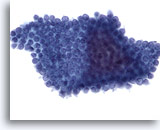
Abbildung 71
Feinnadelaspiration Pankreas, Benigne Duktuszellen.
Aspirat benigner, in Bienenwabenstruktur angeordneter Pankreasgangzellen, mit gleichmäßig verteilten Zellkernen.
40x
Abbildung 71
Feinnadelaspiration Pankreas, Benigne Duktuszellen.
Aspirat benigner, in Bienenwabenstruktur angeordneter Pankreasgangzellen, mit gleichmäßig verteilten Zellkernen.
40x
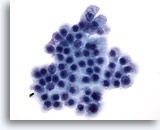
Abbildung 72
Feinnadelaspiration Pankreas, Benigne Duktuszellen.
Bei den bienenwabenartig angeordneten, benignen Duktuszellen in diesem Aspirat, handelt es sich um unimorphe Zellen mit runden Zellkernen und gut abgrenzbaren Zellgrenzen.
60x
Abbildung 72
Feinnadelaspiration Pankreas, Benigne Duktuszellen.
Bei den bienenwabenartig angeordneten, benignen Duktuszellen in diesem Aspirat, handelt es sich um unimorphe Zellen mit runden Zellkernen und gut abgrenzbaren Zellgrenzen.
60x

Abbildung 73
Feinnadelaspiration Pankreas – Skelettmuskulatur
Erkennbar ist das Fragment eines Skelettmuskels, das bei einer perkutanen Pankreasbiopsie unbeabsichtigt entnommen wurde. Es sind spindelförmige Zellkerne von blandem Aussehen zu sehen.
40x
Abbildung 73
Feinnadelaspiration Pankreas – Skelettmuskulatur
Erkennbar ist das Fragment eines Skelettmuskels, das bei einer perkutanen Pankreasbiopsie unbeabsichtigt entnommen wurde. Es sind spindelförmige Zellkerne von blandem Aussehen zu sehen.
40x
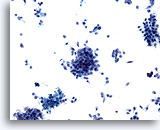
Abbildung 74
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Aspirat eines Adenokarzinoms des Pankreas, das lockere Verbände maligner Zellen sowie viele verstreut liegende atypische Einzelzellen enthält.
20x
Abbildung 74
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Aspirat eines Adenokarzinoms des Pankreas, das lockere Verbände maligner Zellen sowie viele verstreut liegende atypische Einzelzellen enthält.
20x
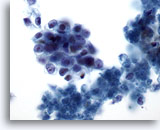
Abbildung 75
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Aspirat eines Pankreasadenokarzinoms, bei dem lockere Verbände maligner, oval geformter Zellen mit hoher Kern-Plasma-Relation erkennbar sind. Im Hintergrund ist ein wenig nekrotischer Detritus erkennbar.
60x
Abbildung 75
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Aspirat eines Pankreasadenokarzinoms, bei dem lockere Verbände maligner, oval geformter Zellen mit hoher Kern-Plasma-Relation erkennbar sind. Im Hintergrund ist ein wenig nekrotischer Detritus erkennbar.
60x
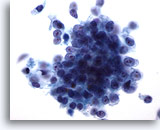
Abbildung 76
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Starke Vergrößerung von einem lockeren, synzytialen Verband maligner, Zellen eines Pankreasgangkarzinoms sowie verstreuten malignen Einzelzellen. Die Zellen sind kubisch bis zylindrisch geformt und weisen eine hohe Kern-Plasma-Relation auf.
60x
Abbildung 76
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Starke Vergrößerung von einem lockeren, synzytialen Verband maligner, Zellen eines Pankreasgangkarzinoms sowie verstreuten malignen Einzelzellen. Die Zellen sind kubisch bis zylindrisch geformt und weisen eine hohe Kern-Plasma-Relation auf.
60x
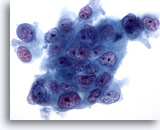
Abbildung 77
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Starke Vergrößerung eines Zellverbandes eines mäßig differenzierten duktalen Pankreasadenokarzinoms, bei dem die in Größe und Form deutlich unterschiedlichen Tumorzellen synzytial angeordnet sind. Es gibt Anzeichen für einen Polaritätsverlust. Die Zellkerne sind hyperchromatisch und weisen mehrere unregelmäßige Nukleolen auf.
60x
Abbildung 77
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Starke Vergrößerung eines Zellverbandes eines mäßig differenzierten duktalen Pankreasadenokarzinoms, bei dem die in Größe und Form deutlich unterschiedlichen Tumorzellen synzytial angeordnet sind. Es gibt Anzeichen für einen Polaritätsverlust. Die Zellkerne sind hyperchromatisch und weisen mehrere unregelmäßige Nukleolen auf.
60x
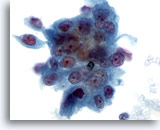
Abbildung 78
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Aspirat eines mäßig differenzierten Pankreaskarzinoms mit einem synzytialen Verband maligner Zellen mit ausgeprägter Anisokaryose und Kernpolymorphie.
60x
Abbildung 78
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Aspirat eines mäßig differenzierten Pankreaskarzinoms mit einem synzytialen Verband maligner Zellen mit ausgeprägter Anisokaryose und Kernpolymorphie.
60x
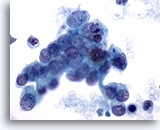
Abbildung 79
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Lockere Verbände und versprengte maligne Einzelzellen im Aspirat eines Pankreasgangkarzinoms. Die Tumorzellen zeigen eine ausgeprägte Anisokaryose und Kernpolymorphie. Bei vielen Tumorzellen sind eine hohe Kern-Plasma-Relation und eine irreguläre Chromatinverteilung erkennbar.
60x
Abbildung 79
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Lockere Verbände und versprengte maligne Einzelzellen im Aspirat eines Pankreasgangkarzinoms. Die Tumorzellen zeigen eine ausgeprägte Anisokaryose und Kernpolymorphie. Bei vielen Tumorzellen sind eine hohe Kern-Plasma-Relation und eine irreguläre Chromatinverteilung erkennbar.
60x
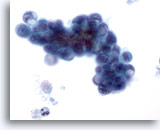
Abbildung 80
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Aspirat eines Pankreasgangkarzinoms, das neben oval geformten malignen Zellen einige Siegelringzellen aufweist. Die enormen Zytoplasma-Vakuolen haben die Zellkerne verdrängt und deformiert.
60x
Abbildung 80
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Aspirat eines Pankreasgangkarzinoms, das neben oval geformten malignen Zellen einige Siegelringzellen aufweist. Die enormen Zytoplasma-Vakuolen haben die Zellkerne verdrängt und deformiert.
60x
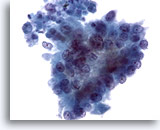
Abbildung 81
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Aspirat eines Pankreasadenokarzinoms mit Tumorzellen von eher zylindrischer Struktur. An den Zellkernen sind eine ausgeprägte Anisokaryose und Kernpolymorphie sowie Polaritätsverlust erkennbar.
40x
Abbildung 81
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Aspirat eines Pankreasadenokarzinoms mit Tumorzellen von eher zylindrischer Struktur. An den Zellkernen sind eine ausgeprägte Anisokaryose und Kernpolymorphie sowie Polaritätsverlust erkennbar.
40x
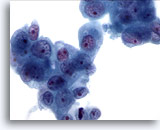
Abbildung 82
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Lockere Verbände maligner Zellen mit vergrößerten Zellkernen, die ein irreguläres Chromatinmuster und prominente Nukleolen aufweisen. Das umgebende Zytoplasma ist amphophil und leicht vakuolisiert.
60x
Abbildung 82
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Lockere Verbände maligner Zellen mit vergrößerten Zellkernen, die ein irreguläres Chromatinmuster und prominente Nukleolen aufweisen. Das umgebende Zytoplasma ist amphophil und leicht vakuolisiert.
60x
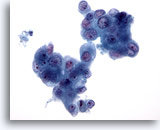
Abbildung 83
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Aspirat eines Pankreasadenokarzinoms, bei dem Verbände maligner Zellen erkennbar sind, deren Zellkerne erhebliche Größenunterschiede aufweisen. Zu sehen sind einige doppelkernige Zellen.
40x
Abbildung 83
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Aspirat eines Pankreasadenokarzinoms, bei dem Verbände maligner Zellen erkennbar sind, deren Zellkerne erhebliche Größenunterschiede aufweisen. Zu sehen sind einige doppelkernige Zellen.
40x
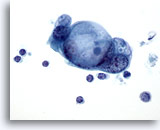
Abbildung 84
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Verbände maligner Zellen mit großen intrazytoplasmatischen Vakuolen, die ein „schießscheibenartiges“ Muster der Schleimtröpfchen aufweisen.
60x
Abbildung 84
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Verbände maligner Zellen mit großen intrazytoplasmatischen Vakuolen, die ein „schießscheibenartiges“ Muster der Schleimtröpfchen aufweisen.
60x
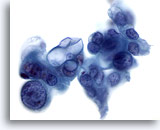
Abbildung 85
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Aspirat eines gering differenzierten Adenokarzinoms, bei dem bizarr geformte Tumorzellen erkennbar sind, von denen einige eine ausgeprägte Anisokaryose und Kernpolymorphie zeigen. Darüber hinaus weisen manche Tumorzellen große intrazytoplasmatische Vakuolen auf.
60x
Abbildung 85
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Aspirat eines gering differenzierten Adenokarzinoms, bei dem bizarr geformte Tumorzellen erkennbar sind, von denen einige eine ausgeprägte Anisokaryose und Kernpolymorphie zeigen. Darüber hinaus weisen manche Tumorzellen große intrazytoplasmatische Vakuolen auf.
60x
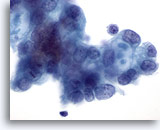
Abbildung 86
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Maligne Zellen, darunter einige mit „schießscheibenförmigen“ Schleimvakuolen.
60x
Abbildung 86
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Maligne Zellen, darunter einige mit „schießscheibenförmigen“ Schleimvakuolen.
60x
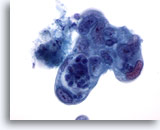
Abbildung 87
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Entdifferenziertes Adenokarzinom des Pankreas, das eine Pleomorphie der Zellen mit beträchtlicher Anisokaryose und Kernpolymorphie sowie eine hohe Kern-Plasma-Relation aufweist.
60x
Abbildung 87
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Entdifferenziertes Adenokarzinom des Pankreas, das eine Pleomorphie der Zellen mit beträchtlicher Anisokaryose und Kernpolymorphie sowie eine hohe Kern-Plasma-Relation aufweist.
60x
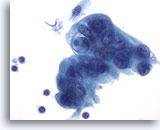
Abbildung 88
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Entdifferenzierte maligne Zellen, einige davon synzytial angeordnet. Die Zellen weisen hyperchromatische Zellkerne auf, die von einem zarten, amphophilen Zytoplasma mit ausgefransten Rändern umgeben sind. Eine der Tumorzellen zeigt eine „schießscheibenförmige“ Schleimvakuole.
60x
Abbildung 88
Feinnadelaspiration Pankreas, Adenokarzinom des Pankreas.
Entdifferenzierte maligne Zellen, einige davon synzytial angeordnet. Die Zellen weisen hyperchromatische Zellkerne auf, die von einem zarten, amphophilen Zytoplasma mit ausgefransten Rändern umgeben sind. Eine der Tumorzellen zeigt eine „schießscheibenförmige“ Schleimvakuole.
60x
Zurück nach oben
Rückkehr zu den Inhaltsverzeichnis
























































































