De nombreux centres médicaux pratiquent couramment la cytoponction hépatique et pancréatique à l’aiguille fine. Une telle intervention est généralement réalisée en vue d’évaluer une masse. Par le passé, les pathologistes avaient plutôt recours à une biopsie au trocart pour examiner les masses hépatiques, mais la cytoponction représente désormais une procédure standard dans la majorité des établissements. Pour le pancréas, la cytoponction à l’aiguille fine est plus courante que la biopsie au trocart, cette dernière pouvant entraîner une pancréatite. L’un des avantages de la cytoponction hépatique ou pancréatique réside dans le fait que plusieurs prélèvements peuvent être effectués au cours d’une même procédure, permettant ainsi un échantillonnage plus complet de la masse.
Occasionellement, un nodule cirrhotique dominant peut être prélevé dans le cadre de l’évaluation d’une lésion [1, 2]. L’aspect variable (plutôt qu’uniforme) des cellules hépatiques sur les lames ThinPrep représente une caractéristique cytologique importante d’un nodule cirrhotique. Les caractéristiques atypiques (comme l’hypertrophie nucléaire, la binucléation et l’anisonucléose) parfois observées sont très utiles dans l’établissement d’un diagnostic de cirrhose, car l’aspect polymorphe de la population cellulaire hépatique différencie les hépatocytes réactionnels bénins de l’atypie uniforme de l’hépatome. Outre la cellularité variable des cellules hépatiques constatée dans la cirrhose, on note des travées et cordes minces ne mesurant pas plus de deux cellules d’épaisseur et des cellules avec rapport nucléo/cytoplasmique faible. Enfin, on peut observer des cellules de canal biliaire avec des cellules inflammatoires et tissus fibreux occasionnels. [1, 2]
Les prélèvements d’hépatome préparés avec ThinPrep contiennent des cellules présentant un rapport nucléo/cytoplasmique uniformément élevé disposées dans des travées épaisses complexes anastomosées avec ramifications dont les bordures périphériques sont nettement démarquées. Les travées contiennent plus de quatre cellules en épaisseur, des cellules endothéliales « transgressives » et sont entourées de cellules endothéliales périphériques. Des cellules isolées et petits groupes dispersés sont souvent présents, ainsi que des noyaux hépatocytiques atypiques dépouillés. On peut occasionnellement observer du pigment biliaire [1, 2, 6, 7, 8, 9, 10, 11, 12, 13] .
Parmi les variantes occasionnelles de l’hépatome, citons l’hépatome fibrolamellaire, les sous-types à petites cellules et cellules claires, ainsi que le mélange hépatome/cholangiome. Les caractéristiques cytologiques de ces variantes sont décrites en détails dans des ouvrages standard.[1, 2]
Sur les lames ThinPrep, les échantillons de tumeurs hépatocellulaires bénignes (comme l’adénome et l’hyperplasie nodulaire focale) se composent de cellules hépatiques peu distinctes des hépatocytes de foie normal qui les entourent. [1, 2] Des fragments de tissus fibreux et de canaux biliaires sont présents dans l’hyperplasie nodulaire focale, mais pas dans les adénomes.
En raison du manque de caractéristiques atypiques, les échantillons prélevés par cytoponction à l’aiguille fine ne permettent pas d’établir un diagnostic spécifique d’adénome ou d’hyperplasie nodulaire focale. Il est par conséquent essentiel de mettre en corrélation les résultats cytologiques avec l’emplacement de l’aiguille.
Pour finir, notons que les prélèvements de carcinome métastatique effectués par cytoponction sont relativement courants, car le foie constitue le second site abdominal de développement de tumeurs malignes métastatiques (après les ganglions lymphatiques). Les carcinomes métastatiques représentent plus de 90 % de l’ensemble des néoplasmes hépatiques malins. Les adénocarcinomes siégeant dans divers sites représentent le principal type histologique du carcinome métastatique impliquant le foie, le carcinome colo-rectal étant le plus fréquent. Les caractéristiques cytomorphologiques de l’adénocarcinome métastatique sont assez similaires aux caractéristiques cytologiques du cholangiome primitif. Les échantillons d’adénocarcinome prélevés par cytoponction se composent généralement d’agrégats cohésifs de cellules malignes avec formation glandulaire. Les cellules cuboïdes à prismatiques ont un cytoplasme pâle délicat excentré, des noyaux ronds à irréguliers avec nucléoles proéminents. Le carcinome colo-rectal est souvent associé à une « nécrose sale » dans le fond, qui contraste avec le fond propre du cholangiome. Les cancers d’autres types de cellules observés incluent le carcinome métastatique à petites cellules, le mélanome, le lymphome malin et les tumeurs mésenchymateuses. [1, 2] [1, 2]
La cytoponction percutanée peropératoire endoscopique sous guidage échographique fait l’objet d’une utilisation croissante dans l’évaluation des masses kystiques et solides du pancréas [1, 2, 14, 15]. Elle présente des avantages distincts par rapport à la biopsie au trocart et à la résection cunéiforme du pancréas, ces deux procédures pouvant entraîner une pancréatite et/ou une péritonite due au déversement d’enzymes exocrines et de bile [16]. La cytoponction pancréatique à l’aiguille fine peut également s’avérer utile dans le diagnostic d’une lésion pancréatique inflammatoire (en vue d’établir la nécessité d’une intervention chirurgicale). Par conséquent, le cytopathologiste doit connaître les caractéristiques cytologiques et le spectre des changements observés dans l’épithélium pancréatique canalaire et acineux bénin [1, 2, 17]. Les cellules canalaires pancréatiques siègent de façon caractéristique dans des amas plats en nid d’abeille avec noyaux ronds à ovales régulièrement espacés et bordures bien définies. Les cellules acineuses ont tendance à siéger dans de petits agrégats cohésifs composés de cellules avec noyaux uniformes à orientation basale, chromatine en motte à finement granulaire et nucléoles discrets entourés d’une quantité modérée de cytoplasme granulaire. Ces échantillons ne contiennent généralement aucune cellule insulaire [1, 2, 14, 18]
Les échantillons de pseudokystes pancréatiques prélevés par cytoponction présentent généralement une faible cellularité avec quelques (voire aucune) cellules épithéliales. On peut toutefois noter des cellules inflammatoires aiguës et chroniques, des histiocytes, des tissus de granulation et des débris de fond avec fragments de calcification [1, 2]. Les caractéristiques cytomorphologiques de la pancréatite aiguë incluent une cellularité modérée à élevée, avec prédominance de neutrophiles et présence d’un fond « sale » [1, 2]. Les cellules canalaires et/ou acineuses peuvent afficher unz atypie réparatrice et/ou inflammatoire, et l’on peut observer une adiponécrose. À l’inverse, les échantillons de pancréatite chronique affichent généralement une cellularité relativement faible avec seulement quelques cellules canalaires dont le degré d’atypie et/ou les caractéristiques réactionnelles n’atteignent pas ceux de la pancréatite aiguë [1, 2]. On note enfin la présence de cellules chroniques inflammatoires.
Comme l’adénocarcinome pancréatique représente une tumeur maligne courante (environ 3 % de l’ensemble des cancers et 5 % des décès liés aux cancers), il est important de connaître ses caractéristiques cytomorphologiques. [18, 19] Presque ¾ des adénocarcinomes pancréatiques sont de type canalaire. Sur les lames ThinPrep, les caractéristiques cytomorphologiques de cette pathologie incluent une cellularité élevée avec des cellules atypiques isolées ou siégeant dans des groupes et amas. [1, 2] Au sein des groupes, on note une disposition en syncytium et une perte de polarité nucléaire. Une hypertrophie nucléaire et cytoplasmique peut être observée. Les noyaux ont tendance à être hyperchromatiques avec chromatine et bordures nucléaires irrégulières, ainsi que des fentes nucléaires occasionnelles. La taille nucléaire est extrêmement variable et l’on peut noter des nucléoles proéminents. Le fond contient généralement une diathèse tumorale.
Les variantes peu courantes de l’adénocarcinome pancréatique incluent le carcinome anaplasique (pléomorphe à cellules géantes), qui possède une population nettement pléomorphe, notamment des cellules malignes géantes et/ou fuselées, ainsi que la très rare tumeur à cellules géantes du pancréas, qui se compose de cellules géantes multinucléées dispersées semblables à des ostéoclastes avec noyaux rassemblés au centre, quantité modérée de cytoplasme et cellules mononucléées d’aspect similaire.[1, 2]
Les prélèvements de néoplasmes à cellules insulaires effectués par cytoponction ont tendance à être cellulaires et à contenir une population monomorphe de petites cellules uniformes manquant de cohésion. Les cellules tumorales sont petites, leur noyau est rond à ovale, la chromatine répartie de façon homogène est finement à grossièrement granulaire et les nucléoles sont discrets. Les noyaux sont excentrés dans ces cellules. Au contraire, les prélèvements de carcinome à cellules acineuses (très rare) contiennent des cellules lobulaires avec noyaux hyperchromatiques, motte chromatinienne et nucléoles proéminents. [1,2] Les cellules insulaires et acineuses ont un cytoplasme granulaire. Les caractéristiques cytomorphologiques des tumeurs kystiques papillaires incluent les structures papillaires avec cœurs fibrovasculaires tapissées d’une ou plusieurs couches de cellules épithéliales avec chromatine pâle, membranes nucléaires délicates et fentes nucléaires longitudinales occasionnelles. [1,2] Par contre, les néoplasmes kystiques mucineux possèdent des noyaux variables (ternes, atypiques et/ou franchement malins) [1,2]. Les cellules peuvent être isolées, siéger dans des groupes plats en nid d’abeille ou dans des groupes 3D associés à un matériel mucineux intracellulaire et/ou extracellulaire abondant. La littérature relative à la cytoponction à l’aiguille fine a recensé d’autres lésions inhabituelles parmi lesquelles le cystadénome séreux et le pancréatoblastome. [1,2,20] Pour terminer cette discussion, notons que l’on peut trouver des échantillons de tumeurs malignes avec métastases dans le pancréas [21].
Rappel : Vous pouvez cliquer sur une image
de l’Atlas pour la voir dans un format plus grand.
Foie
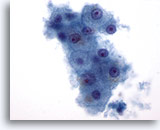
Figure 1: Cytoponction hépatique à l’aiguille fine – Hépatocytes bénins.
Petit groupe d’hépatocytes bénins composé de cellules polygonales à rondes avec bordures bien définies et noyaux placés au centre entourés de cytoplasme granulaire. À noter également la pigmentation intracytoplasmique. Malgré la présence de petits nucléoles, on n’observe aucune indication d’atypie ni d’augmentation des rapports nucléo/cytoplasmiques.
60x
Figure 1
Cytoponction hépatique à l’aiguille fine – Hépatocytes bénins
Petit groupe d’hépatocytes bénins composé de cellules polygonales à rondes avec bordures bien définies et noyaux placés au centre entourés de cytoplasme granulaire. À noter également la pigmentation intracytoplasmique. Malgré la présence de petits nucléoles, on n’observe aucune indication d’atypie ni d’augmentation des rapports nucléo/cytoplasmiques.
60x
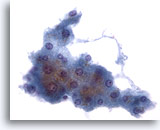
Figure 2: Cytoponction hépatique à l’aiguille fine – Hépatocytes bénins.
Groupe d’hépatocytes réactionnels bénins composé de cellules cuboïdes avec bordures bien définies et vacuolisées, cytoplasme opaque quelque peu granulaire. Noter les bords effilochés de ce groupe, la légère variation de taille nucléaire,la présence d’une cellule binucléée occasionnelle et de petits nucléoles.
40x
Figure 2
Cytoponction hépatique à l’aiguille fine – Hépatocytes bénins
Groupe d’hépatocytes réactionnels bénins composé de cellules cuboïdes avec bordures bien définies et vacuolisées, cytoplasme opaque quelque peu granulaire. Noter les bords effilochés de ce groupe, la légère variation de taille nucléaire,la présence d’une cellule binucléée occasionnelle et de petits nucléoles.
40x
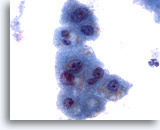
Figure 3
Cytoponction hépatique à l’aiguille fine – Hépatocytes bénins
Noter la légère variation de taille nucléaire, ainsi que le faible rapport nucléo/cytoplasmique, caractéristiques types des hépatocytes réactionnels. On peut également observer une fine vacuolisation cytoplasmique et la présence de pigment intracytoplasmique.
60x
Figure 3
Cytoponction hépatique à l’aiguille fine – Hépatocytes bénins
Noter la légère variation de taille nucléaire, ainsi que le faible rapport nucléo/cytoplasmique, caractéristiques types des hépatocytes réactionnels. On peut également observer une fine vacuolisation cytoplasmique et la présence de pigment intracytoplasmique.
60x
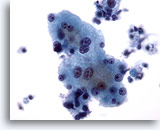
Figure 4
Cytoponction hépatique à l’aiguille fine – Hépatocytes bénins
Hépatocytes réactionnels avec variation de la taille nucléaire et binucléation.
40x
Figure 4
Cytoponction hépatique à l’aiguille fine – Hépatocytes bénins
Hépatocytes réactionnels avec variation de la taille nucléaire et binucléation.
40x
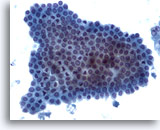
Figure 5
Cytoponction hépatique à l’aiguille fine – Cellules canalaires bénignes
Groupe de cellules bénignes du canal biliaire présentées en nid d’abeille avec petits noyaux uniformes.
20x
Figure 5
Cytoponction hépatique à l’aiguille fine – Cellules canalaires bénignes
Groupe de cellules bénignes du canal biliaire présentées en nid d’abeille avec petits noyaux uniformes.
20x
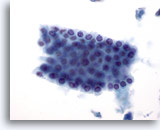
Figure 6
Cytoponction hépatique à l’aiguille fine – Cellules canalaires bénignes.
Groupe de cellules bénignes du canal biliaire présentées en nid d’abeille. Les cellules sont cuboïdes avec de petits noyaux régulièrement espacés. Les cellules canalaires ont un rapport nucléo/cytoplasmique plus élevé que les hépatocytes et ne présentent aucune granularité cytoplasmique, vacuolisation et/ou pigment.
40x
Figure 6
Cytoponction hépatique à l’aiguille fine – Cellules canalaires bénignes
Groupe de cellules bénignes du canal biliaire présentées en nid d’abeille. Les cellules sont cuboïdes avec de petits noyaux régulièrement espacés. Les cellules canalaires ont un rapport nucléo/cytoplasmique plus élevé que les hépatocytes et ne présentent aucune granularité cytoplasmique, vacuolisation et/ou pigment.
40x
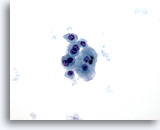
Figure 7
Cytoponction hépatique à l’aiguille fine – Cirrhose
Groupe lâche d’hépatocytes bénins avec binucléation et faible rapport nucléo/cytoplasmique.
40x
Figure 7
Cytoponction hépatique à l’aiguille fine – Cirrhose
Groupe lâche d’hépatocytes bénins avec binucléation et faible rapport nucléo/cytoplasmique.
40x
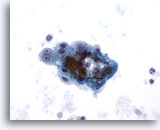
Figure 8
Cytoponction hépatique à l’aiguille fine – Cirrhose
Groupe lâche d’hépatocytes réactionnels bénins provenant d’un nodule cirrhotique. Noter la binucléation avec nucléoles proéminents, tandis que les rapports nucléo/cytoplasmiques restent faibles.
40x
Figure 8
Cytoponction hépatique à l’aiguille fine – Cirrhose
Groupe lâche d’hépatocytes réactionnels bénins provenant d’un nodule cirrhotique. Noter la binucléation avec nucléoles proéminents, tandis que les rapports nucléo/cytoplasmiques restent faibles.
40x
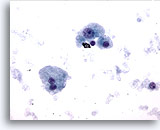
Figure 9
Cytoponction hépatique à l’aiguille fine – Cirrhose
Hépatocytes bénins, isolés et dispersés provenant d’un nodule cirrhotique. On note une variation de taille nucléaire mais aucune irrégularité nucléaire. Présence d’un hépatocyte binucléé. Les rapports nucléo/cytoplasmiques restent faibles.
40x
Figure 9
Cytoponction hépatique à l’aiguille fine – Cirrhose
Hépatocytes bénins, isolés et dispersés provenant d’un nodule cirrhotique. On note une variation de taille nucléaire mais aucune irrégularité nucléaire. Présence d’un hépatocyte binucléé. Les rapports nucléo/cytoplasmiques restent faibles.
40x
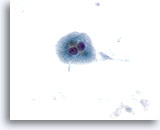
Figure 10
Cytoponction hépatique à l’aiguille fine – Cirrhose
Hépatocytes binucléés, bénins, isolés et dispersés provenant d’un nodule cirrhotique.
40x
Figure 10
Cytoponction hépatique à l’aiguille fine – Cirrhose
Hépatocytes binucléés, bénins, isolés et dispersés provenant d’un nodule cirrhotique.
40x
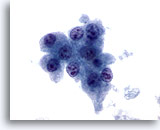
Figure 11
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatocytes présentant des atypies uniformes (augmentation du rapport nucléo/cytoplasmique, noyaux avec plusieurs nucléoles irréguliers, etc.).
60x
Figure 11
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatocytes présentant des atypies uniformes (augmentation du rapport nucléo/cytoplasmique, noyaux avec plusieurs nucléoles irréguliers, etc.).
60x
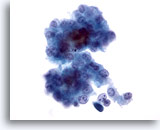
Figure 12
Cytoponction hépatique à l’aiguille fine, hépatome.
Groupe lâche d’hépatocytes malins provenant d’un prélèvement d’hépatome effectué par aspiration. On note des atypies uniformes, une augmentation du rapport nucléo/cytoplasmique et un peu de pigment biliaire entre les hépatocytes.
40x
Figure 12
Cytoponction hépatique à l’aiguille fine, hépatome.
Groupe lâche d’hépatocytes malins provenant d’un prélèvement d’hépatome effectué par aspiration. On note des atypies uniformes, une augmentation du rapport nucléo/cytoplasmique et un peu de pigment biliaire entre les hépatocytes.
40x
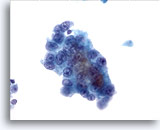
Figure 13
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatome mal différencié dans lequel les cellules hépatiques sont uniformément atypiques et présentent une augmentation du rapport nucléo/cytoplasmique.
40x
Figure 13
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatome mal différencié dans lequel les cellules hépatiques sont uniformément atypiques et présentent une augmentation du rapport nucléo/cytoplasmique.
40x
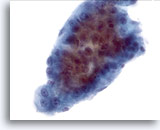
Figure 14
Cytoponction hépatique à l’aiguille fine, hépatome.
Groupe composé de travées épaisses avec bordures périphériques nettement démarquées (caractéristiques types d’un hépatome). Présence d’hépatomes uniformément atypiques.
40x
Figure 14
Cytoponction hépatique à l’aiguille fine, hépatome.
Groupe composé de travées épaisses avec bordures périphériques nettement démarquées (caractéristiques types d’un hépatome). Présence d’hépatomes uniformément atypiques.
40x
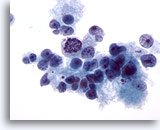
Figure 15
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatome mal différencié avec hépatocytes malins présentant un manque de cohésion, ainsi qu’une taille et une forme nucléaires extrêmement variables.
40x
Figure 15
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatome mal différencié avec hépatocytes malins présentant un manque de cohésion, ainsi qu’une taille et une forme nucléaires extrêmement variables.
40x
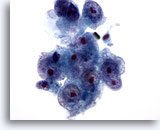
Figure 16
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatome mal différencié dans lequel les hépatocytes présentent un rapport nucléo/cytoplasmique élevé et une irrégularité nucléaire. Présence de plusieurs nucléoles proéminents.
60x
Figure 16
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatome mal différencié dans lequel les hépatocytes présentent un rapport nucléo/cytoplasmique élevé et une irrégularité nucléaire. Présence de plusieurs nucléoles proéminents.
60x
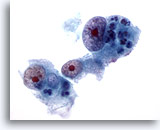
Figure 17
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatome mal différencié dans lequel les hépatocytes présentent une hypertrophie nucléaire marquée, une irrégularité nucléaire et des nucléoles très proéminents.
60x
Figure 17
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatome mal différencié dans lequel les hépatocytes présentent une hypertrophie nucléaire marquée, une irrégularité nucléaire et des nucléoles très proéminents.
60x
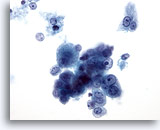
Figure 18: Cytoponction hépatique à l’aiguille fine, hépatome.
Groupe lâche d’hépatocytes malins isolés dispersés avec atypie uniforme. Les cellules hépatiques conservent leurs caractéristiques hépatocytiques (forme davantage cuboïde avec nucléoles placés au centre). On note également la présence de cellules tumorales binucléées et une augmentation du rapport nucléo/cytoplasmique.
40x
Figure 18
Cytoponction hépatique à l’aiguille fine, hépatome.
Groupe lâche d’hépatocytes malins isolés dispersés avec atypie uniforme. Les cellules hépatiques conservent leurs caractéristiques hépatocytiques (forme davantage cuboïde avec nucléoles placés au centre). On note également la présence de cellules tumorales binucléées et une augmentation du rapport nucléo/cytoplasmique.
40x
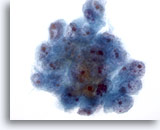
Figure 19
Cytoponction hépatique à l’aiguille fine, hépatome.
Groupe de cellules malignes. Noter l’hypertrophie nucléaire, la répartition non homogène de la chromatine et la présence d’un ou plusieurs nucléoles, ainsi que l’augmentation du rapport nucléo/cytoplasmique.
40x
Figure 19
Cytoponction hépatique à l’aiguille fine, hépatome.
Groupe de cellules malignes. Noter l’hypertrophie nucléaire, la répartition non homogène de la chromatine et la présence d’un ou plusieurs nucléoles, ainsi que l’augmentation du rapport nucléo/cytoplasmique.
40x
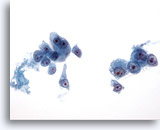
Figure 20
Cytoponction hépatique à l’aiguille fine, hépatome.
Cellules malignes présentant un manque de cohésion à isolées. Les cellules malignes sont uniformément atypiques et présentent une augmentation du rapport nucléo/cytoplasmique. Noter la présence de nucléoles proéminents.
40x
Figure 20
Cytoponction hépatique à l’aiguille fine, hépatome.
Cellules malignes présentant un manque de cohésion à isolées. Les cellules malignes sont uniformément atypiques et présentent une augmentation du rapport nucléo/cytoplasmique. Noter la présence de nucléoles proéminents.
40x
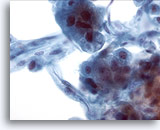
Figure 21
Cytoponction hépatique à l’aiguille fine, hépatome.
Présence d’hépatocytes et de cellules endothéliales situées en périphérie. Ces cellules fuselées présentent des noyaux allongés et un cytoplasme peu distinct.
40x
Figure 21
Cytoponction hépatique à l’aiguille fine, hépatome.
Présence d’hépatocytes et de cellules endothéliales situées en périphérie. Ces cellules fuselées présentent des noyaux allongés et un cytoplasme peu distinct.
40x
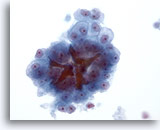
Figure 22
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatocytes uniformément atypiques et bouchons biliaires permettant d’établir un diagnostic d’hépatome.
40x
Figure 22
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatocytes uniformément atypiques et bouchons biliaires permettant d’établir un diagnostic d’hépatome.
40x
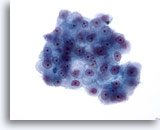
Figure 23
Cytoponction hépatique à l’aiguille fine, hépatome.
Groupe de cellules malignes présentant une augmentation du rapport nucléo/cytoplasmique et des noyaux de forme variable (allant d’ovales à quelque peu irréguliers). Présence de nucléoles proéminents et de bordures cytoplasmiques saillantes. Cytoplasme granulaire à pâle.
40x
Figure 23
Cytoponction hépatique à l’aiguille fine, hépatome.
Groupe de cellules malignes présentant une augmentation du rapport nucléo/cytoplasmique et des noyaux de forme variable (allant d’ovales à quelque peu irréguliers). Présence de nucléoles proéminents et de bordures cytoplasmiques saillantes. Cytoplasme granulaire à pâle.
40x
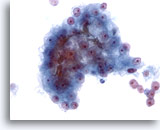
Figure 24
Cytoponction hépatique à l’aiguille fine, hépatome.
Groupe de cellules malignes avec bouchon biliaire. Même si la présence de bile est spécifique à l’hépatome, on ne peut l’observer que dans une minorité de cas.
40x
Figure 24
Cytoponction hépatique à l’aiguille fine, hépatome.
Groupe de cellules malignes avec bouchon biliaire. Même si la présence de bile est spécifique à l’hépatome, on ne peut l’observer que dans une minorité de cas.
40x
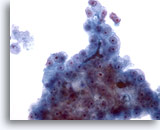
Figure 25
Cytoponction hépatique à l’aiguille fine, hépatome.
Autre exemple de bouchon biliaire dans un prélèvement d’hépatome effectué par aspiration.
40x
Figure 25
Cytoponction hépatique à l’aiguille fine, hépatome.
Autre exemple de bouchon biliaire dans un prélèvement d’hépatome effectué par aspiration.
40x
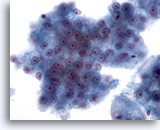
Figure 26
Cytoponction hépatique à l’aiguille fine, hépatome.
Groupes d’hépatocytes malins avec atypies uniformes.
40x
Figure 26
Cytoponction hépatique à l’aiguille fine, hépatome.
Groupes d’hépatocytes malins avec atypies uniformes.
40x
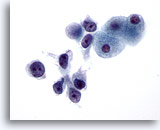
Figure 27
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatome mal différencié présentant une dissociation et des cellules malignes avec augmentation marquée du rapport nucléo/cytoplasmique.
60x
Figure 27
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatome mal différencié présentant une dissociation et des cellules malignes avec augmentation marquée du rapport nucléo/cytoplasmique.
60x
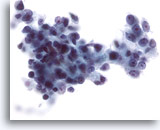
Figure 28
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatome mal différencié dans lequel les cellules malignes présentent une augmentation marquée du rapport nucléo/cytoplasmique. À noter également l’importante irrégularité nucléaire.
40x
Figure 28
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatome mal différencié dans lequel les cellules malignes présentent une augmentation marquée du rapport nucléo/cytoplasmique. À noter également l’importante irrégularité nucléaire.
40x
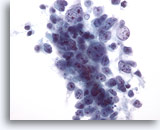
Figure 29: Cytoponction hépatique à l’aiguille fine, hépatome.
Cellules tumorales présentant un manque de cohésion qui augmente avec les hépatomes mal différenciés (lesquels perdent certaines caractéristiques « hépatocellulaires »). Par conséquent, le diagnostic différentiel d’hépatome primaire ou de carcinome métastatique est souvent difficile à établir.
40x
Figure 29
Cytoponction hépatique à l’aiguille fine, hépatome.
Cellules tumorales présentant un manque de cohésion qui augmente avec les hépatomes mal différenciés (lesquels perdent certaines caractéristiques « hépatocellulaires »). Par conséquent, le diagnostic différentiel d’hépatome primaire ou de carcinome métastatique est souvent difficile à établir.
40x
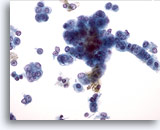
Figure 30
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatocytes malins avec augmentation du rapport nucléo/cytoplasmique, noyaux avec chromatine vésiculaire et nucléoles proéminents. La disposition linéaire et la forme plus prismatique des cellules tumorales sur la droite évoquent la possibilité d’un mélange hépatome/cholangiome.
40x
Figure 30
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatocytes malins avec augmentation du rapport nucléo/cytoplasmique, noyaux avec chromatine vésiculaire et nucléoles proéminents. La disposition linéaire et la forme plus prismatique des cellules tumorales sur la droite évoquent la possibilité d’un mélange hépatome/cholangiome.
40x
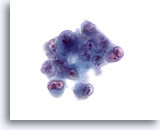
Figure 31
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatome mal différencié avec cellules extrêmement atypiques qui présentent des rapports nucléo/cytoplasmique élevés, une bi/multinucléation, une motte chromatinienne irrégulière et des nucléoles irréguliers proéminents.
60x
Figure 31
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatome mal différencié avec cellules extrêmement atypiques qui présentent des rapports nucléo/cytoplasmique élevés, une bi/multinucléation, une motte chromatinienne irrégulière et des nucléoles irréguliers proéminents.
60x
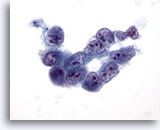
Figure 32
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatome mal différencié dans lequel un groupe de cellules malignes affichant un manque de cohésion présente des rapports nucléo/cytoplasmique extrêmement élevés, une irrégularité nucléaire, une répartition non homogène de la chromatine et des nucléoles multiples.
60x
Figure 32
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatome mal différencié dans lequel un groupe de cellules malignes affichant un manque de cohésion présente des rapports nucléo/cytoplasmique extrêmement élevés, une irrégularité nucléaire, une répartition non homogène de la chromatine et des nucléoles multiples.
60x
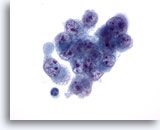
Figure 33
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatome mal différencié avec cellules malignes de taille et forme variables, noyaux irréguliers, répartition non homogène de la chromatine et nucléoles multiples.
60x
Figure 33
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatome mal différencié avec cellules malignes de taille et forme variables, noyaux irréguliers, répartition non homogène de la chromatine et nucléoles multiples.
60x
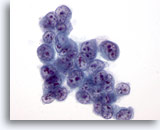
Figure 34
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatome mal différencié dans lequel les cellules tumorales présentent un rapport nucléo/cytoplasmique très élevé.
60x
Figure 34
Cytoponction hépatique à l’aiguille fine, hépatome.
Hépatome mal différencié dans lequel les cellules tumorales présentent un rapport nucléo/cytoplasmique très élevé.
60x
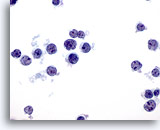
Figure 35
Cytoponction hépatique à l’aiguille fine – Lymphome
Cellules lymphoïdes atypiques avec dissociation. Noter les rapports nucléo/cytoplasmiques élevés, l’irrégularité nucléaire et la présence de petits nucléoles proéminents.
60x
Figure 35
Cytoponction hépatique à l’aiguille fine – Lymphome
Cellules lymphoïdes atypiques avec dissociation. Noter les rapports nucléo/cytoplasmiques élevés, l’irrégularité nucléaire et la présence de petits nucléoles proéminents.
60x
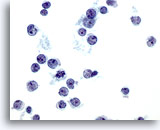
Figure 36
Cytoponction hépatique à l’aiguille fine – Lymphome.
Prélèvement d’un lymphome non hodgkinien effectué par cytoponction dans lequel les cellules tumorales sont isolées, dispersées et présentent un rapport nucléo/cytoplasmique élevé avec irrégularité nucléaire (par ex. crevasses et protubérances). Certaines cellules tumorales ont de petits nucléoles proéminents.
60x
Figure 36
Cytoponction hépatique à l’aiguille fine – Lymphome
Prélèvement d’un lymphome non hodgkinien effectué par cytoponction dans lequel les cellules tumorales sont isolées, dispersées et présentent un rapport nucléo/cytoplasmique élevé avec irrégularité nucléaire (par ex. crevasses et protubérances). Certaines cellules tumorales ont de petits nucléoles proéminents.
60x
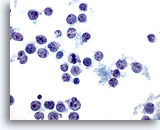
Figure 37
Cytoponction hépatique à l’aiguille fine – Lymphome
Prélèvement d’un lymphome non hodgkinien effectué par aspiration présentant des cellules lymphoïdes malignes isolées et dispersées avec noyaux ovales à irréguliers, irrégularités nucléaires (crevasses et protubérances) et membranes nucléaires irrégulières.
60x
Figure 37
Cytoponction hépatique à l’aiguille fine – Lymphome
Prélèvement d’un lymphome non hodgkinien effectué par aspiration présentant des cellules lymphoïdes malignes isolées et dispersées avec noyaux ovales à irréguliers, irrégularités nucléaires (crevasses et protubérances) et membranes nucléaires irrégulières.
60x
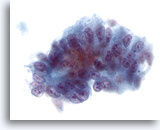
Figure 38
Cytoponction hépatique à l’aiguille fine, adénocarcinome métastatique.
Cellules prismatiques atypiques avec pseudo-stratification évocatrice des noyaux (lesquels sont ovales et présentent plusieurs nucléoles et une irrégularité nucléaire).
40x
Figure 38
Cytoponction hépatique à l’aiguille fine, adénocarcinome métastatique.
Cellules prismatiques atypiques avec pseudo-stratification évocatrice des noyaux (lesquels sont ovales et présentent plusieurs nucléoles et une irrégularité nucléaire).
40x
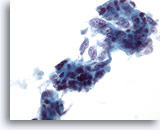
Figure 39
Cytoponction hépatique à l’aiguille fine, adénocarcinome métastatique.
Groupes lâches dans lesquels de nombreuses cellules tumorales ont une forme prismatique avec des noyaux vésiculaires allongés et plusieurs nucléoles proéminents.
40x
Figure 39
Cytoponction hépatique à l’aiguille fine, adénocarcinome métastatique.
Groupes lâches dans lesquels de nombreuses cellules tumorales ont une forme prismatique avec des noyaux vésiculaires allongés et plusieurs nucléoles proéminents.
40x
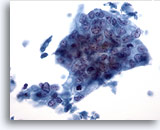
Figure 40
Cytoponction hépatique à l’aiguille fine, adénocarcinome métastatique.
Adénocarcinome mal différencié dans lequel les cellules tumorales sont disposées en syncytium avec des noyaux affichant une perte de polarité. La taille et la forme nucléaires des cellules tumorales varient de façon considérable.
40x
Figure 40
Cytoponction hépatique à l’aiguille fine, adénocarcinome métastatique.
Adénocarcinome mal différencié dans lequel les cellules tumorales sont disposées en syncytium avec des noyaux affichant une perte de polarité. La taille et la forme nucléaires des cellules tumorales varient de façon considérable.
40x
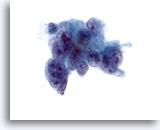
Figure 41
Cytoponction hépatique à l’aiguille fine, adénocarcinome métastatique.
Cellules malignes mal différenciées de forme et de taille nucléaires considérablement variables. À noter également la multinucléation, la répartition non homogène de la chromatine et la présence d’un ou plusieurs nucléoles proéminents. Les cellules tumorales ont un cytoplasme délicat.
60x
Figure 41
Cytoponction hépatique à l’aiguille fine, adénocarcinome métastatique.
Cellules malignes mal différenciées de forme et de taille nucléaires considérablement variables. À noter également la multinucléation, la répartition non homogène de la chromatine et la présence d’un ou plusieurs nucléoles proéminents. Les cellules tumorales ont un cytoplasme délicat.
60x
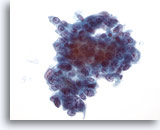
Figure 42
Cytoponction hépatique à l’aiguille fine, adénocarcinome métastatique.
Cellules tumorales variant de cuboïdes à quelque peu prismatiques. Noyaux de taille / forme nucléaires quelque peu variables avec chromatine vésiculaire et nucléoles proéminents.
40x
Figure 42
Cytoponction hépatique à l’aiguille fine, adénocarcinome métastatique.
Cellules tumorales variant de cuboïdes à quelque peu prismatiques. Noyaux de taille / forme nucléaires quelque peu variables avec chromatine vésiculaire et nucléoles proéminents.
40x
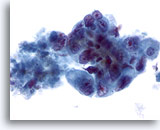
Figure 43
Cytoponction hépatique à l’aiguille fine, adénocarcinome métastatique.
Cellules malignes mal différenciées de taille et forme nucléaires extrêmement variables. Noyaux avec répartition non homogène de la chromatine et nucléoles proéminents.
40x
Figure 43
Cytoponction hépatique à l’aiguille fine, adénocarcinome métastatique.
Cellules malignes mal différenciées de taille et forme nucléaires extrêmement variables. Noyaux avec répartition non homogène de la chromatine et nucléoles proéminents.
40x
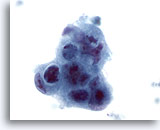
Figure 44
Cytoponction hépatique à l’aiguille fine, adénocarcinome métastatique.
Cellules malignes mal différenciées disposées en syncytium et affichant une perte de polarité. Irrégularité nucléaire marquée, hyperchromasie et nucléoles irréguliers.
60x
Figure 44
Cytoponction hépatique à l’aiguille fine, adénocarcinome métastatique.
Cellules malignes mal différenciées disposées en syncytium et affichant une perte de polarité. Irrégularité nucléaire marquée, hyperchromasie et nucléoles irréguliers.
60x
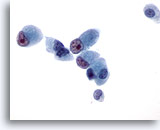
Figure 45
Cytoponction hépatique à l’aiguille fine, cholangiome métastatique.
Cellules malignes de forme cuboïde à prismatique avec noyaux excentrés possédant des nucléoles irréguliers proéminents.
60x
Figure 45
Cytoponction hépatique à l’aiguille fine, cholangiome métastatique.
Cellules malignes de forme cuboïde à prismatique avec noyaux excentrés possédant des nucléoles irréguliers proéminents.
60x
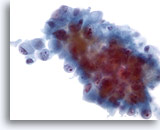
Figure 46
Cytoponction hépatique à l’aiguille fine, cholangiome métastatique.
Cellules tumorales variant d’ovales à prismatiques avec noyaux excentrés. Irrégularité nucléaire, répartition non homogène de la chromatine et nucléoles proéminents. Cellules entourées de cytoplasme délicat amphophile.
40x
Figure 46
Cytoponction hépatique à l’aiguille fine, cholangiome métastatique.
Cellules tumorales variant d’ovales à prismatiques avec noyaux excentrés. Irrégularité nucléaire, répartition non homogène de la chromatine et nucléoles proéminents. Cellules entourées de cytoplasme délicat amphophile.
40x
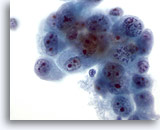
Figure 47
Cytoponction hépatique à l’aiguille fine, cholangiome métastatique.
Cellules malignes allant d’ovales à une forme irrégulière avec motte chromatinienne répartie de façon non homogène. Les cellules tumorales possèdent de multiples nucléoles et sont entourées de cytoplasme délicat amphophile.
60x
Figure 47
Cytoponction hépatique à l’aiguille fine, cholangiome métastatique.
Cellules malignes allant d’ovales à une forme irrégulière avec motte chromatinienne répartie de façon non homogène. Les cellules tumorales possèdent de multiples nucléoles et sont entourées de cytoplasme délicat amphophile.
60x
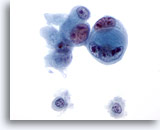
Figure 48
Cytoponction hépatique à l’aiguille fine, cholangiome métastatique.
Adénocarcinome mal différencié dans lequel les cellules sont imbriquées les unes dans les autres. On note également une taille et une forme nucléaires extrêmement variables, ainsi que de multiples nucléoles irréguliers.
60x
Figure 48
Cytoponction hépatique à l’aiguille fine, cholangiome métastatique.
Adénocarcinome mal différencié dans lequel les cellules sont imbriquées les unes dans les autres. On note également une taille et une forme nucléaires extrêmement variables, ainsi que de multiples nucléoles irréguliers.
60x
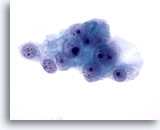
Figure 49
Cytoponction hépatique à l’aiguille fine, hypernéphrome métastatique.
Cellules malignes avec noyaux ronds, nucléoles multiples et entourées de cytoplasme délicat et pâle avec bordures effilochées.
60x
Figure 49
Cytoponction hépatique à l’aiguille fine, hypernéphrome métastatique.
Cellules malignes avec noyaux ronds, nucléoles multiples et entourées de cytoplasme délicat et pâle avec bordures effilochées.
60x
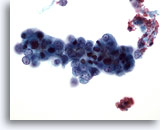
Figure 50
Cytoponction hépatique à l’aiguille fine, adénocarcinome endométrial métastatique.
Cellules malignes relativement petites avec rapport nucléo/cytoplasmique très élevé.
40x
Figure 50
Cytoponction hépatique à l’aiguille fine, adénocarcinome endométrial métastatique.
Cellules malignes relativement petites avec rapport nucléo/cytoplasmique très élevé.
40x
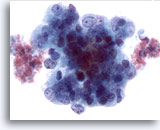
Figure 51
Cytoponction hépatique à l’aiguille fine, adénocarcinome endométrial métastatique.
Cellules tumorales de taille et forme nucléaires extrêmement variables, chromatine irrégulière et nucléoles proéminents.
60x
Figure 51
Cytoponction hépatique à l’aiguille fine, adénocarcinome endométrial métastatique.
Cellules tumorales de taille et forme nucléaires extrêmement variables, chromatine irrégulière et nucléoles proéminents.
60x
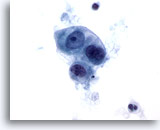
Figure 52
Carcinome caecal métastatique
Groupe lâche de cellules malignes cuboïdes à ovales. Taille et forme nucléaires variables.
60x
Figure 52
Carcinome caecal métastatique
Groupe lâche de cellules malignes cuboïdes à ovales. Taille et forme nucléaires variables.
60x
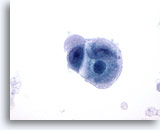
Figure 53
Carcinome caecal métastatique
Prélèvement d’un carcinome métastatique mal différencié du caecum effectué par cytoponction à l’aiguille fine dans lequel les cellules tumorales sont de forme et de taille nucléaires variables. Le cytoplasme entourant les cellules a un aspect amphophile plein de bulles.
60x
Figure 53
Carcinome caecal métastatique
Prélèvement d’un carcinome métastatique mal différencié du caecum effectué par cytoponction à l’aiguille fine dans lequel les cellules tumorales sont de forme et de taille nucléaires variables. Le cytoplasme entourant les cellules a un aspect amphophile plein de bulles.
60x
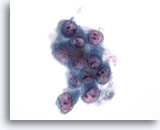
Figure 54: Cytoponction hépatique à l’aiguille fine, carcinome métastatique du poumon.
Groupe lâche de cellules malignes de forme nucléaire extrêmement variable, rapport nucléo/cytoplasmique élevé. Les cellules tumorales isolées ont un noyau excentré et sont entourées de cytoplasme amphophile.
60x
Figure 54
Cytoponction hépatique à l’aiguille fine, carcinome métastatique du poumon.
Groupe lâche de cellules malignes de forme nucléaire extrêmement variable, rapport nucléo/cytoplasmique élevé. Les cellules tumorales isolées ont un noyau excentré et sont entourées de cytoplasme amphophile.
60x
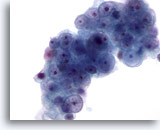
Figure 55
Cytoponction hépatique à l’aiguille fine, hypernéphrome avec métastases hépatiques.
Cellules tumorales avec noyaux ronds de taille variable et faible irrégularité des membranes nucléaires. Noyaux avec nucléoles petits à proéminents. Présence de cytoplasme pâle autour des cellules.
60x
Figure 55
Cytoponction hépatique à l’aiguille fine, hypernéphrome avec métastases hépatiques.
Cellules tumorales avec noyaux ronds de taille variable et faible irrégularité des membranes nucléaires. Noyaux avec nucléoles petits à proéminents. Présence de cytoplasme pâle autour des cellules.
60x
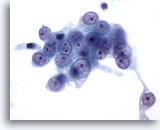
Figure 56
Cytoponction hépatique à l’aiguille fine, hypernéphrome avec métastases hépatiques.
Cellules malignes avec noyaux ronds, chromatine vésiculaire et un ou plusieurs nucléoles proéminents. Noter le cytoplasme pâle autour de ces cellules et les bordures cytoplasmiques effilochées.
60x
Figure 56
Cytoponction hépatique à l’aiguille fine, hypernéphrome avec métastases hépatiques.
Cellules malignes avec noyaux ronds, chromatine vésiculaire et un ou plusieurs nucléoles proéminents. Noter le cytoplasme pâle autour de ces cellules et les bordures cytoplasmiques effilochées.
60x
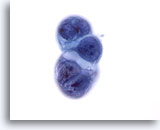
Figure 57
Cytoponction hépatique à l’aiguille fine, hypernéphrome avec métastases hépatiques.
Groupe de cellules d’un carcinome canalaire du pancréas avec métastases dans le foie. Rapports nucléo/cytoplasmiques élevés, irrégularité nucléaire, motte chromatinienne et vacuolisation cytoplasmique.
60x
Figure 57
Cytoponction hépatique à l’aiguille fine, hypernéphrome avec métastases hépatiques.
Groupe de cellules d’un carcinome canalaire du pancréas avec métastases dans le foie. Rapports nucléo/cytoplasmiques élevés, irrégularité nucléaire, motte chromatinienne et vacuolisation cytoplasmique.
60x
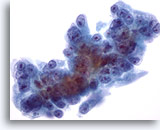
Figure 58
Cytoponction hépatique à l’aiguille fine, hypernéphrome avec métastases hépatiques.
Cellules malignes de taille et forme nucléaires extrêmement variables, nucléoles excentrés entourés de cytoplasme amphophile délicat.
60x
Figure 58
Cytoponction hépatique à l’aiguille fine, hypernéphrome avec métastases hépatiques.
Cellules malignes de taille et forme nucléaires extrêmement variables, nucléoles excentrés entourés de cytoplasme amphophile délicat.
60x
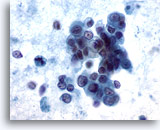
Figure 59
Cytoponction hépatique à l’aiguille fine, hypernéphrome avec métastases hépatiques.
Groupes lâches de cellules malignes avec cytoplasme pâle à vacuolisé et noyaux excentrés. Taille et forme nucléaires extrêmement variables. Présence de certaines cellules tumorales isolées. Diathèse tumorale considérable dans le fond.
60x
Figure 59
Cytoponction hépatique à l’aiguille fine, hypernéphrome avec métastases hépatiques.
Groupes lâches de cellules malignes avec cytoplasme pâle à vacuolisé et noyaux excentrés. Taille et forme nucléaires extrêmement variables. Présence de certaines cellules tumorales isolées. Diathèse tumorale considérable dans le fond.
60x
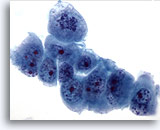
Figure 60
Cytoponction hépatique à l’aiguille fine, hypernéphrome avec métastases hépatiques.
Cellules malignes mal différenciées de taille et forme nucléaires extrêmement variables. Répartition non homogène de la chromatine et nucléoles proéminents.
60x
Figure 60
Cytoponction hépatique à l’aiguille fine, hypernéphrome avec métastases hépatiques.
Cellules malignes mal différenciées de taille et forme nucléaires extrêmement variables. Répartition non homogène de la chromatine et nucléoles proéminents.
60x
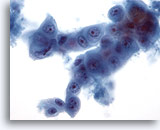
Figure 61
Cytoponction hépatique à l’aiguille fine, hypernéphrome avec métastases hépatiques.
Cellules ovales à cuboïdes imbriquées les unes dans les autres. Taille et forme nucléaires extrêmement variables.
40x
Figure 61
Cytoponction hépatique à l’aiguille fine, hypernéphrome avec métastases hépatiques.
Cellules ovales à cuboïdes imbriquées les unes dans les autres. Taille et forme nucléaires extrêmement variables.
40x
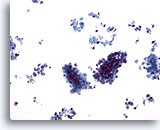
Figure 62
Cytoponction hépatique à l’aiguille fine, SCC métastatique.
Groupes de petites cellules malignes et cellules tumorales isolées dispersées. Noter la petite taille caractéristique des cellules malignes et les rapports nucléo/cytoplasmiques élevés.
20x
Figure 62
Cytoponction hépatique à l’aiguille fine, SCC métastatique.
Groupes de petites cellules malignes et cellules tumorales isolées dispersées. Noter la petite taille caractéristique des cellules malignes et les rapports nucléo/cytoplasmiques élevés.
20x
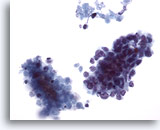
Figure 63
Cytoponction hépatique à l’aiguille fine, SCC métastatique.
Groupes de petites cellules malignes avec rapport nucléo/cytoplasmique élevé. Noyaux hyperchromatiques sans nucléole proéminent. Noter le matériel nécrotique à côté du groupe malin.
40x
Figure 63
Cytoponction hépatique à l’aiguille fine, SCC métastatique.
Groupes de petites cellules malignes avec rapport nucléo/cytoplasmique élevé. Noyaux hyperchromatiques sans nucléole proéminent. Noter le matériel nécrotique à côté du groupe malin.
40x
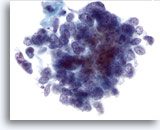
Figure 64
Cytoponction hépatique à l’aiguille fine, SCC métastatique.
Noter la chromatine répartie de façon homogène et l’absence de nucléoles proéminents caractéristiques du carcinome à petites cellules, ainsi que les rapports nucléo/cytoplasmique élevés.
60x
Figure 64
Cytoponction hépatique à l’aiguille fine, SCC métastatique.
Noter la chromatine répartie de façon homogène et l’absence de nucléoles proéminents caractéristiques du carcinome à petites cellules, ainsi que les rapports nucléo/cytoplasmique élevés.
60x
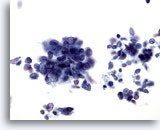
Figure 65
Cytoponction hépatique à l’aiguille fine, SCC métastatique.
Groupes lâches de petites cellules malignes avec rapport nucléo/cytoplasmique élevé. La majorité des nucléoles ne sont pas évidents. Noter la chromatine finement granulaire.
40x
Figure 65
Cytoponction hépatique à l’aiguille fine, SCC métastatique.
Groupes lâches de petites cellules malignes avec rapport nucléo/cytoplasmique élevé. La majorité des nucléoles ne sont pas évidents. Noter la chromatine finement granulaire.
40x
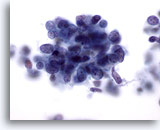
Figure 66
Cytoponction hépatique à l’aiguille fine, SCC métastatique.
Fort grossissement faisant apparaître des cellules malignes dont le rapport nucléo/cytoplasmique est élevé et des noyaux avec chromatine finement granulaire répartie de façon non homogène et sans nucléoles proéminents.
60x
Figure 66
Cytoponction hépatique à l’aiguille fine, SCC métastatique.
Fort grossissement faisant apparaître des cellules malignes dont le rapport nucléo/cytoplasmique est élevé et des noyaux avec chromatine finement granulaire répartie de façon non homogène et sans nucléoles proéminents.
60x
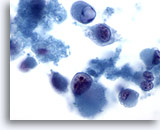
Figure 67
Cytoponction hépatique à l’aiguille fine – Mélanome métastatique
Frottis affichant une dissociation et des cellules atypiques marquées avec phénotype rhabdoïde (caractérisé par de gros globules intracytoplasmiques et des noyaux avec nucléoles proéminents).
60x
Figure 67
Cytoponction hépatique à l’aiguille fine – Mélanome métastatique
Frottis affichant une dissociation et des cellules atypiques marquées avec phénotype rhabdoïde (caractérisé par de gros globules intracytoplasmiques et des noyaux avec nucléoles proéminents).
60x
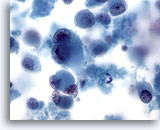
Figure 68
Cytoponction hépatique à l’aiguille fine – Mélanome métastatique.
Présence de cellules malignes isolées et dispersées, certaines affichant une binucléation caractéristique avec nucléoles proéminents. Comme dans certains mélanomes métastatiques, on note une quantité modérée de cytoplasme.
60x
Figure 68
Cytoponction hépatique à l’aiguille fine – Mélanome métastatique
Présence de cellules malignes isolées et dispersées, certaines affichant une binucléation caractéristique avec nucléoles proéminents. Comme dans certains mélanomes métastatiques, on note une quantité modérée de cytoplasme.
60x
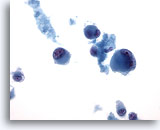
Figure 69
Cytoponction hépatique à l’aiguille fine – Mélanome métastatique
Présence de cellules tumorales bizarres isolées et dispersées, certaines affichant une binucléation.
40x
Figure 69
Cytoponction hépatique à l’aiguille fine – Mélanome métastatique
Présence de cellules tumorales bizarres isolées et dispersées, certaines affichant une binucléation.
40x
Pancréas
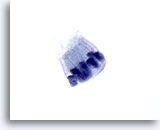
Figure 70
Cytoponction pancréatique à l’aiguille fine, cellules canalaires bénignes.
Noter les cellules prismatiques disposées en palissade. Les rapports nucléo/cytoplasmiques restent faibles. Les noyaux sont ovales et entourés de cytoplasme amphophile pâle.
60x
Figure 70
Cytoponction pancréatique à l’aiguille fine, cellules canalaires bénignes.
Noter les cellules prismatiques disposées en palissade. Les rapports nucléo/cytoplasmiques restent faibles. Les noyaux sont ovales et entourés de cytoplasme amphophile pâle.
60x
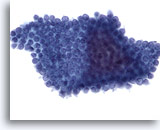
Figure 71
Cytoponction pancréatique à l’aiguille fine, cellules canalaires bénignes.
Cellules disposées en nid d’abeille avec noyaux espacés régulièrement.
40x
Figure 71
Cytoponction pancréatique à l’aiguille fine, cellules canalaires bénignes.
Cellules disposées en nid d’abeille avec noyaux espacés régulièrement.
40x
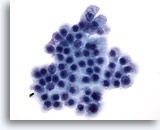
Figure 72
Cytoponction pancréatique à l’aiguille fine, cellules canalaires bénignes.
Cellules uniformes disposées en nid d’abeille avec noyaux ronds et bordures cellulaires bien définies.
60x
Figure 72
Cytoponction pancréatique à l’aiguille fine, cellules canalaires bénignes.
Cellules uniformes disposées en nid d’abeille avec noyaux ronds et bordures cellulaires bien définies.
60x

Figure 73
Cytoponction pancréatique à l’aiguille fine – Muscle du squelette
Fragment de muscle du squelette prélevé par inadvertance lors d’une ponction percutanée du pancréas. Présence de noyaux fuselés ternes.
40x
Figure 73
Cytoponction pancréatique à l’aiguille fine – Muscle du squelette
Fragment de muscle du squelette prélevé par inadvertance lors d’une ponction percutanée du pancréas. Présence de noyaux fuselés ternes.
40x
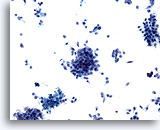
Figure 74
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Groupes lâches de cellules malignes. Nombreuses cellules atypiques isolées dispersées.
20x
Figure 74
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Groupes lâches de cellules malignes. Nombreuses cellules atypiques isolées dispersées.
20x
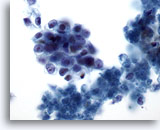
Figure 75
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Groupes lâches de cellules malignes ovales avec rapport nucléo/cytoplasmique élevé. Présence de débris nécrotiques dans le fond.
60x
Figure 75
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Groupes lâches de cellules malignes ovales avec rapport nucléo/cytoplasmique élevé. Présence de débris nécrotiques dans le fond.
60x
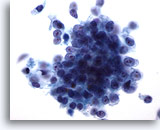
Figure 76
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Fort grossissement d’un carcinome canalaire pancréatique composé d’un groupe lâche de cellules malignes disposées en syncytium et de cellules malignes isolées dispersées. Les cellules sont de forme cuboïde à prismatique et présentent un rapport nucléo/cytoplasmique élevé.
60x
Figure 76
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Fort grossissement d’un carcinome canalaire pancréatique composé d’un groupe lâche de cellules malignes disposées en syncytium et de cellules malignes isolées dispersées. Les cellules sont de forme cuboïde à prismatique et présentent un rapport nucléo/cytoplasmique élevé.
60x
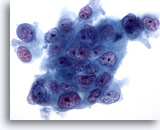
Figure 77
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Fort grossissement d’un adénocarcinome pancréatique modérément différencié de type canalaire composé de cellules tumorales disposées en syncytium, de taille et forme très variables. Perte de polarité évidente. Noyaux hyperchromatiques avec nucléoles irréguliers multiples.
60x
Figure 77
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Fort grossissement d’un adénocarcinome pancréatique modérément différencié de type canalaire composé de cellules tumorales disposées en syncytium, de taille et forme très variables. Perte de polarité évidente. Noyaux hyperchromatiques avec nucléoles irréguliers multiples.
60x
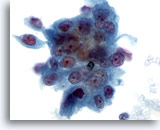
Figure 78
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Carcinome pancréatique modérément différencié contenant un groupe disposé en syncytium de cellules malignes de forme et de taille nucléaires considérablement variables.
60x
Figure 78
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Carcinome pancréatique modérément différencié contenant un groupe disposé en syncytium de cellules malignes de forme et de taille nucléaires considérablement variables.
60x
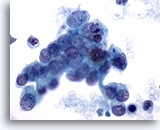
Figure 79
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Groupe lâche et cellules malignes isolées dispersées dans un prélèvement de carcinome canalaire pancréatique. Les cellules tumorales affichent une taille et une forme nucléaires extrêmement variées. Bon nombre d’entre elles présentent un rapport nucléo/cytoplasmique élevé, ainsi qu’une chromatine irrégulière.
60x
Figure 79
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Groupe lâche et cellules malignes isolées dispersées dans un prélèvement de carcinome canalaire pancréatique. Les cellules tumorales affichent une taille et une forme nucléaires extrêmement variées. Bon nombre d’entre elles présentent un rapport nucléo/cytoplasmique élevé, ainsi qu’une chromatine irrégulière.
60x
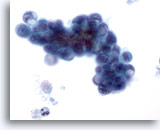
Figure 80
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Cellules malignes ovales et cellules en anneau (ou en « bague à chatons »). Les larges vacuoles cytoplasmiques ont déplacé et déformé les noyaux.
60x
Figure 80
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Cellules malignes ovales et cellules en anneau (ou en « bague à chatons »). Les larges vacuoles cytoplasmiques ont déplacé et déformé les noyaux.
60x
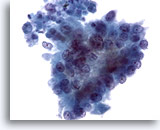
Figure 81
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Sur cette image, les cellules tumorales présentent une configuration davantage prismatique, une taille et une forme nucléaires extrêmement variables, ainsi qu’une perte de polarité.
40x
Figure 81
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Sur cette image, les cellules tumorales présentent une configuration davantage prismatique, une taille et une forme nucléaires extrêmement variables, ainsi qu’une perte de polarité.
40x
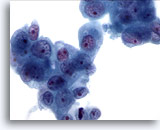
Figure 82
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Groupes lâches de cellules malignes avec noyaux augmentés en taille, chromatine irrégulière et nucléoles proéminents. Cellules entourées de cytoplasme amphophile à légèrement vacuolisé.
60x
Figure 82
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Groupes lâches de cellules malignes avec noyaux augmentés en taille, chromatine irrégulière et nucléoles proéminents. Cellules entourées de cytoplasme amphophile à légèrement vacuolisé.
60x
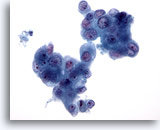
Figure 83
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Groupes de cellules malignes de forme et de taille nucléaires considérablement variables. Cellules binucléées occasionnelles.
40x
Figure 83
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Groupes de cellules malignes de forme et de taille nucléaires considérablement variables. Cellules binucléées occasionnelles.
40x
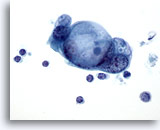
Figure 84
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Groupe de cellules malignes avec larges vacuoles intracytoplasmiques présentant un aspect de gouttelette de mucine en cocarde.
60x
Figure 84
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Groupe de cellules malignes avec larges vacuoles intracytoplasmiques présentant un aspect de gouttelette de mucine en cocarde.
60x
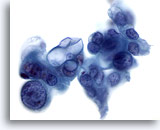
Figure 85
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Adénocarcinome mal différencié avec cellules tumorales bizarres dont certaines affichent une forme et une taille nucléaires considérablement variables. En outre, certaines cellules tumorales présentent de larges vacuoles intracytoplasmiques.
60x
Figure 85
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Adénocarcinome mal différencié avec cellules tumorales bizarres dont certaines affichent une forme et une taille nucléaires considérablement variables. En outre, certaines cellules tumorales présentent de larges vacuoles intracytoplasmiques.
60x
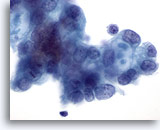
Figure 86
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Cellules malignes dont certaines présentent des vacuoles contenant de la mucine en cocarde.
60x
Figure 86
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Cellules malignes dont certaines présentent des vacuoles contenant de la mucine en cocarde.
60x
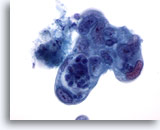
Figure 87
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Adénocarcinome pancréatique mal différencié avec cellules pléomorphes de taille/forme nucléaires extrêmement variables et rapport nucléo/cytoplasmique élevé.
60x
Figure 87
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Adénocarcinome pancréatique mal différencié avec cellules pléomorphes de taille/forme nucléaires extrêmement variables et rapport nucléo/cytoplasmique élevé.
60x
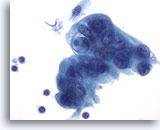
Figure 88
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Cellules malignes mal différenciées, certaines disposées en syncytium, noyaux hyperchromatiques, cellules entourées de cytoplasme amphophile délicat avec bordures effilochées. L’une des cellules tumorales présente une vacuole contenant de la mucine en cocarde.
60x
Figure 88
Cytoponction pancréatique à l’aiguille fine, adénocarcinome pancréatique.
Cellules malignes mal différenciées, certaines disposées en syncytium, noyaux hyperchromatiques, cellules entourées de cytoplasme amphophile délicat avec bordures effilochées. L’une des cellules tumorales présente une vacuole contenant de la mucine en cocarde.
60x
Retour au début
Retour à la table des matières
























































































