Cytoponction a l'aiguille fine
Introduction
David B. Kaminsky, MD, FIAC

L’univers de la cytopathologie est né avec la conception et la promotion d’une méthode de dépistage du cancer du col de l’utérus par le Dr. George Papanicolaou. Il a ensuite été révolutionné par l’introduction de la cytoponction (ou biopsie) à l’aiguille fine et de la cytologie en milieu liquide, dont la réunion fournit un puissant outil diagnostique qui facilite les études moléculaires et tests annexes dans les maladies oncologiques et infectieuses. Ces deux pratiques sophistiquées sont devenues des standards. Ensemble, elles renforcent les fondations de la cytopathologie moderne et revêtent un caractère indispensable.
La cytoponction à l’aiguille fine [FNAB, Fine Needle Aspiration Biopsy] est née à l’institut Karolinska-Radiumhemmet de Stockholm, dans les mains des pionniers Franzen, Zajicek et Esposti dont les travaux fructueux, corroborés par les données des biopsies, ont validé la fidélité du diagnostic cellulaire par rapport au diagnostic tissulaire et montré que l’aiguille représentait un outil diagnostique pratique capable de fournir, avec une méthode peu invasive, des informations équivalentes aux tissus.
Dans les années 1930, Martin tenta d’introduire la cytoponction, mais il se heurta à une communauté médicale américaine sceptique car sa technique faisait concurrence à une nouvelle technologie (à savoir la cytologie exfoliatrice et les coupes sous congélation). Cette technique provocatrice fit son chemin dans certains centres médicaux universitaires, dans lesquels des pathologistes apprirent à interpréter les morphologies cellulaires. Les cliniciens transcendèrent alors leur ambivalence et scepticisme.
Sous l’influence de pathologistes engagés comme Koss et Frable, la cytoponction commença à se développer et l’American Society of Cytopathology introduit des cours lors de sa réunion scientifique annuelle. Le Dr. Frable et moi-même avons collaboré dans des ateliers pratiques visant à enseigner la technique d’aspiration, les critères et la corrélation avec les modèles histologiques, et ainsi prouver à nos confrères la précision, l’efficacité et la sécurité de cette procédure. Comme d’autres pathologistes était également très enthousiastes, la cytoponction fut finalement intégrée aux programmes d’internat et d’enseignement, puis finalement acceptée dans la pratique générale. La collaboration avec des équipes de radiologie interventionnelle assura son succès définitif lorsque la tomodensitométrie, l’échographie et la radioscopie permirent un accès visuel contrôlé aux lésions viscérales profondes avec un risque acceptable et des résultats optimaux. Face à un nombre croissant de cancers et à une responsabilité financière accrue associée à leur prise en charge, notre société informée fut réceptive à une intervention mini-invasive, précise et rentable adaptable aux soins externes et favorable à la participation des patients dans le choix du traitement, ainsi que dans la mise en œuvre appropriée du traitement choisi. Cette technique correspondait parfaitement aux efforts déployés en vue d’améliorer la qualité des soins, car elle offrait une procédure mesurable basée sur des données et axée sur des résultats. L’introduction de la cytologie en milieu liquide ajouta une nouvelle dimension : le rinçage de l’aiguille dans le liquide recueilli en vue de fournir un réservoir de cellules permettant l’intégrité et la conservation des échantillons, et ainsi fournir des techniques supplémentaires d’analyse cytologique et de tests annexes.

La cytoponction à l’aiguille fine fait désormais partie intégrante des soins apportés aux patients. Elle est reconnue comme moyen de méditation dans les relations entre professionnels de la cytopathologie, cliniciens, équipes de radiologie interventionnelle, patients et organismes d’assurance maladie. Elle représente le lien entre cytoarchitecture et anatomie tissulaire, immunocytochimie, cytométrie de flux, culture, diagnostic moléculaire, traitement ciblé et corrélation clinique. Elle est financièrement viable et se traduit par un risque faible et des résultats exploitables. Elle a du caractère, de la personnalité et une vie indépendante.
Indications :
La présence d’une masse palpable à la surface du corps ou d’une lésion inexpliquée détectée par radiographie indiquent qu’une cytoponction à l’aiguille doit être réalisée par visualisation directe ou sous guidage radiographique. Plus spécifiquement, cette technique est utilisée pour :
- Fournir une modalité diagnostique fiable, appropriée et rentable
- Différencier, avec une technique peu invasive, une maladie bénigne d’une maladie maligne
- Écarter le jugement clinique de non résécabilité
- Confirmer une maladie métastatique
- Obtenir des informations équivalentes aux tissus chez des patients $$présentant des contre-indications
- Effectuer un tri par composition cellulaire : décision de pratiquer une radiothérapie, chimiothérapie, immunothérapie, chirurgie ou surveillance
- Acquérir du matériel pour les cultures, la microscopie électronique, cytométrie de flux, immunocytochimie, analyse d’images ADN et sondes ADN
Contre-indications :
Parmi les contre-indications cliniques à la cytoponction, citons la diathèse hémorragique, l’anticoagulothérapie, les malformations artério-veineuses et les kystes hydatiques. Si le site de ponction est le thorax, il existe d’autres contre-indications telles que l’hypertension pulmonaire, une toux incontrôlée, un emphysème avancé et l’incapacité du patient à retenir sa respiration.
Complications :
La cytoponction de masses palpables sous visualisation directe peut être compliquée par une hémorragie mineure [contrôlée par pression] et très rarement par une infection (le recours à une technique antiseptique appropriée permet d’éviter les infections). Les complications associées aux cytoponctions de lésions profondes sous guidage radiographique incluent : hémorragie, infection, translocation des cellules tumorales [rare]. Les sondes thoraciques peuvent provoquer un pneumothorax, une embolie gazeuse et un emphysème sous-cutané.
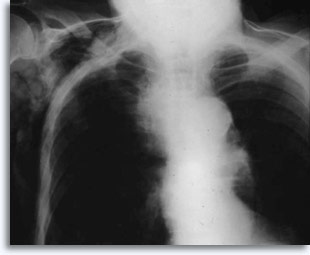
Avec des ponctions pulmonaires percutanées transthoraciques comme point de référence, une hémorragie peut se produire lorsque l’aiguille traverse la plèvre et entre dans le parenchyme pulmonaire. Sur les films thoraciques après ponction, cette hémorragie apparaît généralement sous la forme d’une amplification du site concerné.
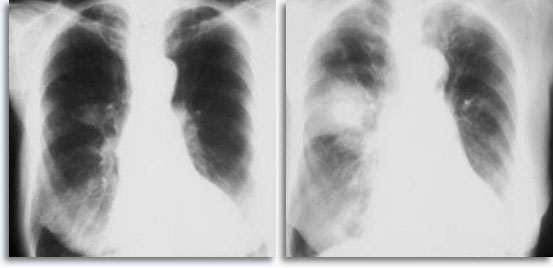
|
Cette technique est occasionnellement associée à une hémoptysie auto-limitée (expression clinique d’une fuite intraparenchymateuse). Le pneumothorax est une complication attendue de la cytoponction transthoracique car l’aiguille traverse la plèvre en direction du parenchyme, donnant lieu à un certain degré de collapsus pulmonaire. Il s’agit d’un pneumothorax symptomatique considéré comme une complication, qui nécessite généralement l’insertion d’un cathéter thoracique afin de regonfler le poumon.
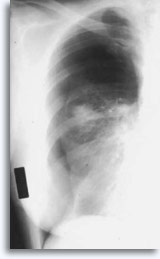 |
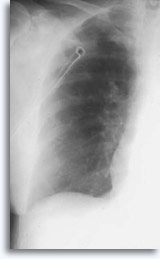 |
Les facteurs qui influencent l’occurrence du pneumothorax symptomatique incluent l’âge du patient, la taille, l’emplacement et la profondeur de la lésion, le nombre de ponctions, la présence d’un emphysème, l’intensité de l’examen des films après ponction et l’expérience de l’opérateur.
Pour éviter l’embolie gazeuse, le radiologue peut utiliser un robinet à trois voies ou faire extrêmement attention à ce que l’air ne pénètre pas dans l’aiguille pendant le cours intervalle entre le retrait du stylet et la connexion de la seringue. Un emphysème sous-cutané peut se produire lorsque de l’air pénètre dans les tissus mous, entraînant une suffusion crépitante auto-limitée.
 |
Lors d’études exhaustives réalisées au Karolinska Institute sur d’importantes populations de patients subissant une cytoponction, la translocation des cellules malignes le long de l’aiguille a représenté un événement rare, pour ne pas dire anecdotique puisqu’on l’a constaté pour à peine un cas sur plusieurs milliers, en général associé à une tumeur extrêmement maligne dont on prévoyait la dissémination spontanée.
La plupart des décès sont dus à l’utilisation d’aiguilles coupantes plutôt qu’à des aiguilles fines et sont extrêmement rares avec des aiguilles infra-millimétriques (22 G). Dans les ponctions pulmonaires, les décès sont dus à une hémorragie endobronchique provoquée par des aiguilles coupantes.
Technique employée pour une cytoponction superficielle sous visualisation directe :
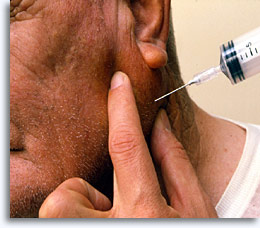
La cytoponction à l’aiguille fine est une méthode sûre et efficace d’obtenir des cellules pour l’évaluation cytologique diagnostique de masses superficielles palpables (sein, thyroïde, glandes salivaires, ganglions lymphatiques, kystes et tumeurs métastatiques) en utilisant une seringue 20 cc, une aiguille 22 G et éventuellement un porte-seringue [« pistolet »].
 |
 |
La préparation du patient est minime : explication de la procédure, des complications et effets secondaires, des limites et résultats attendus, annotation des antécédents (allergies, anticoagulothérapie, tendances hémorragiques, etc.), acquisition du formulaire de consentement éclairé signé, respect des consignes de l’HIPAA et de toutes les considérations éthiques (notamment la présence d’un assistant pour les patientes), examen physique du site cible et traitement antiseptique. L’anesthésie locale est facultative.
Après la palpation et le traitement antiseptique, l’aiguille est introduite dans la cible, le piston poussé pour créer une pression négative pendant que l’aiguille oscille plusieurs fois dans différentes directions, puis un rééquilibrage est effectué avant le retrait de l’aiguille. La procédure est terminée quand l’opérateur estime que la pénétration est suffisante ou quand le matériel apparaît dans la garde de la seringue. La seringue est alors retirée de l’aiguille, puis remplie d’air afin d’exercer une pression lors de sa reconnexion à l’aiguille. Elle peut être tenue manuellement ou avec un porte-seringue facultatif.
Les cellules obtenues de l’aspiration sont extraites sur des lames en verre étiquetées en plaçant l’aiguille, côté biseau vers le bas, en contact avec le verre et en extrayant une gouttelette. À l’aide d’une seconde lame, la gouttelette est dispersée par capillarité dans une monocouche circulaire. Les lames sont ensuite séparées dans un mouvement perpendiculaire rapide pour éviter la contamination de l’échantillon, puis immédiatement immergées dans un liquide composé d’éthanol à 95 %. En l’absence de colorations de Romanowsky, les artefacts de séchage à l’air doivent être évités. L’aiguille peut ensuite être rincée dans une solution saline ou dans le flacon ThinPrep® Un cytobloc peut être préparé à partir d’un matériel solide.
 |
Si la ponction est réalisée sur un ganglion lymphatique, des « passages » supplémentaires peuvent être effectués pour coloration de Diff Quick ou pour lavage en milieu RPMI (dans le cas de la cytométrie de flux). Un diagnostic préliminaire est documenté et communiqué au médecin traitant ou au personnel soignant (selon le cas).
Technique employée pour une cytoponction de lésions profondes sous guidage radiographique.
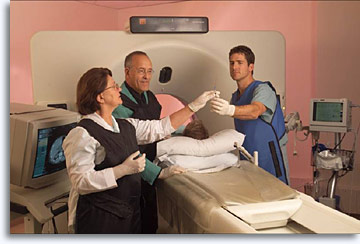
Les lésions profondes non palpables peuvent être atteintes en suivant (sur une échographie, radioscopie ou tomodensitométrie) le cheminement de l’aiguille 22 G jusqu’au site cible. La ponction est généralement réalisée par le radiologue en collaboration avec le pathologiste responsable de l’évaluation de la qualité de l’échantillon, de l’établissement (si possible) d’un diagnostic immédiat et du recours à d’autres techniques permettant d’assurer un traitement et une évaluation optimaux de l’échantillon. La présence d’un pathologiste au cours de la procédure garantit la qualité de l’échantillon, augmente de façon significative la précision statistique du diagnostic, réduit le nombre de « passages », évite les pneumothorax et permet de prendre des décisions immédiates quant au tri. Le radiologue explique la procédure au patient, détermine la trajectoire, administre l’anesthésique local, positionne l’aiguille, effectue le prélèvement et détermine le traitement en cas de complication. Sa présence garantit un prélèvement optimal et un traitement approprié de l’échantillon, tandis que la présence du pathologiste assure une meilleure compréhension du problème clinique et des relations anatomiques de la lésion. Enfin, un chirurgien peut planifier une approche opératoire stratégique (disponibilité de la salle d’opération, gestion administrative, etc.) Cette collaboration entre les différents membres de l’équipe représente un réel bénéfice pour le patient.
 |
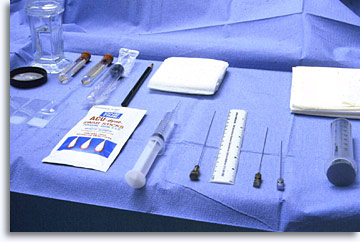
Matériel et réactifs présents sur le plateau préparé pour une cytoponction à l’aiguille fine : solution antiseptique, Xylocaïne à 1 %, seringues 20 cc, aiguilles souples 22 G pour ponction lombaire avec stylets, porte-seringue (facultatif), gazes stériles, lames en verre transparent, éthanol à 95 %, sérum physiologique, tubes stériles vides fermés, flacons ThinPrep®, bouteille contenant du formaldéhyde à 10 %.
 |
Une fois la procédure ci-dessus expliquée et le formulaire de consentement éclairé signé obtenu, le radiologue établit la position de la lésion et évalue la trajectoire à l’aide de la méthode d’imagerie choisie. Pour les ponctions thyroïdiennes, l’échographie est la méthode préférée de guidage de l’aiguille en temps réel et d’établissement de la position de sa pointe dans la cible. Une image peut permettre de vérifier la position correcte de la pointe de l’aiguille.
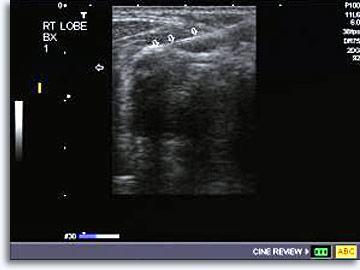 |
Pour les lésions pulmonaires et abdominales, une tomodensitométrie (TDM) est souvent employée pour un guidage précis et sensible de l’aiguille, ainsi que pour la documentation de la source cellulaire à partir de la cible.
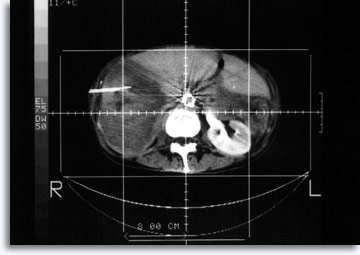 |
La TDM ayant beaucoup évolué et permettant d’obtenir rapidement une image qui facilite l’efficacité de la ponction, la radioscopie est nettement moins utilisée pour les lésions pulmonaires. Voici un exemple de cytoponction à l’aiguille fine dirigée par TDM :
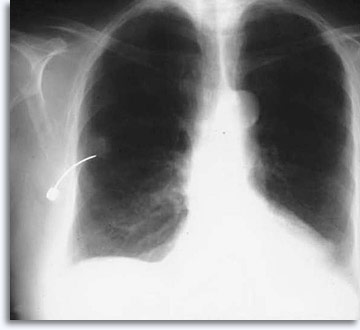 |
Une fois les images de référence acquises, le site est nettoyé à l’aide d’un antiseptique et le patient recouvert d’un champ stérile. L’anesthésique local est administré, puis l’aiguille souple 22 G (avec le stylet en place) est introduite dans la peau, à une profondeur estimée au préalable, dans la lésion [pour les lésions thoraciques et abdominales], ou l’aiguille 22 G fixée à la seringue 20 cc est positionnée dans la cible sous contrôle échographique. La pointe de l’aiguille est vérifiée. Si un stylet est utilisé, il est retiré. La seringue est fixée à l’aiguille, puis le piston poussé pendant que l’aiguille oscille plusieurs fois dans divers plans. Après équilibrage des pressions, l’aiguille est retirée du patient, puis retirée de la seringue. De l’air est introduit dans la seringue qui est ensuite reconnectée à l’aiguille. Le matériel présent dans l’aiguille est extrait sur des lames de verre, dispersé, puis immédiatement immergé dans un liquide composé d’éthanol à 95 %. L’aiguille est ensuite rincée dans une solution saline, dans le flacon ThinPrep®ou dans du RPMI. Pour les lésions thoraco-abdominales et les ganglions lymphatiques, le patient reste généralement pendant la coloration et l’interprétation rapides des lames (qualité, tri et diagnostic). Les lésions thyroïdiennes sont généralement soumises à trois « passages » par cible, puis le matériel est coloré et évalué après l’échographie.
 |
Types d’échantillons prélevés par cytoponction à l’aiguille fine
Un prélèvement avec une aiguille 22 G peut être réalisé sur tous les sites corporels, y compris les plus singuliers comme le cerveau, les orbites oculaires, les testicules et le pénis. L’approche est modifiée selon le site, mais la technique reste la même. Le matériel prélevé par cytoponction sur des tumeurs contient quasiment toujours des cellules reflétant une architecture histologique qui permet de classer la lésion comme carcinome, sarcome, lymphome, mélanome ou tumeur maligne indifférenciée.
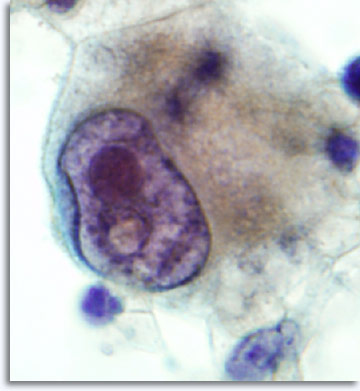
|
Si l’architecture ne permet pas d’établir un diagnostic spécifique et de classer la tumeur dans une catégorie, d’autres techniques comme l’immunocytochimie peuvent fournir des informations moléculaires facilitant la classification. Pour les processus infectieux, on peut isoler des agents étiologiques spécifiques d’infection à l’aide de différentes colorations (Papanicolaou, Giemsa pour les bactéries, Ziehl-Neelsen pour les bacilles acidorésistants, PAS et GMS pour les champignons).
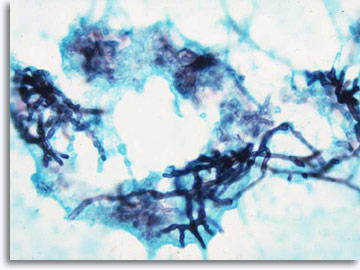
|
La présentation des échantillons peut varier légèrement selon que les cellules sont placées directement sur les lames ou traitées par le biais de la technologie ThinPrep®en milieu liquide. Immédiatement après le prélèvement, le frottis contient des débris et du sang dans le fond, le noyau des cellules malignes apparaissant généralement plus hyperchromatique et dense. Avec la méthode ThinPrep, l’agrégation cellulaire est conservée, le sang présent dans le fond est lysé et le noyau des cellules malignes paraît moins dense et hyperchromatique. Une exception : la vésiculation d’aspect verre dépoli caractéristique du carcinome papillaire de la thyroïde, dans lequel les changements optiques des noyaux sont similaires dans les présentations conventionnelles et celles en milieu liquide.
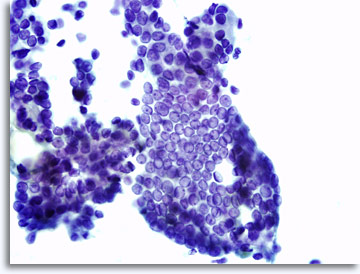 |
Frottis après prélèvement
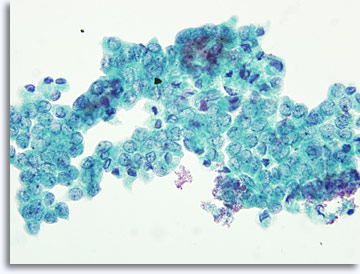 |
ThinPrep®
L’American Society of Cytopathology et la Papanicolaou Society rédigent des consignes visant à garantir la qualité des échantillons pour des sites spécifiques. Les consignes relatives à la cytoponction mammaire sont en cours de développement par l’ASC, tandis que la Papanicolaou Society a fourni des consignes spécifiques pour la thyroïde et les poumons. Sans normalisation définitive, la qualité des prélèvements est soumise à une certaine subjectivité qui varie avec l’expérience du personnel chargé de l’interprétation. Hologic, Inc. accumule des informations sur ce qui constitue des échantillons corrects recueillis et traités en milieu liquide. Pour cela, nous référençons des exemples d’échantillons non satisfaisants (ne contenant que du sang, contenant de la fibrine sans épithélium pour les kystes, représentant uniquement une inflammation, colloïde thyroïdien sans cellule, etc.) Une interprétation rapide au moment de la cytoponction fournit une évaluation immédiate de la qualité et permet une prise en charge clinique appropriée si un diagnostic définitif peut être établi.
Aspects financiers
Si l’on compare le coût d’une cytoponction à l’aiguille fine avec celui d’une biopsie conventionnelle, on obtient immédiatement des économies spectaculaires, en particulier quand la cytoponction est effectuée en soin externe. La réduction du coût des soins passe par une technique productive, ce qui est le cas de la cytoponction à l’aiguille fine. En effet, le recueil de cellules par une technique relativement économique qui en outre évite l’hospitalisation et oriente les patients vers des protocoles thérapeutiques non chirurgicaux (y compris les traitements ciblés) offre un avantage financier, ainsi qu’un accès plus immédiat aux soins dans un système de santé débordé. Du point de vue de l’établissement hospitalier, cette technique permet une gestion plus efficace des ressources opératoires et l’utilisation de ces ressources pour d’autres interventions. Dans les hôpitaux publics surchargés, l’avantage est évident puisque les patients subissant une cytoponction ne doivent pas être hospitalisés. Grâce à la cytoponction à l’aiguille fine, des chirurgiens, anesthésistes, infirmiers, techniciens en histologie et pathologistes peuvent se consacrer à des tâches thérapeutiques et analytiques post-biopsie. On peut ainsi réduire la charge de travail (et le volume) du personnel tout en maintenant la qualité des soins.
La Sécurité sociale et autres organismes d’assurance maladie remboursent les frais professionnels et techniques de la ponction, laquelle permet d’évaluer immédiatement la qualité des échantillons, d’établir un diagnostic, d’interpréter le prélèvement, d’examiner des préparations accessoires (par ex., traitement ThinPrep® et cytoblocs) et d’utiliser un nombre spécifique de marqueurs pour l’immunocytochimie et la cytométrie de flux. Les sites nécessitant plusieurs « passages » (par ex. nodule thyroïdien unilatéral) sont remboursés sur la base d’un honoraire. Une cytoponction impliquant plusieurs sites (par ex. nodules thyroïdiens bilatéraux) est remboursée en fonction du nombre de sites. Voici les codes CPT facilitant la facturation :
| Code CPT | Description |
| 10021 | Cytoponction à l’aiguille fine sans guidage radiographique |
| 88172 | Évaluation immédiate de la qualité de l’échantillon |
| 88173 | Interprétation de l’échantillon et rapport |
| 88305 | Cytobloc |
| 88173 | ThinPrep, Cytospin |
| 88180 | Cytométrie de flux |
| 87070 | Culture de routine |
| 88305 | Biopsie au trocart |
| 87102 | Culture de bacilles acidorésistants |
| 87116 | Culture de champignons |
| 88342 | Immunocytochimie |
| 88312 | Colorations spéciales |
Conclusion :
Nous avons le privilège de pratiquer la cytopathologie dans un environnement médical avancé qui met en relation la morphologie avec la micro-anatomie, permet d’établir des diagnostics moléculaires et d’assurer une prise en charge clinique de qualité. La cytologie joue un rôle essentiel dans la détection, le diagnostic et la classification des cancers, ainsi que dans l’amélioration des résultats. La cytoponction à l’aiguille fine représente un outil unique fournissant des informations diagnostiques sûres, immédiates, précises équivalentes aux tissus, à moindre coût, en réduisant les traumatismes et risques de complications tout en garantissant la satisfaction des patients. Elle complète l’imagerie radiographique dans l’exploration du corps humain et dans la recherche diagnostique moléculaire, génétique et thérapeutique. Son application à la cytologie en milieu liquide laisse espérer une plus grande diversité et précision.
