Le sein se compose de graisse et de stroma supportant les tissues glandulaires, ainsi que d’un système canalaire avec ramifications menant à 6-10 canaux principaux et s’ouvrant sur le mamelon. Des lésions bénignes et malignes peuvent s’y développer. Chez les jeunes femmes, l’adénofibrome représente la lésion la plus courante. Chez les femmes plus âgées, on trouve davantage de changements fibrokystiques. Les autres lésions bénignes incluent l’adiponécrose et des pathologies inflammatoires comme l’abcès mammaire et la mastite. On peut également trouver des lésions bénignes moins courantes comme les hamartomes et l’hyperplasie pseudo-angiomateuse. L’hyperplasie canalaire fait partie des changements fibrokystiques. L’hyperplasie canalaire atypique peut être difficile à distinguer du carcinome canalaire in situ de bas grade et ces lésions représentent un spectre de pathologies susceptibles de développer un cancer du sein. Les changements dus à la radiothérapie peuvent produire une masse cytologiquement assimilable à une lésion atypique. De même, les changements dus à la grossesse et à l’allaitement peuvent être à tort assimilés à une tumeur maligne. Les données cliniques sont donc essentielles à l’établissement d’un diagnostic cytologique précis.
Les tumeurs mammaires malignes peuvent être primitives ou métastatiques (ces dernières incluant le lymphome, le mélanome malin et d’autres tumeurs secondaires comme des carcinomes rénaux, bronchiques, ovariens ou pulmonaires). D’un point de vue diagnostique, le carcinome primitif du sein de type canalaire (sans autre précision) représente la tumeur la plus courante. Vient ensuite le néoplasme mammaire primitif (carcinome lobulaire). La biopsie des excisions permet plus facilement d’établir un diagnostic de carcinome canalaire in situ et de carcinome lobulaire in situ que la cytologie.
La cytologie mammaire sert au dépistage et au diagnostic. Toutes les lésions détectées sur une mammographie peuvent être prélevées avec une aiguille fine, soit par ponction directe (lésions palpables) soit par guidage stéréotaxique ou échographique (lésions non palpables). Si l’échantillon cytologique n’est pas satisfaisant ou est équivoque, on peut avoir recours à la biopsie au trocart ou à des coupes sous congélation. Les ponctions sont faciles à réaliser sur les masses mammaires palpables. Ces prélèvements peuvent ensuite être rapidement traités pour établir un diagnostic rapide.
La cytologie des cytoponctions à l’aiguille fine constitue un outil utile dans le diagnostic des lésions mammaires, qu’elles soient ou non palpables. Il s’agit d’une procédure sûre, rapide, économique (par rapport aux biopsies au trocart) et relativement peu douloureuse qui peut être réalisée par des cliniciens et des pathologistes. Les cytopathologistes peuvent ensuite avoir recours à des colorations rapides pour évaluer la qualité de l’échantillon et recommencer la procédure si nécessaire. Avec des cytopathologistes expérimentés, la corrélation cyto-histologique est excellente. Un inconvénient mineur de la cytoponction à l’aiguille fine réside dans le fait qu’il n’est pas toujours possible de faire la distinction entre des lésions invasives et in situ. La biopsie au trocart semble être associée à des problèmes similaires dans certains cas.
Le matériel aspiré est étalé sur une lame de verre ou extrait dans une solution Cytolyt®. L’aiguille est rincée avec la même solution pour chaque passage effectué. Comme le liquide peut être utilisé pour plusieurs lames presque identiques, le laboratoire conserve du matériel pour des colorations spéciales (récepteurs d’œstrogène / progestérone, surexpression de HER2/neu, etc.)
Les ponctions de mastite et abcès mammaire contiennent des neutrophiles en abondance, des histiocytes, des histiocytes géants multinucléés, quelques cellules épithéliales en cours de dégénérescence et du matériel protéinacé pouvant imiter la nécrose. Ces caractéristiques sont assez fréquentes chez les femmes qui allaitent. L’adiponécrose se développe à la suite d’un traumatisme (coup direct dans le sein, intervention chirurgicale ou radiothérapie). D’un point de vue clinique et mammographique, cette affection imite le carcinome du sein, avec une masse irrégulière et dure. En revanche, l’échantillon permet d’établir un diagnostic, car il se compose d’adipocytes en cours de dégénérescence avec lipophages abondants.
L’adénofibrome se présente sous la forme d’une masse mammaire ferme, lisse et mobile. Elle a généralement un aspect caoutchouteux et agrippe la pointe de l’aiguille. Les échantillons sont en général cellulaires avec de grands amas de cellules canalaires bénignes avec ramifications et quelques « graines de sésame » à la surface (cellules myoépithéliales). Sur les lames ThinPrep, des cellules myoépithéliales isolées dans le fond ont tendance à s’accumuler à côté des cellules canalaires (lesquelles affichent souvent un chevauchement suggérant un élément d’hyperplasie canalaire). On observe également des fragments stromaux de taille variable contenant des noyaux fuselés.
Les tumeurs phyllodes de bas grade ont également une composition fibro-épithéliale, l’élément glandulaire imitant de près l’adénofibrome. Cependant, l’hyperplasie canalaire est beaucoup plus fréquente dans les tumeurs phyllodes. Les composants stromaux ont tendance à être proéminents, avec de larges fragments hypercellulaires. On peut également noter des groupes contenant de nombreuses cellules stromales. Les tumeurs phyllodes malignes affichent des caractéristiques sans équivoque.
Le changement fibrokystique est une lésion relativement courante englobant les modifications kystiques avec métaplasie apocrine, hyperplasie canalaire de type courant et autres formes d’épithéliose. L’aspect cytologique de ces lésions inclut des amas et groupes de cellules canalaires bénignes superposées avec cellules myoépithéliales, métaplasie apocrine, macrophages mousseux et calcium. D’un point de vue cytologique, ces caractéristiques peuvent imiter celles de l’adénofibrome, mais l’examen clinique révèle généralement un épaississement mal défini ou une arête à la place de la masse mobile lisse de l’adénofibrome. Les changements fibrokystiques peuvent évoluer pour former des kystes palpables faciles à aspirer. Le liquide peut être clair et incolore ou trouble, marron, vert ou taché de sang. Les liquides kystiques contiennent du matériel protéinacé, des cellules canalaires bénignes d’aspect dégénéré ou légèrement atypique, des cellules apocrines métaplasiques et des macrophages mousseux. Un liquide marron ou vert indique généralement un saignement antérieur, confirmé par la présence de macrophages chargés d’hémosidérine sur la lame. Les cellules apocrines métaplasiques présentent un cytoplasme granulaire abondant, des noyaux ronds et nucléoles proéminents. Elles peuvent être binucléées et paraître atypiques en raison de leur taille nucléaire variable.
La myosphérulose collagène est une lésion bénigne pouvant accompagner l’hyperplasie canalaire ou lobulaire. Les prélèvements comportent des globules de matériel extracellulaire (bleu pâle avec la coloration de Papanicolaou et magenta avec DiffQuik), une métaplasie apocrine canalaire bénigne et des cellules myoépithéliales. Le diagnostic différentiel inclut le carcinome kystique adénoïde.
Le carcinome canalaire a tendance à être unilatéral. Il se présente cliniquement sous la forme d’une masse dure irrégulière qui, sur la mammographie, a l’aspect caractéristique d’une masse, d’une lésion à spicules ou de microcalcifications. Même si le carcinome canalaire in situ est censé précéder le carcinome canalaire invasif, il peut également accompagner le carcinome lobulaire invasif. De même, le carcinome lobulaire in situ peut être associé à un carcinome canalaire et à un carcinome lobulaire invasif. Les prélèvements de carcinome canalaire in situ effectués par cytoponction affichent des caractéristiques malignes, mais ils peuvent également comporter des cellules myoépithéliales qui recouvrent les groupes de cellules. Les prélèvements de carcinome canalaire invasif (sans autre précision) sont cellulaires et se composent de grandes cellules tumorales souvent pléomorphes. Le carcinome canalaire de bas grade peut être confondu avec des cellules canalaires bénignes. L’invasion est suggérée par la présence de cellules tumorales qui s’infiltrent entre les adipocytes.
Le carcinome lobulaire est souvent bilatéral. Cliniquement, la tumeur est bien définie et n’a pas d’aspect mammographique type. Le carcinome lobulaire in situ se présente sous la forme de groupes arrondis de petites cellules malignes, certaines affichant des vacuoles intracytoplasmiques, souvent recouvertes par des cellules myoépithéliales. Comme les cytoponctions de carcinome lobulaire invasif donnent lieu à des échantillons comportant peu de matériel, ces prélèvements sont souvent classés dans la catégorie « Non satisfaisant » ou « Atypique ». Les cellules sont plus petites que dans le carcinome canalaire ; elles se présentent souvent sous forme isolée avec noyaux excentrés et vacuoles intracytoplasmiques. On n’observe généralement aucun nucléole. Les cellules siègent souvent dans un groupe unique. Les prélèvements de carcinome lobulaire peuvent contenir des cellules en anneau.
On trouve également des types spéciaux de carcinome canalaire : tubulaire, colloïde (mucineux), métaplasique, médullaire, apocrine et malpighien. Pour pouvoir être classée dans un type particulier, une lésion tumorale mammaire doit afficher plus de 90 % des caractéristiques propres à ce type. Comme la cytologie n’examine qu’une partie de la tumeur, elle ne permet pas de la classer avec précision comme cytologiquement tubulaire ou mucineuse. La suspicion peut être indiquée dans le résultat en incluant une définition telle que « carcinome canalaire avec caractéristiques mucineuses ou tubulaires » au lieu de l’associer à un type définitif (susceptible d’être différent de celui établi avec l’échantillon prélevé par excision). Le carcinome tubulaire se compose de structures tubulaires et acineuses. Les échantillons de carcinome mucineux sont souvent grossièrement mucoïdes et contiennent de la mucine en abondance. Certaines pathologies rares comme le carcinome kystique adénoïde (identique à celui de la glande salivaire) peuvent également se développer. Cette tumeur imite la myosphérulose collagène bénigne car elle contient également du matériel hyalin extracellulaire qui a les mêmes caractéristiques de coloration, mais se présente sous la forme de globules et de structures tubulaires ou cylindriques. Les cellules tumorales sont petites, ternes avec peu de cytoplasme ; on ne note aucune cellule canalaire bénigne, apocrine ni métaplasique.
Rappel : Vous pouvez cliquer sur une image
de l’Atlas pour la voir dans un format plus grand.
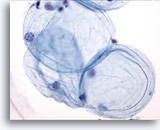
Figure 1
Cytoponction mammaire à l’aiguille fine, cellule adipeuse.
Les cellules adipeuses (ou adipocytes) sont de grandes cellules sphériques avec cytoplasme translucide et petits noyaux excentrés. On les trouve dans les échantillons bénins et malins.
40x
Figure 1
Cytoponction mammaire à l’aiguille fine, cellule adipeuse.
Les cellules adipeuses (ou adipocytes) sont de grandes cellules sphériques avec cytoplasme translucide et petits noyaux excentrés. On les trouve dans les échantillons bénins et malins.
40x
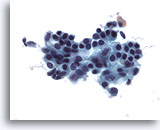
Figure 2
Cytoponction mammaire à l’aiguille fine, cellules canalaires bénignes.
Les prélèvements normaux du sein contiennent des cellules canalaires bénignes, souvent accompagnées de cellules myoépithéliales.
40x
Figure 2
Cytoponction mammaire à l’aiguille fine, cellules canalaires bénignes.
Les prélèvements normaux du sein contiennent des cellules canalaires bénignes, souvent accompagnées de cellules myoépithéliales.
40x
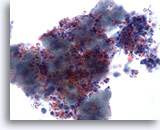
Figure 3
Cytoponction mammaire à l’aiguille fine, abcès.
Les prélèvements d’abcès du sein effectués par cytoponction à l’aiguille fine ne comportent généralement pas de cellules épithéliales. Les débris cellulaires, hématies lysées et neutrophiles sont des caractéristiques courantes de cette affection.
40x
Figure 3
Cytoponction mammaire à l’aiguille fine, abcès.
Les prélèvements d’abcès du sein effectués par cytoponction à l’aiguille fine ne comportent généralement pas de cellules épithéliales. Les débris cellulaires, hématies lysées et neutrophiles sont des caractéristiques courantes de cette affection.
40x
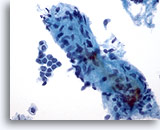
Figure 4: Cytoponction mammaire à l’aiguille fine, adénofibrome.
Présence d’un important fragment stromal contenant quelques petits noyaux fuselés. Les fragments stromaux peuvent être observés dans les liquides contenant des tissus mammaires bénins, mais également dans les lésions fibro-épithéliales comme l’adénofibrome. Les fragments stromaux provenant des tumeurs phyllodes sont beaucoup plus cellulaires. Noter la présence d’un petit groupe de cellules canalaires bénignes.
40x
Figure 4
Cytoponction mammaire à l’aiguille fine, adénofibrome.
Présence d’un important fragment stromal contenant quelques petits noyaux fuselés. Les fragments stromaux peuvent être observés dans les liquides contenant des tissus mammaires bénins, mais également dans les lésions fibro-épithéliales comme l’adénofibrome. Les fragments stromaux provenant des tumeurs phyllodes sont beaucoup plus cellulaires. Noter la présence d’un petit groupe de cellules canalaires bénignes.
40x
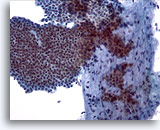
Figure 5
Cytoponction mammaire à l’aiguille fine, adénofibrome.
Gros amas (avec ramifications) de cellules canalaires bénignes uniformes et cohésives recouvrant un fragment stromal. Noter les petits noyaux quelque peu fuselés des cellules stromales dans le fragment stromal.
20x
Figure 5
Cytoponction mammaire à l’aiguille fine, adénofibrome.
Gros amas (avec ramifications) de cellules canalaires bénignes uniformes et cohésives recouvrant un fragment stromal. Noter les petits noyaux quelque peu fuselés des cellules stromales dans le fragment stromal.
20x
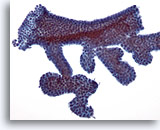
Figure 6
Cytoponction mammaire à l’aiguille fine, adénofibrome.
En général, les prélèvements d’adénofibrome contiennent de gros amas avec ramifications de cellules canalaires bénignes (comme sur cette figure).
20x
Figure 6
Cytoponction mammaire à l’aiguille fine, adénofibrome.
En général, les prélèvements d’adénofibrome contiennent de gros amas avec ramifications de cellules canalaires bénignes (comme sur cette figure).
20x
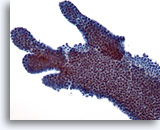
Figure 7
Cytoponction mammaire à l’aiguille fine, adénofibrome.
Autre exemple de cellules canalaires avec ramifications observées dans l’adénofibrome.
20x
Figure 7
Cytoponction mammaire à l’aiguille fine, adénofibrome.
Autre exemple de cellules canalaires avec ramifications observées dans l’adénofibrome.
20x
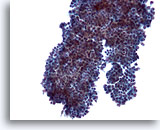
Figure 8
Cytoponction mammaire à l’aiguille fine, adénofibrome.
Dans certains cas, les groupes de cellules canalaires présentent de petites projections arrondies (comme ici) au lieu des longues branches observées sur les deux figures précédentes.
20x
Figure 8
Cytoponction mammaire à l’aiguille fine, adénofibrome.
Dans certains cas, les groupes de cellules canalaires présentent de petites projections arrondies (comme ici) au lieu des longues branches observées sur les deux figures précédentes.
20x
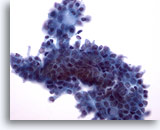
Figure 9: Cytoponction mammaire à l’aiguille fine, adénofibrome.
Dans ce champ, les bords du groupe canalaire ne sont pas lisses comme sur les deux images précédentes, probablement en raison du traitement en milieu liquide. A noter, quelques cellules myoépithéliales à l’intérieur du groupe de cellules canalaires et sur le bord supérieur. Sur les lames ThinPrep, on observe souvent les cellules myoépithéliales à côté des groupes canalaires au lieu d’être dispersées dans le fond comme sur les frottis conventionnels.
40x
Figure 9
Cytoponction mammaire à l’aiguille fine, adénofibrome.
Dans ce champ, les bords du groupe canalaire ne sont pas lisses comme sur les deux images précédentes, probablement en raison du traitement en milieu liquide. A noter, quelques cellules myoépithéliales à l’intérieur du groupe de cellules canalaires et sur le bord supérieur. Sur les lames ThinPrep, on observe souvent les cellules myoépithéliales à côté des groupes canalaires au lieu d’être dispersées dans le fond comme sur les frottis conventionnels.
40x
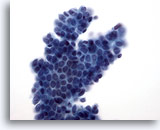
Figure 10
Cytoponction mammaire à l’aiguille fine, adénofibrome.
L’amas avec ramifications de cellules canalaires bénignes recouvertes de cellules myoépithéliales produit l’aspect caractéristique de « graine de sésame sur un petit pain ».
40x
Figure 10
Cytoponction mammaire à l’aiguille fine, adénofibrome.
L’amas avec ramifications de cellules canalaires bénignes recouvertes de cellules myoépithéliales produit l’aspect caractéristique de « graine de sésame sur un petit pain ».
40x
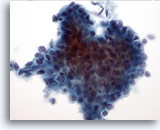
Figure 11: Cytoponction mammaire à l’aiguille fine, tumeur phyllode de bas grade.
Comme les adénofibromes, les tumeurs phyllodes sont également des lésions fibro-épithéliales. Néanmoins, même les lésions de bas grade peuvent réapparaître si elles ne font pas l’objet d’une excision avec marge importante. Le composant glandulaire est similaire à celui observé dans l’adénofibrome, mais il est beaucoup plus cellulaire et d’aspect hyperplasique. Cette image illustre un groupe 3D de cellules canalaires avec superposition et encombrement nucléaires suggérant des changements hyperplasiques.
40x
Figure 11
Cytoponction mammaire à l’aiguille fine, tumeur phyllode de bas grade.
Comme les adénofibromes, les tumeurs phyllodes sont également des lésions fibro-épithéliales. Néanmoins, même les lésions de bas grade peuvent réapparaître si elles ne font pas l’objet d’une excision avec marge importante. Le composant glandulaire est similaire à celui observé dans l’adénofibrome, mais il est beaucoup plus cellulaire et d’aspect hyperplasique. Cette image illustre un groupe 3D de cellules canalaires avec superposition et encombrement nucléaires suggérant des changements hyperplasiques.
40x
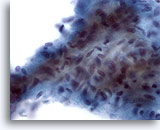
Figure 12
Cytoponction mammaire à l’aiguille fine, tumeur phyllode de bas grade.
Ce fragment stromal est hypercellulaire et contient de grosses cellules fuselées encombrées. De nombreuses cellules stromales fuselées isolées peuvent également être observées dans le fond de cette lésion.
60x
Figure 12
Cytoponction mammaire à l’aiguille fine, tumeur phyllode de bas grade.
Ce fragment stromal est hypercellulaire et contient de grosses cellules fuselées encombrées. De nombreuses cellules stromales fuselées isolées peuvent également être observées dans le fond de cette lésion.
60x
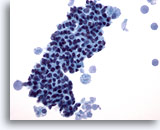
Figure 13
Cytoponction mammaire à l’aiguille fine, changements fibrokystiques.
Ce champ montre un groupe serré de cellules canalaires bénignes avec macrophages mousseux à chaque extrémité, matériel sécrétoire dans le fond.
40x
Figure 13
Cytoponction mammaire à l’aiguille fine, changements fibrokystiques.
Ce champ montre un groupe serré de cellules canalaires bénignes avec macrophages mousseux à chaque extrémité, matériel sécrétoire dans le fond.
40x
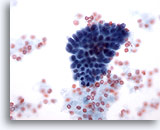
Figure 14
Cytoponction mammaire à l’aiguille fine, changements fibrokystiques.
Ce petit groupe de cellules canalaires bénignes provient d’un échantillon montrant des changements fibrokystiques.
40x
Figure 14
Cytoponction mammaire à l’aiguille fine, changements fibrokystiques.
Ce petit groupe de cellules canalaires bénignes provient d’un échantillon montrant des changements fibrokystiques.
40x
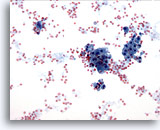
Figure 15
Cytoponction mammaire à l’aiguille fine, changements fibrokystiques.
Changements fibrokystiques impliquant une sécrétion, du sang et des cellules apocrines métaplasiques dans le fond.
20x
Figure 15
Cytoponction mammaire à l’aiguille fine, changements fibrokystiques.
Changements fibrokystiques impliquant une sécrétion, du sang et des cellules apocrines métaplasiques dans le fond.
20x
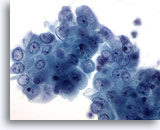
Figure 16
Cytoponction mammaire à l’aiguille fine, kyste.
Ce groupe de cellules canalaires bénignes fait apparaître une légère atypie sous la forme de nucléoles visibles et d’une légère augmentation de la taille nucléaire. Ces changements minimes sont souvent observés dans les kystes du sein.
60x
Figure 16
Cytoponction mammaire à l’aiguille fine, kyste.
Ce groupe de cellules canalaires bénignes fait apparaître une légère atypie sous la forme de nucléoles visibles et d’une légère augmentation de la taille nucléaire. Ces changements minimes sont souvent observés dans les kystes du sein.
60x
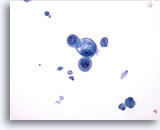
Figure 17
Cytoponction mammaire à l’aiguille fine, kyste.
Ce champ montre un petit groupe de cellules épithéliales bénignes, dont l’une est vacuolisée, avec des débris kystiques dans le fond.
40x
Figure 17
Cytoponction mammaire à l’aiguille fine, kyste.
Ce champ montre un petit groupe de cellules épithéliales bénignes, dont l’une est vacuolisée, avec des débris kystiques dans le fond.
40x
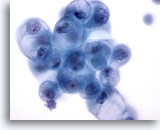
Figure 18
Cytoponction mammaire à l’aiguille fine, kyste.
Dans un échantillon kystique, les cellules canalaires bénignes peuvent, comme ici, présenter une vacuolisation dégénérative. Ces changements ne doivent pas être interprétés comme un signe de cancer.
60x
Figure 18
Cytoponction mammaire à l’aiguille fine, kyste.
Dans un échantillon kystique, les cellules canalaires bénignes peuvent, comme ici, présenter une vacuolisation dégénérative. Ces changements ne doivent pas être interprétés comme un signe de cancer.
60x
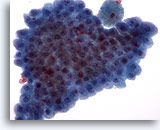
Figure 19
Cytoponction mammaire à l’aiguille fine, métaplasie apocrine.
Les cellules apocrines bénignes siègent souvent dans des amas plats. Elles sont courantes dans prélèvements de kyste mammaire et les prélèvements effectués à l’aiguille fine sur des sites de changement fibrokystique.
40x
Figure 19
Cytoponction mammaire à l’aiguille fine, métaplasie apocrine.
Les cellules apocrines bénignes siègent souvent dans des amas plats. Elles sont courantes dans prélèvements de kyste mammaire et les prélèvements effectués à l’aiguille fine sur des sites de changement fibrokystique.
40x
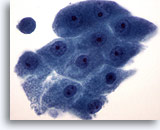
Figure 20
Cytoponction mammaire à l’aiguille fine, métaplasie apocrine.
Les cellules apocrines présentent un cytoplasme granulaire abondant et des noyaux ronds avec nucléoles proéminents. Leurs bordures cytoplasmiques sont en général clairement définies.
60x
Figure 20
Cytoponction mammaire à l’aiguille fine, métaplasie apocrine.
Les cellules apocrines présentent un cytoplasme granulaire abondant et des noyaux ronds avec nucléoles proéminents. Leurs bordures cytoplasmiques sont en général clairement définies.
60x
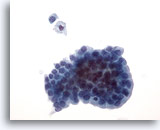
Figure 21: Cytoponction mammaire à l’aiguille fine, lésion papillaire kystique.
Les prélèvements de lésions papillaires kystiques contiennent des cellules épithéliales et des macrophages mousseux. Les cellules canalaires bénignes de ce groupe sont de taille et de forme uniformes. Elles présentent une configuration en palissade le long d’un côté. Noter le macrophage mousseux et la cellule canalaire bénigne isolée au-dessus du groupe. Si l’on se trouve en présence d’une légère atypie cellulaire, il peut s’avérer difficile de faire la distinction entre une lésion bénigne et une lésion papillaire maligne.
40x
Figure 21
Cytoponction mammaire à l’aiguille fine, lésion papillaire kystique.
Les prélèvements de lésions papillaires kystiques contiennent des cellules épithéliales et des macrophages mousseux. Les cellules canalaires bénignes de ce groupe sont de taille et de forme uniformes. Elles présentent une configuration en palissade le long d’un côté. Noter le macrophage mousseux et la cellule canalaire bénigne isolée au-dessus du groupe. Si l’on se trouve en présence d’une légère atypie cellulaire, il peut s’avérer difficile de faire la distinction entre une lésion bénigne et une lésion papillaire maligne.
40x
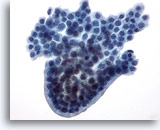
Figure 22
Cytoponction mammaire à l’aiguille fine, lésion papillaire kystique.
Ce groupe de cellules canalaires bénignes présente un bord arrondi en palissade, ce qui donne l’aspect d’une structure papillaire, bien que l’on n’observe aucun cœur fibrovasculaire.
40x
Figure 22
Cytoponction mammaire à l’aiguille fine, lésion papillaire kystique.
Ce groupe de cellules canalaires bénignes présente un bord arrondi en palissade, ce qui donne l’aspect d’une structure papillaire, bien que l’on n’observe aucun cœur fibrovasculaire.
40x
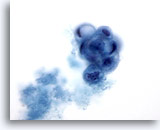
Figure 23: Cytoponction mammaire à l’aiguille fine, lésion papillaire kystique.
Ce champ montre un groupe papillaire arrondi de cellules canalaires vacuolisées en cours de dégénérescence accompagné de matériel sécrétoire. Le diagnostic d’atypie convient à ce prélèvement, car il n’est pas toujours possible de faire la distinction entre des lésions papillaires bénignes et malignes. La présence de cellules métaplasiques apocrines constitue généralement un indice de processus bénin.
60x
Figure 23
Cytoponction mammaire à l’aiguille fine, lésion papillaire kystique.
Ce champ montre un groupe papillaire arrondi de cellules canalaires vacuolisées en cours de dégénérescence accompagné de matériel sécrétoire. Le diagnostic d’atypie convient à ce prélèvement, car il n’est pas toujours possible de faire la distinction entre des lésions papillaires bénignes et malignes. La présence de cellules métaplasiques apocrines constitue généralement un indice de processus bénin.
60x
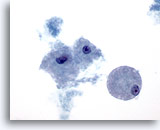
Figure 24
Cytoponction mammaire à l’aiguille fine, lésion papillaire kystique.
Les macrophages mousseux observés ici sont présents dans les lésions kystiques bénignes et malignes, qu’elles soient ou non papillaires.
60x
Figure 24
Cytoponction mammaire à l’aiguille fine, lésion papillaire kystique.
Les macrophages mousseux observés ici sont présents dans les lésions kystiques bénignes et malignes, qu’elles soient ou non papillaires.
60x
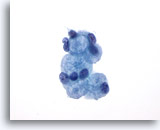
Figure 25: Cytoponction mammaire à l’aiguille fine, myosphérulose collagène.
Cette lésion bénigne fait généralement partie des résultats secondaires des biopsies mammaires. Elle forme rarement une masse palpable. Cet échantillon contient des indications d’hyperplasie canalaire bénigne, de cellules métaplasiques canalaires et apocrines bénignes, de cellules myoépithéliales et de globules de matériel extracellulaire entourés de petites cellules épithéliales bénignes. Les prélèvements de carcinome kystique adénoïde du sein présentent les mêmes caractéristiques.
60x
Figure 25
Cytoponction mammaire à l’aiguille fine, myosphérulose collagène.
Cette lésion bénigne fait généralement partie des résultats secondaires des biopsies mammaires. Elle forme rarement une masse palpable. Cet échantillon contient des indications d’hyperplasie canalaire bénigne, de cellules métaplasiques canalaires et apocrines bénignes, de cellules myoépithéliales et de globules de matériel extracellulaire entourés de petites cellules épithéliales bénignes. Les prélèvements de carcinome kystique adénoïde du sein présentent les mêmes caractéristiques.
60x
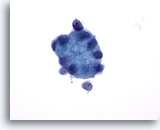
Figure 26
Cytoponction mammaire à l’aiguille fine, myosphérulose collagène.
Gros globule de matériel hyalin entouré de petites cellules épithéliales.
60x
Figure 26
Cytoponction mammaire à l’aiguille fine, myosphérulose collagène.
Gros globule de matériel hyalin entouré de petites cellules épithéliales.
60x
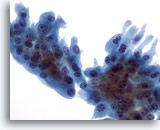
Figure 27
Cytoponction mammaire à l’aiguille fine, myosphérulose collagène/métaplasie apocrine.
La présence d’un amas de cellules métaplasiques apocrines avec cytoplasme relativement abondant dans l’échantillon du cas illustré ci-dessus permet d’établir un diagnostic de myosphérulose collagène.
40x
Figure 27
Cytoponction mammaire à l’aiguille fine, myosphérulose collagène/métaplasie apocrine.
La présence d’un amas de cellules métaplasiques apocrines avec cytoplasme relativement abondant dans l’échantillon du cas illustré ci-dessus permet d’établir un diagnostic de myosphérulose collagène.
40x
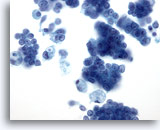
Figure 28: Cytoponction mammaire à l’aiguille fine, carcinome canalaire in situ.
Échantillon cellulaire avec groupes de cellules tumorales, cellules malignes isolées et macrophages mousseux. Le carcinome canalaire in situ (CCIS) comporte souvent des cellules myoépithéliales recouvrant les groupes de cellules malignes. Comme dans les tumeurs invasives, les cellules tumorales ont tendance à se présenter en groupes plutôt que sous forme isolée. En outre, aucune structure tubulaire n’est associée au CCIS. Le comédocarcinome canalaire in situ est de façon caractéristique associé à la présence de nécrose et de calcium.
40x
Figure 28
Cytoponction mammaire à l’aiguille fine, carcinome canalaire in situ.
Échantillon cellulaire avec groupes de cellules tumorales, cellules malignes isolées et macrophages mousseux. Le carcinome canalaire in situ (CCIS) comporte souvent des cellules myoépithéliales recouvrant les groupes de cellules malignes. Comme dans les tumeurs invasives, les cellules tumorales ont tendance à se présenter en groupes plutôt que sous forme isolée. En outre, aucune structure tubulaire n’est associée au CCIS. Le comédocarcinome canalaire in situ est de façon caractéristique associé à la présence de nécrose et de calcium.
40x
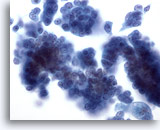
Figure 29
Cytoponction mammaire à l’aiguille fine, carcinome canalaire in situ.
Groupes de cellules tumorales relativement ternes. Vague impression de cœur fibrovasculaire dans le groupe de cellules situé sur la droite.
40x
Figure 29
Cytoponction mammaire à l’aiguille fine, carcinome canalaire in situ.
Groupes de cellules tumorales relativement ternes. Vague impression de cœur fibrovasculaire dans le groupe de cellules situé sur la droite.
40x
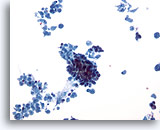
Figure 30
Cytoponction mammaire à l’aiguille fine, carcinome canalaire.
Ce faible grossissement permet d’observer une nécrose cellulaire abondante avec un groupe serré de cellules au centre. Nous sommes ici en présence d’un cas de carcinome canalaire invasif.
20x
Figure 30
Cytoponction mammaire à l’aiguille fine, carcinome canalaire.
Ce faible grossissement permet d’observer une nécrose cellulaire abondante avec un groupe serré de cellules au centre. Nous sommes ici en présence d’un cas de carcinome canalaire invasif.
20x
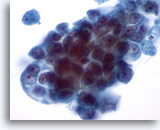
Figure 31
Cytoponction mammaire à l’aiguille fine, carcinome canalaire.
Un plus fort grossissement fait apparaître l’encombrement et les nucléoles proéminents des cellules néoplasiques. Bien que pâle, la chromatine est anormale.
60x
Figure 31
Cytoponction mammaire à l’aiguille fine, carcinome canalaire.
Un plus fort grossissement fait apparaître l’encombrement et les nucléoles proéminents des cellules néoplasiques. Bien que pâle, la chromatine est anormale.
60x
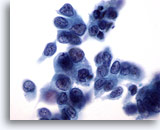
Figure 32
Cytoponction mammaire à l’aiguille fine, carcinome canalaire.
Les cellules tumorales de ce champ présentent une certaine dissociation, un pléomorphisme, une irrégularité nucléaire, une hyperchromasie et des nucléoles.
60x
Figure 32
Cytoponction mammaire à l’aiguille fine, carcinome canalaire.
Les cellules tumorales de ce champ présentent une certaine dissociation, un pléomorphisme, une irrégularité nucléaire, une hyperchromasie et des nucléoles.
60x
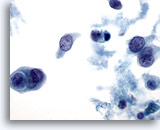
Figure 33
Cytoponction mammaire à l’aiguille fine, carcinome canalaire.
Nécrose, cannibalisme au sein des cellules tumorales et dissociation cellulaire.
60x
Figure 33
Cytoponction mammaire à l’aiguille fine, carcinome canalaire.
Nécrose, cannibalisme au sein des cellules tumorales et dissociation cellulaire.
60x
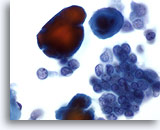
Figure 34
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de bas grade.
Cellules de carcinome isolées et siégeant dans des groupes, accompagnées de particules de calcium (qui prennent une teinte rouge avec la coloration de Papanicoloau). La présence de cellules monomorphes avec marges nucléaires lisses et micronucléoles suggère un carcinome canalaire de bas grade.
60x
Figure 34
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de bas grade.
Cellules de carcinome isolées et siégeant dans des groupes, accompagnées de particules de calcium (qui prennent une teinte rouge avec la coloration de Papanicoloau). La présence de cellules monomorphes avec marges nucléaires lisses et micronucléoles suggère un carcinome canalaire de bas grade.
60x
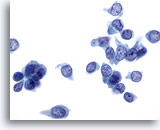
Figure 35
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de bas grade.
Ce champ comporte de nombreuses cellules de carcinome isolées. Les noyaux sont pâles mais la morphologie de la chromatine est clairement anormale. Les nucléoles ne sont pas ici augmentés en taille.
60x
Figure 35
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de bas grade.
Ce champ comporte de nombreuses cellules de carcinome isolées. Les noyaux sont pâles mais la morphologie de la chromatine est clairement anormale. Les nucléoles ne sont pas ici augmentés en taille.
60x
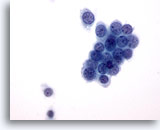
Figure 36
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de bas grade.
Exemple de carcinome canalaire de bas grade. Certaines cellules tumorales siègent dans un groupe serré. On trouve quelques cellules isolées. Noter les marges nucléaires rondes.
60x
Figure 36
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de bas grade.
Exemple de carcinome canalaire de bas grade. Certaines cellules tumorales siègent dans un groupe serré. On trouve quelques cellules isolées. Noter les marges nucléaires rondes.
60x
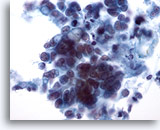
Figure 37
Cytoponction mammaire à l’aiguille fine, carcinome canalaire.
Ce champ montre des cellules tumorales isolées et siégeant dans de petits groupes. Certaines cellules semblent contenir des vacuoles intracytoplasmiques. La taille nucléaire est variable dans les groupes de cellules.
40x
Figure 37
Cytoponction mammaire à l’aiguille fine, carcinome canalaire.
Ce champ montre des cellules tumorales isolées et siégeant dans de petits groupes. Certaines cellules semblent contenir des vacuoles intracytoplasmiques. La taille nucléaire est variable dans les groupes de cellules.
40x
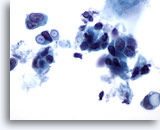
Figure 38
Cytoponction mammaire à l’aiguille fine, carcinome canalaire.
Ces cellules malignes présentent des vacuoles intracytoplasmiques clairement définies, dont certaines ont un aspect en cocarde. Même si cette caractéristique est généralement attribuée au carcinome lobulaire, on peut également la trouver dans le carcinome canalaire.
60x
Figure 38
Cytoponction mammaire à l’aiguille fine, carcinome canalaire.
Ces cellules malignes présentent des vacuoles intracytoplasmiques clairement définies, dont certaines ont un aspect en cocarde. Même si cette caractéristique est généralement attribuée au carcinome lobulaire, on peut également la trouver dans le carcinome canalaire.
60x
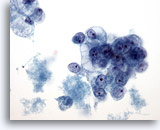
Figure 39
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de
grade 2.
Groupes de cellules malignes vacuolisées avec noyaux ronds et nucléoles proéminents. Noter la nécrose dans le fond.
40x
Figure 39
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de grade 2.
Groupes de cellules malignes vacuolisées avec noyaux ronds et nucléoles proéminents. Noter la nécrose dans le fond.
40x
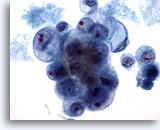
Figure 40
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de
grade 2.
Cet échantillon provient du même cas que la Figure 39 ci-dessus. Les cellules tumorales présentent une variation marquée de la taille des noyaux et nucléoles. On note la présence de nécrose. La biopsie a permis d’établir un diagnostic de carcinome canalaire modérément différencié.
60x
Figure 40
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de grade 2.
Cet échantillon provient du même cas que la Figure 39 ci-dessus. Les cellules tumorales présentent une variation marquée de la taille des noyaux et nucléoles. On note la présence de nécrose. La biopsie a permis d’établir un diagnostic de carcinome canalaire modérément différencié.
60x
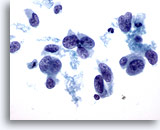
Figure 41
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de haut grade.
Ce champ illustre les variations de forme nucléaire observées dans le carcinome canalaire. Certains noyaux sont presque fuselés. La majorité des noyaux sont beaucoup plus grands que le neutrophile et le lymphocyte contigus. Motte chromatinienne et élimination de la chromatine.
60x
Figure 41
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de haut grade.
Ce champ illustre les variations de forme nucléaire observées dans le carcinome canalaire. Certains noyaux sont presque fuselés. La majorité des noyaux sont beaucoup plus grands que le neutrophile et le lymphocyte contigus. Motte chromatinienne et élimination de la chromatine.
60x
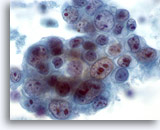
Figure 42
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de haut grade.
Autre exemple de pléomorphisme observé dans le carcinome canalaire. Ce groupe de cellules tumorales contient des noyaux de taille variable. Certaines cellules ont plusieurs grands nucléoles. On peut observer une nécrose dans le fond.
60x
Figure 42
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de haut grade.
Autre exemple de pléomorphisme observé dans le carcinome canalaire. Ce groupe de cellules tumorales contient des noyaux de taille variable. Certaines cellules ont plusieurs grands nucléoles. On peut observer une nécrose dans le fond.
60x
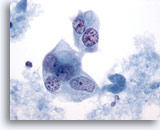
Figure 43
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de haut grade.
Cellules malignes multinucléées avec noyaux pâles et chromatine en motte/éliminée.
60x
Figure 43
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de haut grade.
Cellules malignes multinucléées avec noyaux pâles et chromatine en motte/éliminée.
60x
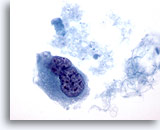
Figure 44
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de haut grade.
Cet échantillon provenant du même cas que la Figure 43 ci-dessus comporte une cellule binucléée avec noyaux hyperchromatiques et chromatine en motte / éliminée.
60x
Figure 44
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de haut grade.
Cet échantillon provenant du même cas que la Figure 43 ci-dessus comporte une cellule binucléée avec noyaux hyperchromatiques et chromatine en motte / éliminée.
60x
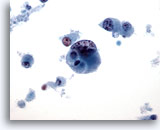
Figure 45
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de haut grade.
Exemple de carcinome canalaire de haut grade mal différencié. Cellules isolées, chromatine anormale, nucléoles visibles et nécrose cellulaire dans le fond.
40x
Figure 45
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de haut grade.
Exemple de carcinome canalaire de haut grade mal différencié. Cellules isolées, chromatine anormale, nucléoles visibles et nécrose cellulaire dans le fond.
40x
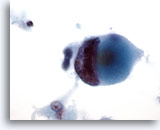
Figure 46
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de haut grade.
Noter la motte et l’élimination chromatiniennes marquées dans cette cellule maligne provenant du même cas que Figure 45 ci-dessus.
60x
Figure 46
Cytoponction mammaire à l’aiguille fine, carcinome canalaire de haut grade.
Noter la motte et l’élimination chromatiniennes marquées dans cette cellule maligne provenant du même cas que Figure 45 ci-dessus.
60x
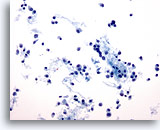
Figure 47
Cytoponction mammaire à l’aiguille fine, carcinome lobulaire.
Dans les prélèvements de carcinome lobulaire, les cellules ont tendance à être dispersées, mais on peut parfois observer de nombreuses cellules (comme sur cette image). Les cellules tumorales sont isolées, mais elles peuvent former de petits agrégats, souvent sous la forme d’un groupe isolé.
20x
Figure 47
Cytoponction mammaire à l’aiguille fine, carcinome lobulaire.
Dans les prélèvements de carcinome lobulaire, les cellules ont tendance à être dispersées, mais on peut parfois observer de nombreuses cellules (comme sur cette image). Les cellules tumorales sont isolées, mais elles peuvent former de petits agrégats, souvent sous la forme d’un groupe isolé.
20x
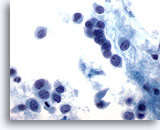
Figure 48
Cytoponction mammaire à l’aiguille fine, carcinome lobulaire.
Les cellules néoplasiques sont généralement petites, avec des marges nucléaires rondes à irrégulières et des noyaux excentrés, ce qui produit un aspect plasmacytoïde comme dans ce champ.
60x
Figure 48
Cytoponction mammaire à l’aiguille fine, carcinome lobulaire.
Les cellules néoplasiques sont généralement petites, avec des marges nucléaires rondes à irrégulières et des noyaux excentrés, ce qui produit un aspect plasmacytoïde comme dans ce champ.
60x
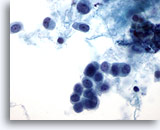
Figure 49
Cytoponction mammaire à l’aiguille fine, carcinome lobulaire.
Cellules à l’aspect plasmacytoïde avec noyaux ronds. Le matériel du fond semble être de nature protéinacée plutôt que nécrotique. Petit groupe unique de 3 cellules au centre du champ.
60x
Figure 49
Cytoponction mammaire à l’aiguille fine, carcinome lobulaire.
Cellules à l’aspect plasmacytoïde avec noyaux ronds. Le matériel du fond semble être de nature protéinacée plutôt que nécrotique. Petit groupe unique de 3 cellules au centre du champ.
60x
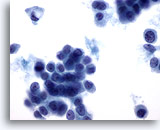
Figure 50
Cytoponction mammaire à l’aiguille fine, carcinome lobulaire.
Présence fréquente de vacuoles intracytoplasmiques dans les échantillons de carcinome lobulaire, comme dans la cellule isolée en haut à gauche de ce champ. On note également la présence de vacuoles dans le carcinome canalaire.
60x
Figure 50
Cytoponction mammaire à l’aiguille fine, carcinome lobulaire.
Présence fréquente de vacuoles intracytoplasmiques dans les échantillons de carcinome lobulaire, comme dans la cellule isolée en haut à gauche de ce champ. On note également la présence de vacuoles dans le carcinome canalaire.
60x
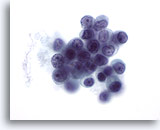
Figure 51
Cytoponction mammaire à l’aiguille fine, carcinome lobulaire.
La présence de nucléoles n’est pas caractéristique du carcinome lobulaire (à l’exception du carcinome lobulaire pléomorphe), mais elle peut parfois être notée.
60x
Figure 51
Cytoponction mammaire à l’aiguille fine, carcinome lobulaire.
La présence de nucléoles n’est pas caractéristique du carcinome lobulaire (à l’exception du carcinome lobulaire pléomorphe), mais elle peut parfois être notée.
60x
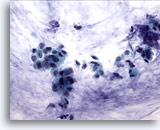
Figure 52
Cytoponction mammaire à l’aiguille fine, carcinome colloïde (mucineux).
Groupes de petites cellules et quelques cellules isolées dans un fond de mucine. Dans la mesure où le diagnostic dépend d’un constat de production de mucine dans toute la tumeur, il est préférable de diagnostiquer ces cas comme des carcinomes canalaires présentant une différenciation mucineuse plutôt que comme des carcinomes mucineux.
40x
Figure 52
Cytoponction mammaire à l’aiguille fine, carcinome colloïde (mucineux).
Groupes de petites cellules et quelques cellules isolées dans un fond de mucine. Dans la mesure où le diagnostic dépend d’un constat de production de mucine dans toute la tumeur, il est préférable de diagnostiquer ces cas comme des carcinomes canalaires présentant une différenciation mucineuse plutôt que comme des carcinomes mucineux.
40x
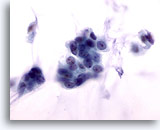
Figure 53
Cytoponction mammaire à l’aiguille fine, carcinome colloïde.
Les cellules malignes de cette lésion sont ternes. Elles présentent des marges nucléaires lisses, une chromatine répartie de façon homogène, mais aucun nucléole visible. Si la mucine n’est pas visible, les cellules peuvent être interprétées à tort comme bénignes.
60x
Figure 53
Cytoponction mammaire à l’aiguille fine, carcinome colloïde..
Les cellules malignes de cette lésion sont ternes. Elles présentent des marges nucléaires lisses, une chromatine répartie de façon homogène, mais aucun nucléole visible. Si la mucine n’est pas visible, les cellules peuvent être interprétées à tort comme bénignes.
60x
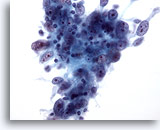
Figure 54
Cytoponction mammaire à l’aiguille fine, carcinome médullaire.
En général, les prélèvements de ce type de tumeurs effectués à l’aiguille fine comportent de grandes cellules tumorales pléomorphes avec nucléoles proéminents, ici mélangées à des lymphocytes. On peut également observer des plasmocytes.
40x
Figure 54
Cytoponction mammaire à l’aiguille fine, carcinome médullaire.
En général, les prélèvements de ce type de tumeurs effectués à l’aiguille fine comportent de grandes cellules tumorales pléomorphes avec nucléoles proéminents, ici mélangées à des lymphocytes. On peut également observer des plasmocytes.
40x
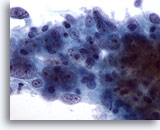
Figure 55
Cytoponction mammaire à l’aiguille fine, carcinome médullaire.
Groupe de cellules avec nucléoles de grande taille au centre et chromatine anormale. Présence de lymphocytes.
60x
Figure 55
Cytoponction mammaire à l’aiguille fine, carcinome médullaire.
Groupe de cellules avec nucléoles de grande taille au centre et chromatine anormale. Présence de lymphocytes.
60x
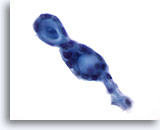
Figure 56
Cytoponction mammaire à l’aiguille fine, carcinome kystique adénoïde.
Ces tumeurs contiennent du matériel hyalin extracellulaire (sous forme globulaire ou cylindrique/canalaire) entouré de petites cellules néoplasiques ternes. Deux structures globulaires contiguës sont présentes dans ce champ.
60x
Figure 56
Cytoponction mammaire à l’aiguille fine, carcinome kystique adénoïde.
Ces tumeurs contiennent du matériel hyalin extracellulaire (sous forme globulaire ou cylindrique/canalaire) entouré de petites cellules néoplasiques ternes. Deux structures globulaires contiguës sont présentes dans ce champ.
60x
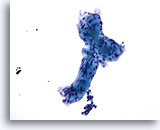
Figure 57
Cytoponction mammaire à l’aiguille fine, carcinome kystique adénoïde.
Illustration claire d’un matériel hyalin extracellulaire formant un vague tubule avec deux structures globulaires attachées.
20x
Figure 57
Cytoponction mammaire à l’aiguille fine, carcinome kystique adénoïde.
Illustration claire d’un matériel hyalin extracellulaire formant un vague tubule avec deux structures globulaires attachées.
20x

Figure 58
Cytoponction mammaire à l’aiguille fine, carcinome kystique adénoïde.
Champ illustrant des globules hyalins recouverts de petites cellules tumorales. Diagnostic différentiel de myosphérulose collagène, lésion bénigne dans laquelle les globules hyalins sont accompagnés de cellules bénignes ou canalaires hyperplasiques.
60x
Figure 58
Cytoponction mammaire à l’aiguille fine, carcinome kystique adénoïde.
Champ illustrant des globules hyalins recouverts de petites cellules tumorales. Diagnostic différentiel de myosphérulose collagène, lésion bénigne dans laquelle les globules hyalins sont accompagnés de cellules bénignes ou canalaires hyperplasiques.
60x
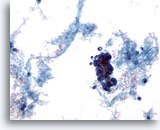
Figure 59
Cytoponction mammaire à l’aiguille fine, kyste malin.
Tous les kystes ne sont pas bénins. Certains carcinomes canalaires peuvent se présenter sous la forme de lésions kystiques, comme dans cet exemple. Cette vue à faible grossissement montre un matériel protéinacé, du sang et un groupe de cellules hyperchromatiques.
20x
Figure 59
Cytoponction mammaire à l’aiguille fine, kyste malin.
Tous les kystes ne sont pas bénins. Certains carcinomes canalaires peuvent se présenter sous la forme de lésions kystiques, comme dans cet exemple. Cette vue à faible grossissement montre un matériel protéinacé, du sang et un groupe de cellules hyperchromatiques.
20x
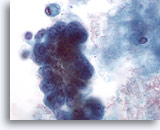
Figure 60
Cytoponction mammaire à l’aiguille fine, kyste malin.
Un fort grossissement du groupe de cellules de la Figure 59 ci-dessus fait apparaît un pléomorphisme, des nucléoles visibles et une vacuolisation. La biopsie a permis d’établir un diagnostic de carcinome canalaire.
60x
Figure 60
Cytoponction mammaire à l’aiguille fine, kyste malin.
Un fort grossissement du groupe de cellules de la Figure 59 ci-dessus fait apparaît un pléomorphisme, des nucléoles visibles et une vacuolisation. La biopsie a permis d’établir un diagnostic de carcinome canalaire.
60x
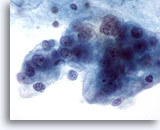
Figure 61
Cytoponction mammaire à l’aiguille fine, kyste malin.
Autre exemple de carcinome canalaire diagnostiqué sur un prélèvement de kyste effectué par aspiration. Champ montrant des cellules malignes vacuolisées nettement pléomorphes avec nucléoles et chromatine anormale.
60x
Figure 61
Cytoponction mammaire à l’aiguille fine, kyste malin.
Autre exemple de carcinome canalaire diagnostiqué sur un prélèvement de kyste effectué par aspiration. Champ montrant des cellules malignes vacuolisées nettement pléomorphes avec nucléoles et chromatine anormale.
60x
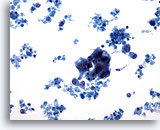
Figure 62
Cytoponction mammaire à l’aiguille fine, kyste malin.
Champ montrant un groupe hyperchromatique de cellules épithéliales avec nombreux débris cellulaires dans le fond ; suspicion de carcinome.
20x
Figure 62
Cytoponction mammaire à l’aiguille fine, kyste malin.
Champ montrant un groupe hyperchromatique de cellules épithéliales avec nombreux débris cellulaires dans le fond ; suspicion de carcinome.
20x
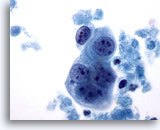
Figure 63
Cytoponction mammaire à l’aiguille fine, kyste malin.
Petit groupe de cellules tumorales avec nucléoles proéminents et marges nucléaires relativement lisses. Groupe entouré de nécrose.
60x
Figure 63
Cytoponction mammaire à l’aiguille fine, kyste malin.
Petit groupe de cellules tumorales avec nucléoles proéminents et marges nucléaires relativement lisses. Groupe entouré de nécrose.
60x
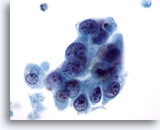
Figure 64
Cytoponction mammaire à l’aiguille fine, kyste malin.
Cet échantillon provient du même cas que la Figure 63 ci-dessus. Les cellules se superposent. On note également une indication de séparation, des marges nucléaires irrégulières, une chromatine anormale et des nucléoles visibles.
60x
Figure 64
Cytoponction mammaire à l’aiguille fine, kyste malin.
Cet échantillon provient du même cas que la Figure 63 ci-dessus. Les cellules se superposent. On note également une indication de séparation, des marges nucléaires irrégulières, une chromatine anormale et des nucléoles visibles.
60x
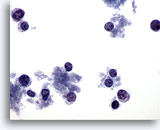
Figure 65
Cytoponction mammaire à l’aiguille fine, lymphome.
Champ montrant des cellules dispersées avec très peu de cytoplasme. Absence de groupes. Cellules avec noyaux ronds et marge de cytoplasme sur un côté (caractéristiques en faveur d’une lésion lymphoïde plutôt qu’épithéliale).
40x
Figure 65
Cytoponction mammaire à l’aiguille fine, lymphome.
Champ montrant des cellules dispersées avec très peu de cytoplasme. Absence de groupes. Cellules avec noyaux ronds et marge de cytoplasme sur un côté (caractéristiques en faveur d’une lésion lymphoïde plutôt qu’épithéliale).
40x
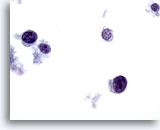
Figure 66
Cytoponction mammaire à l’aiguille fine, lymphome.
Un fort grossissement montre des cellules lymphoïdes avec une morphologie caractéristique de la chromatine. Une coloration immunocytochimique (par ex. à l’antigène leucocytaire commun, LCA) sur lame ThinPrep non colorée permettrait de confirmer le diagnostic.
60x
Figure 66
Cytoponction mammaire à l’aiguille fine, lymphome.
Un fort grossissement montre des cellules lymphoïdes avec une morphologie caractéristique de la chromatine. Une coloration immunocytochimique (par ex. à l’antigène leucocytaire commun, LCA) sur lame ThinPrep non colorée permettrait de confirmer le diagnostic.
60x


































































