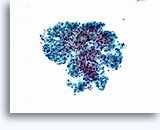
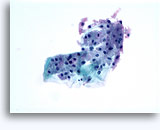
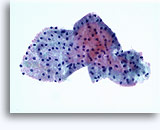
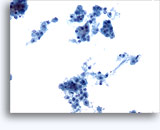
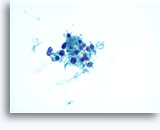
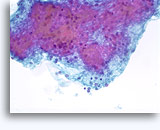
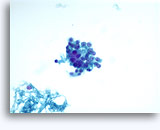
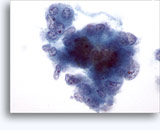
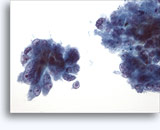
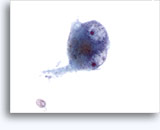
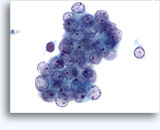
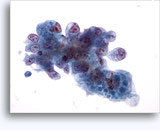
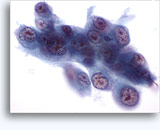
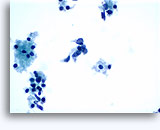
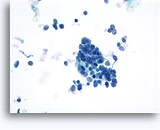
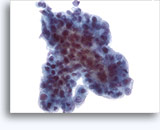
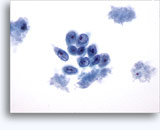
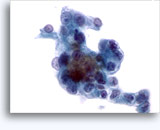
Cytoponction à l'aiguille fine
Autres foyers
Michele M. Weir, MD, FRCP
Introduction
Cette section traite de la cytoponction à l’aiguille fine réalisée sur le rein, la glande surrénale, les gonades, les os et les tissus mous.
Cytoponction rénale à l’aiguille fine
La cytoponction à l’aiguille fine d’une masse rénale est peu fréquente, car la plupart des patients présentant une telle masse subissent directement une résection. Elle peut néanmoins s’avérer utile quand :
- les images radiographiques ne permettent pas la classification de la lésion ;
- le patient ne peut pas subir d’intervention chirurgicale ; et
- une intervention chirurgicale (épargnant le rein ou l’uretère) doit être planifiée
Les chiffres associés à la cytoponction des tumeurs rénales sont : sensibilité de 79-92 %, spécificité de 92-99 % et précision diagnostique globale de 73-95 %. En raison de l’hétérogénéité de ces tumeurs et de l’importance de la classification cytogénétique, l’échantillon histologique permet mieux d’établir un diagnostic définitif dans certains cas de néoplasme rénal. Le sous-type de certains néoplasmes oncocytiques négatifs à la coloration au fer colloïdal (technique de Hale) pouvant être difficile à identifier avec un échantillon prélevé par cytoponction, un diagnostic différentiel doit être établi.
Chez les adultes, le kyste rénal constitue la cause non-néoplasique la plus courante d’une masse rénale. Les autres lésions peuvent inclure un abcès et une pyélonéphrite xanthogranulomateuse. Parmi les néoplasmes rénaux, l’entité bénigne la plus courante est l’oncocytome et l’entité maligne la plus fréquente est l’hypernéphrome. Les autres néoplasmes incluent l’angiomyolipome bénin et le carcinome urothélial du bassinet du rein.
Cytologie de la cytoponction rénale à l’aiguille fine
- Normale
- Faible cellularité de l’échantillon
- Cellules isolées ou petits groupes
- Glomérules :
- boucles capillaires, cellules fuselées et rondes
- absence d’atypie, de sphérules ou de papilles (contrairement à l’hypernéphrome papillaire)
- structures globulaires cellulaires
- imite : l’hypernéphrome papillaire
- Tubule proximal avec circonvolutions (PCT) :
- tubules et amas
- cytoplasme granulaire abondant
- cytoplasme fragile mal défini sans bordures cellulaires (contrairement à l’oncocytome)
- noyau terne, nucléole proéminent
- imite : l’oncocytome et l’hypernéphrome
- Tubule distal avec circonvolutions/tube collecteur (DCT/CD) :
- tubules, groupes plats (contrairement à l’hypernéphrome)
- cytoplasme bien défini, cellules plus petites
- absence de vacuoles (contrairement à l’hypernéphrome)
- absence de nucléoles
- imite : l’hypernéphrome
- Oncocytome
- Fond propre
- Cellules isolées ou groupes lâches manquant de cohésion, absence de noyaux dépouillés
- Rarement dans de grands groupes (contrairement à l’hypernéphrome)
- Petits noyaux uniformes, bordures lisses (contrairement à l’hypernéphrome)
- Atypie nucléaire focale, binucléation, nucléoles discrets
- Cytoplasme abondant, uniformément granulaire et bien défini
- Absence de vacuoles (contrairement à l’hypernéphrome)
- Bordure cellulaire nettement définie (comme les cellules du PCT)
- Marquage négatif à la vimentine, marquage positif à la cytokératine 8/18 (utilisation de biotine)
- Négatif à la coloration au fer colloïdal de Hale ou coloration périnucléaire/atypique
- Microscopie électronique : mitochondrie
- Imite : le PCT, l’hypernéphrome chromophobe et l’hypernéphrome conventionnel avec cytoplasme granulaire
- Hypernéphrome
- Type conventionnel/courant/à cellules claires (CRCC)
- fond propre ou nécrotique
- amas monocouches cohésifs (contrairement à l’oncocytome)
- capillaires proéminents avec ramifications
- rares cellules isolées (bas grade) –> davantage de cellules isolées et noyaux dépouillés (grades plus élevés) (contrairement à l’oncocytome)
- noyaux ternes, absence de nucléoles (bas grade)
- noyaux atypiques plus grands, certains bizarres, nucléoles proéminents (grade plus élevé), (contrairement à l’oncocytome et à l’hypernéphrome chromophobe)
- noyau excentré, expulsé des cellules
- noyaux plus uniformes que l’hypernéphrome chromophobe
- cytoplasme vacuolisé mousseux (contrairement à ONC et normal)
- cytoplasme abondant, clair ou granulaire (pas uniforme), faible rapport N/C
- corps intracytoplasmiques de type Mallory
- Positif à la vimentine et à la cytokératine (utilisation de biotine)
- Négatif à la coloration au fer colloïdal de Hale
- Microscopie électronique : glycogène, lipide, parfois mitochondrie
- Imite : tubule distal avec circonvolutions et tube collecteur, oncocytome, hypernéphrome chromophobe
- Type chromophobe
- fond propre
- amas, groupes, cellules isolées (manque de cohésion, mais moins que l’hypernéphrome)
- noyaux nus (contrairement à l’oncocytome)
- taille nucléaire plus variable (que l’oncocytome et le CRCC)
- noyaux vésiculaires, binucléation, inclusions
- membrane nucléaire irrégulière (contrairement à l’oncocytome et au CRCC)
- nucléoles proéminents dans certains cas
- cytoplasme granulaire abondant
- élimination périnucléaire, bordures cellulaires proéminentes (« koilocytiques »)
- cytoplasme cotonneux/clair/granulaire non uniforme
- négatif à la vimentine, positif à la cytokératine (utilisation de biotine)
- positif à la coloration au fer colloïdal de Hale – cytoplasme dense et uniforme
- microscopie électronique : microvésicules, mitochondrie (dans le cas de la variante éosinophile)
- Imite : l’oncocytome et le CRCC
- Type conventionnel/courant/à cellules claires (CRCC)
Cytoponction surrénale à l’aiguille fine
La cytoponction à l’aiguille fine d’une masse située dans la glande surrénale sert généralement à confirmer la présence de métastases ou à examiner un nodule secondaire. En raison du risque de crise d’hypertension et/ou de décès, le phéochromocytome fonctionnel ou la suspicion de phéochromocytome constitue une contre-indication à la cytoponction. La sensibilité obtenue avec la cytoponction de tumeurs surrénales est de 85 à 94 % et sa spécificité (métastases) de 100 %.
Chez les adultes, le néoplasme le plus courant dans la glande surrénale est le cancer métastatique du poumon ou du sein. Parmi les autres foyers d’origine, citons les voies GI, le pancréas, le rein et la peau (mélanome). Les néoplasmes primitifs de la glande surrénale incluent ceux d’origine corticale (adénome, carcinome) et ceux d’origine médullaire (phéochromocytome). Les autres lésions surrénales primitives incluent le myélolipome, les kystes et l’hyperplasie nodulaire corticale.
Cytologie de la cytoponction surrénale à l’aiguille fine
- Normale
- Faible cellularité
- Cortex : couches externes
- fond mousseux riche en lipides
- cellules isolées, groupes
- noyaux ovales ternes
- absence ou petits nucléoles
- cytoplasme vacuolisé abondant avec bords effilochés
- Imite : peut être confondu avec un nodule cortical surrénal bénin et certains carcinomes corticaux surrénaux
- Cortex : couche interne
- absence de vacuolisation
- cytoplasme éosinophile granulaire
- cellules plus petites
- pigment (lipofuscine)
- Moelle :
- cytoplasme basophile
- grand noyau excentré
- nucléoles apparents
- fine chromatine granulaire
- Nodule cortical surrénal bénin
- Échantillon pouvant être cellulaire
- Fond mousseux riche en lipides (absent dans l’hypernéphrome)
- Fragments cohésifs avec cellules endothéliales sinusoïdales
- Noyaux dépouillés
- Noyaux ronds à ovales (plus uniformes que dans l’hypernéphrome)
- Absence ou petits nucléoles
- Multinucléation
- Cytoplasme vacuolisé (plus que dans l’hypernéphrome)
- Positif à la vimentine, positif à la cytokératine (poids moléculaire faible) dans certains cas
- Positif à l’inhibine, mélane A et calrétinine
- Marquage négatif aux EMA, CK7, CK20
- Imite : l’hypernéphrome ; peut être confondu avec une glande surrénale normale et certains carcinomes corticaux surrénaux.
- Corticosurrénalome surrénal
- Imite les caractéristiques de l’adénome
- Présence éventuelle de nécrose
- Présence éventuelle de critères nucléaires malins
- Évaluation histologique nécessaire pour faire la différence entre un adénome plus étendu et un carcinome
- Immunoprofil similaire à l’adénome
- Imite : peut être confondu avec une glande surrénale normale, un adénome cortical surrénal, un phéochromocytome et d’autres tumeurs malignes (s’il est mal différencié)
- Pheochromocytome
- 3 types de cellules
- N°1 : cytoplasme fibrillaire, noyaux hyperchromatiques ovales, possibilité d’anisonucléose/pléomorphisme/binucléation
- cellules fuselées (cellules de Sertoli)
- cellules plasmacytoïdes
- Pigment (mélanine) dans certains échantillons
- Cellules isolées manquant de cohésion, certains groupes
- Taille et forme nucléaires nettement variables
- Granularité cytoplasmique rouge sur le matériel séché à l’air
- Cellules fuselées positives à la synaptophysine, chromogranine, S-100
- Imite : le corticosurrénalome et d’autres tumeurs malignes mal différenciées
- 3 types de cellules
- Carcinome métastatique
- Population cellulaire uniforme
- Critères nucléaires malins ; possibilité de caractéristiques neuro-endocriniennes
- Possibilité de différenciation glandulaire ou malpighienne du cytoplasme
- Présence éventuelle de nécrose
- Marquage positif à la cytokératine
- Profil CK7, CK20 pouvant être le site d’origine
- Généralement négatif à l’inhibine, mélane A et calrétinine
- Recours au marqueur TTF-1 pour confirmer l’origine pulmonaire
- Imite : le phéochromocytome, le corticosurrénalome et d’autres tumeurs malignes mal différenciées
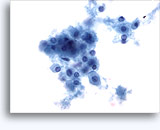
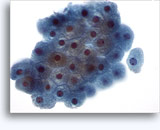
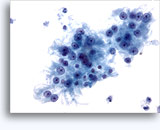
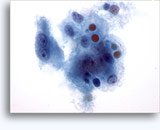
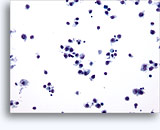
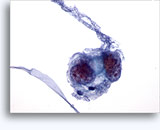
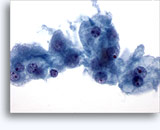
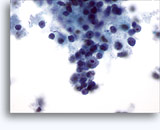
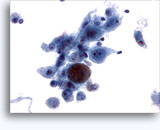
Figures 22 et 23: Petites cellules avec noyaux hyperchromatiques, « sales » et moulés, cytoplasme rare et rapports N/C élevés. Fond contenant des débris granulaires nécrotiques.
Cytoponction ovarienne et testiculaire à l’aiguille fine
Cette technique est rarement utilisée pour le diagnostic primitif de néoplasme gonadique. En Amérique du Nord, la cytoponction joue un rôle dans le diagnostic des tumeurs malignes gonadiques récurrentes ou métastatiques. Pour ce dernier emploi, la sensibilité diagnostique de cette technique varie entre 65 et 95 %, avec une spécificité supérieure (92 à 100 %). Les faux négatifs sont, entre autres, dus à des erreurs d’échantillonnage (associées à une fibrose induite par la radiothérapie, à la taille de la masse ou à la présence de nécrose) et à des erreurs d’interprétation.
Cytologie de la cytoponction ovarienne à l’aiguille fine
- Adénocarcinome séreux
- Échantillons cellulaires
- Papilles, certaines avec des ramifications
- Certaines cellules isolées
- Critères nucléaires malins (pouvant être absents dans la variante de bas grade)
- Vacuoles intracytoplasmiques
- Psammomes « nus » ou dans des groupes de cellules (résultat non spécifique)
- Imite : d’autres carcinomes (primitifs & secondaires) pour la variante de bas grande, impossible à distinguer de la tumeur séreuse à la limite de la malignité
Cytologie de la cytoponction testiculaire à l’aiguille fine
- Séminome
- Grandes cellules dispersées et quelques groupes
- Noyaux dépouillés, cytoplasme délicat
- Cellules primitives : noyaux centraux, fine chromatine vésiculaire, nucléole central proéminent
- Lymphocytes et histiocytes épithélioïdes au fond
- Fond tigroïde (mousseux, semblable à une bande ; peut être absent ou minime dans les préparations en couche mince)
- Positif à la PLAP ; négatif à la LCA, AFP, cytokératine
- Imite : d’autres tumeurs germinales, le lymphome malin
- Carcinome embryonnaire
- Présence de nécrose
- Papillaire, semblable à une glande ou en groupes
- Noyaux pléomorphes, chromatine grossière, plusieurs nucléoles proéminents
- Positif à la PLAP ; éventuellement positif à la AFP ; négatif à la LCA
- Imite : d’autres tumeurs germinales, le lymphome malin, le mélanome et le carcinome de haut grade
Cytoponction à l’aiguille fine des os et tissus mous
Cette technique est le plus souvent employée pour confirmer une pathologie métastatique, en général un carcinome. Dans certains centres, elle peut servir à l’établissement d’un diagnostic d’ostéosarcome ou de sarcome primitif des tissus mous. La précision diagnostique la plus élevée est attribuée à la cytoponction des néoplasmes métastatiques (de 92 à 100 %).
Cytologie de la cytoponction à l’aiguille fine des os et tissus mous
- Carcinome métastatique
- Nécrose dans certains cas
- Caractéristiques nucléaires malignes
- Groupes de cellules et cellules isolées (manque de cohésion)
- Différenciation neuro-endocrinienne : rapports N/C élevés, noyaux moulés, hyperchromatiques et « sales » avec cytoplasme rare
- Différenciation glandulaire : vacuoles intracytoplasmiques, billes cellulaires, papilles, glandes
- Différenciation malpighienne : kératinisation, cytoplasme réfractile dur
- Différenciation urothéliale : cellules en forme de cercaire (queues cytoplasmiques)
- Généralement positif à la cytokératine
- Mélanome malin métastatique
- Cellules isolées manquant de cohésion
- Caractéristiques nucléaires malignes, noyaux excentrés
- Diverses morphologies : cellules petites, fuselées ou épithélioïdes
- Taille nucléaire variable
- Pseudo-inclusions nucléaires avec bi et multinucléation
- Pigment intracytoplasmique marron de granules de mélanine
- Positif à la S-100, HMB-45, mélane A (pas toujours)
- Lymphome malin
- Cellules isolées manquant de cohésion
- Chromatine granulaire ouverte
- Nucléoles basés sur la membrane nucléaire dans certains sous-types
- Membrane nucléaire saillante et irrégulière
- Cytoplasme rare dans certains sous-types (rapports N/C élevés)
- Corps lymphoglandulaires dans le fond
- Positif à la LCA, lignée cellulaire B ou T
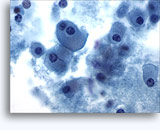
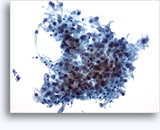
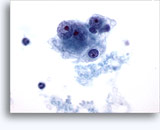
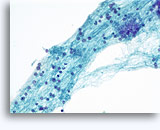
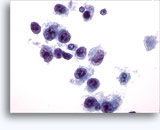
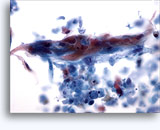
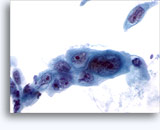
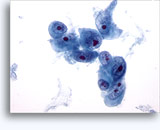
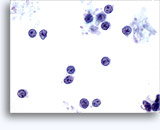
Figures 37 et 38: Cellules isolées présentant un manque de cohésion avec rapports N/C élevés, cytoplasme rare, chromatine ouverte, membranes saillantes et nucléoles basés sur la membrane. Corps lymphoglandulaires dans le fond.
Références
- Bommer KK, Ramzy I and Mody D. Fine-Needle Aspiration Biopsy in the Diagnosis and Management of Bone Lesions. Cancer (Cancer Cytopathology) 1997; 81:148-56.
- Caraway NP, Fanning CV, Amato RJ and Sneige N. Fine-Needle Aspiration Cytology of Seminoma: A Review of 16 Cases. Diagnostic Cytopathology 1995; 12:327-33.
- Geisinger KR et al. Modern Cytopathology. Philadelphia, Churchill Livingstone. 2004; pp 579-606, 689-700.
- Kabukcuoglu F, Kabukcuoglu Y, Kuzgun U and Evren I. Fine Needle aspiration of Malignant Bone Lesions. Acta Cytologica 1998;42:875-82.
- Liu J, Fanning CV. Can Renal Oncocytomas be Distinguished from Renal Cell Carcinoma on Fine-Needle Aspiration Specimens? Cancer (Cancer Cytopathol) 2001;93:390-7.
- Nguyen G and Akin MM. Fine Needle Aspiration Cytology of the Kidney, Renal Pelvis and Adrenal. In:Clinics in Laboratory Medicine. Stanley MW editor. Philadelphia. WB Saunders Company. 1998;18(3):429-60.
- Renshaw AA, Granter SR, Cibas ES. Fine-Needle Aspiration of the Adult Kidney. Cancer (Cancer Cytopathol) 1997;81:71-88.
- Renshaw, AA, Lee KR, Madge R, Granter SR. Accuracy of Fine Needle Aspiration in Distinguishing Subtypes of Renal Cell Carcinoma. Acta Cytol 1997;41:987-94.
- Wakely PE, Kneisl, JS. Soft Tissue Aspiration Cytopathology. Cancer (Cancer Cytopathol) 2000;90:292-8.
- Wiatrowska, BA, Zakowski MF. Fine-Needle Aspiration Biopsy of Chromophobe Renal Cell Carcinoma and Oncocytoma. Cancer (Cancer Cytopathol) 1999;87:161-7.
- Wu H H, Cramer HM, Kho J and Elsheikh, TM. Fine Needle Aspiration Cytology of Benign Adrenal Cortical Nodules. Acta Cytologica 1998;42:1352-8.
- Yang B, Syed ZA and Rosenthal DL. CD10 Facilitates the Diagnosis of Metastatic Renal Cell Carcinoma From Primary Adrenal Cortical Neoplasm in Adrenal Fine-Needle Aspiration. Diagn. Cytopathol. 2002;27:149-52.
- Zardauin IM. Renal FNAC Acta Cytol 1999;43:184-90.
- Zhang, PJ, Genega EM, Tomaszewski JE, Pasha TL, LiVolsi VA. The Role of Calretinin, Inhibin, Melan-A, BCL-2, and C-kit in Differentiating Adrenal Cortical and Medullary Tumors: An Immunohistochemical Study. Mod Pathol 2003;16(6):591-7.