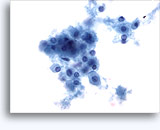
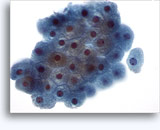
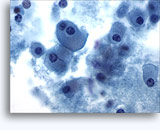
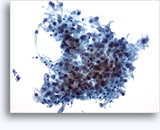
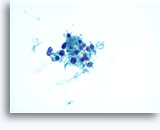
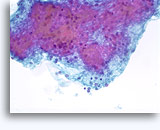
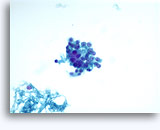
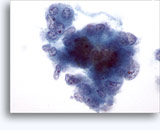
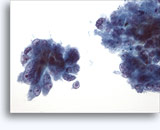
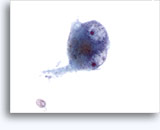
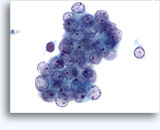
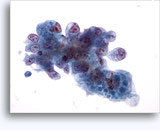
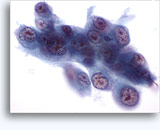
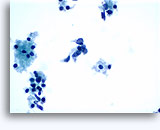
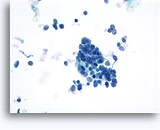
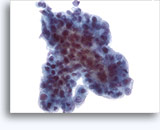
穿刺吸引細胞診
その他の部位
Michele M. Weir, MD, FRCP
はじめに
この節では、腎、副腎、性腺、骨、軟部組織の穿刺吸引生検について概説します。
腎の穿刺吸引生検
腎腫瘤のある患者の大半が直接切除するため、腎集塊の穿刺吸引生検はほとんど実施されていません。しかし、穿刺吸引生検は画像の特徴が分類するにあたり判定保留となり、
- その患者に外科的治療ではなく、
- 外科計画が必要になると
- (腎または尿管の保存手術)、腎腫瘤の評価が重要な役割を果たします。
腎腫瘍の穿刺吸引生検は、感度79~92%、特異度92~99%、なかでも総合的にみた診断の正確さは73~95%であると報告されています。腫瘍の不均一性および細胞遺伝学的分類の重要性により、一部の腎腫瘍の確定診断は組織学的標本にするのが最も良いとされています。ヘールのコロイド銀染色法でみた陰性の膨大細胞腫のなかには穿刺吸引生検でさらに細かく分類することは難しく、結果として鑑別診断以外に方法がないと思われます。
成人で最もよくみられる腎腫瘤の非腫瘍性の原因は腎嚢胞です。このほか、病変には膿瘍、黄色肉芽腫腎盂腎炎があります。腎腫瘍のなかで最も多くみられる良性のものはオンコサイトーマ、最も悪性のものは腎細胞癌です(RCC)です。腫瘍にはこのほか良性のangiomyolipmaおよび尿路上皮癌があります。
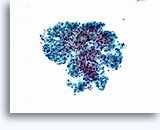
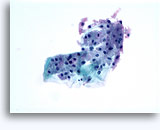
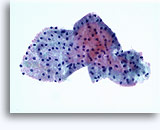
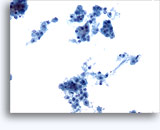
腎穿刺吸引生検による細胞診
- 正常
- 低細胞密度標本
- I孤立型細胞または小集団
- 糸球体:
- 辺縁血管係蹄網、紡錘型細胞および円型細胞
- 異型性なし、球顆、乳頭(乳頭状腎細胞癌とは異なる)のいずれもなし
- 細胞球形構造
- 類似像:乳頭状腎細胞癌
- 近位尿細管迂局部(PCT):
- 小管およびシート
- 豊富な顆粒状細胞質
- 細胞境界のない不鮮明かつ脆弱な細胞質(オンコサイトーマとは異なる)
- 特徴のない核、顕著な核小体
- 類似像:オンコサイトーマ、腎細胞癌
- 遠位曲尿細管/集合尿細管(DCT/CD):
- 小管および平らなシート(腎細胞癌とは異なる)
- 明確な細胞質
- 空胞なし(腎細胞癌とは異なる)
- 核小体なし
- 類似像:腎細胞癌
- オンコサイトーマ
- 混入物のない背景
- 非結合の孤立性細胞または低密度の集塊、裸核なし
- 大集団になることはまれ(腎細胞癌とは異なる)
- 小さく均一な核、滑らかな境界(腎細胞癌とは異なる)
- 中心核異型性、ニ核化、不明瞭な核小体
- 豊富で均一に顆粒状を示す明確な細胞質
- 核小体なし(腎細胞癌とは異なる)
- 著しく明確な細胞縁(近位尿細管迂局部とは異なる)
- ビメンチン陰性、サイトケラチン8/18陽性(ビオチンブロック使用)
- ヘールのコロラド銀染色法陰性、核周辺/異型性染色あり
- 電子顕微鏡:ミトコンドリア
- 類似像:近位尿細管迂局部、嫌色素性腎細胞癌、顆粒状の細胞質が認められる通常型腎細胞癌
- 腎細胞癌
- 従来の/多くみられる/淡明細胞型(CRCC)
- 混入物のない背景または壊死の背景
- 高密度の単層シート(オンコサイトーマと異なる)
- 顕著な分岐毛細血管
- 孤立性細胞はまれ(低悪性度)→ 孤立性細胞、裸核が多い(高悪性度)(オンコサイトーマとは異なる)
- 特徴のない核、核小体なし(低悪性度)
- 大きな異型核、一部異様、核小体顕著(高悪性度)(オンコサイトーマ、嫌色素性の腎細胞癌とは異なる)
- 細胞から突出した偏在性の核
- 嫌色素性腎細胞癌より多い均一な核
- 泡沫状に空胞化した細胞質(ONC、正常なものと異なる)
- 淡明または顆粒状(均一ではない)豊富な細胞質(低いN/C比)
- マロリー様体の細胞質内
- ビメンチン、サイトケラチン陽性(ビオチンブロック使用)
- ヘールのコロラド銀染色法陰性
- 電子顕微鏡:グリコーゲン、脂質、ミトコンドリアが一部の
- 類似像:遠位曲尿細管および集合尿細管、オンコサイトーマ、嫌色素性の腎細胞癌に認められます
- 嫌色素型
- 混入物のない背景
- シート状、集塊、孤立性細胞(従来の/多くみられる/明細胞型より弱い非結合性)
- 裸核(オンコサイトーマとは異なる)
- 細胞および核サイズに大きなばらつき(オンコサイトーマ、従来の/多くみられる/淡明細胞型より)
- 小胞状核、二核化
- 不整な核の輪郭(オンコサイトーマ、従来の/多くみられる/淡明細胞型とは異なる)
- 一部に顕著な核小体
- 豊富な顆粒状細胞質
- 核周辺の透明化、顕著な細胞縁(koilocytic)
- 綿毛様/明調/顆粒状で不均一な細胞質
- ビメンチン陰性、サイトケラチン陽性(ビオチンブロック使用)
- ヘールのコロラド銀染色法陽性 – 均一な高密度の細胞質微小胞、好酸性に変形があれば、ミトコンドリア
- 電子顕微鏡:オンコサイトーマ、
- 類似像:従来の/多くみられる/淡明細胞型
- 従来の/多くみられる/淡明細胞型(CRCC)
副腎の穿刺吸引生検
副腎集塊の穿刺吸引生検は通常、転移を確認するために実施されるかまたは偶発的に小結節を検出する精密検査で実施されます。機能的にみて褐色細胞腫が疑われる場合、高血圧発作や死亡のおそれがあるため、穿刺吸引生検が禁忌となります。.副腎腫瘍の穿刺吸引生検は、感度85~94%、転移の特異度は100%に及びます。
成人では、副腎に最も多くみられる腫瘍は肺または胸部からの転移です。このほか、原発部位として、消化器、膵臓、腎、皮膚(黒色腫)がよく挙げられます。副腎の原発とする腫瘍には、皮質を起源とするもの(腺腫、癌)、延髄を起源とするもの(褐色細胞腫)があります。また、初期の副腎病変には、骨髄脂肪腫、嚢胞および皮質結節性過形成があります。
副腎穿刺吸引生検の細胞診
- 正常
- 低細胞密度
- 皮質:外層
- 泡沫性の脂質が豊富な背景
- 孤立性細胞、集塊
- 特徴のない楕円型の核
- 核小体なしまたは小さな核小体
- 多量の空胞化した細胞質の辺縁が擦り切れ、
- 類似像:良性の副腎皮質小結節、一部の副腎皮質癌と区別することが不可能
- 皮質:内層
- 核小体なし
- 顆粒状の好酸性細胞質
- 小さな細胞
- 消耗色素
- 皮質:
- 好塩基性細胞質
- 大きな偏在性の核
- 目立つ核小体
- 細かい顆粒状のクロマチン
- 良性の副腎皮質小結節
- 細胞標本
- 泡沫性の脂質が豊富な背景(腎細胞癌にはみられない)
- 密集した類洞内皮細胞の破片
- 裸核
- 円形ないし楕円形の核(腎細胞癌より均一化)
- 核小体なしまたは小さな核小体
- 多核細胞化
- 空胞化した細胞質(腎細胞癌より多い)
- ビメンチン陽性、サイトケラチン(低分子量)一部陽性
- インヒビン、Melan-A、カルレチニン陽性
- EMA、CK7、CK20陰性
- 類似像:腎細胞癌は正常な副腎、一部の副腎皮質細胞癌と見分けがつきません。
- 副腎皮質細胞癌
- 腺腫の特徴に類似
- 壊死の存在
- 悪性核基準を参照
- 組織学的評価により、巨大腺腫と癌を区別する必要があります。
- 腺腫とほぼ同じ免疫の特徴
- 類似像:未分化の副腎髄質褐色細胞腫であれば、正常な副腎、副腎皮質腺腫、褐色細胞腫、その他の腫瘍と区別できません。
- 褐色細胞腫
- 3つの細胞型
- #1 – 繊維性の細胞質、卵形の過染核 – 不同核/多型性/二核化を示します。
- 紡錘細胞(セルトリ細胞)
- 形質細胞様細胞
- 一部にメラニン色素
- 非結合性の孤立性細胞、一部に集塊
- 核の大きさおよび形状に顕著なばらつき
- 空気乾燥したものに赤い細胞質の顆粒性
- 紡錘細胞では、シナトフィジン、クロモグラニン陽性、S-100陽性
- 類似像:副腎皮質癌、その他の未分化悪性腫瘍
- 3つの細胞型
- 転移性癌
- 均一な細胞集団
- 核基準からみて悪性腫瘍を示し、神経内分泌系の特徴がみられます。
- 細胞質に腺または扁平上皮の分化が認められます。
- 壊死の存在
- サイトケラチン陽性
- CK7、CK20の特徴から原発部位を限定することができます。
- インヒビン、Melan-A、カルレチニンは通常陰性
- TTF-1は肺原発確認の一助となります。
- 類似像:褐色細胞腫、副腎皮質癌、その他の未分化悪性腫瘍
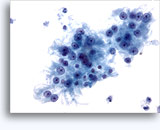
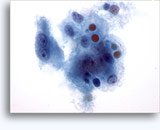
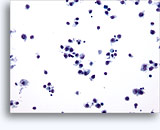
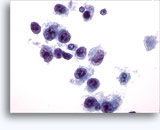
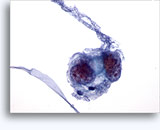
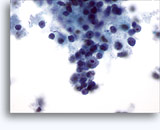
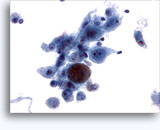
画像 22-23: クロマチン増量、汚れた核、少量の細胞質、高いN/C比。背景に壊死性の顆粒状破片。
卵巣および精巣の穿刺吸引生検の細胞診
卵巣および精巣の穿刺吸引生検の細胞診は性腺腫瘍の初期診断にまれに用いられます。穿刺吸引生検の細胞診は、北アメリカでは再発または転移性腺悪性腫瘍の診断に貢献しています。後者の場合、感度は65~95%と幅がありますが、高い特異度が期待できます。偽陰性の結果が出る理由としては、放射腺誘導の繊線症、集塊の大きさ、壊死の存在、標本誤差、像の解析エラー(良性であると過小評価)などが挙げられます。
卵巣穿刺吸引生検の細胞診から選択
- 漿液性腺癌
- 細胞標本
- 乳頭、一部分岐
- 一部孤立性細胞
- 核基準からすると悪性ですが、低悪性度の場合は判定不可
- 細胞質内空胞
- 砂粒小体がむき出しのこともあれば、細胞集団に留まることもある(非特異的所見)
- 類似像:悪性度が低ければ、その他の癌は(原発性および転移性とも)重篤な境界型腫瘍と区別することが不可能
精巣穿刺吸引生検の細胞診
- セミノーム
- 非結合型の大細胞、集塊はごくまれ
- 裸核、繊細な細胞質
- 原始的な細胞:中央に位置する核、細かい小胞性のクロマチン、中央に位置する顕著な核小体
- 背景にリンパ球、類上皮組織球
- 虎斑状の背景(泡状、帯状。Thin layer標本像には認められないか最小限)
- PLAP陽性、LCA、AFP、サイトケラチン陰性
- 類似像:その他の胚細胞腫瘍、悪性リンパ腫
- 胎児性癌
- 壊死あり
- 乳頭状、腺様またはシート状
- 多形核、粗大クロマチン、いくつかの顕著が核小体
- PLAP、サイトケラチン陽性、AFP陽性、LCA陰性
- 類似像:その他の胚細胞腫瘍、悪性リンパ腫、メラノーマ、高悪性度癌
骨および軟部組織の穿刺吸引生検
骨および軟部組織病変の穿刺吸引生検は通常、転移性疾患(通常は癌)を確認するために実施されます。実施される医療施設によっては、選択した初期の骨肉腫および軟部組織肉腫の診断に用います。転移性腫瘍の穿刺吸引生検の場合、診断の正確さという点では最も優れています(92~100%)。
骨および軟部組織の転移をみる穿刺吸引生検
- 転移性癌
- 一部に壊死あり
- 悪性腫瘍の核の特徴
- 細胞集塊も孤立性細胞(非結合性)も存在します。
- 神経内分泌系分化:高いN/C比、細胞質の乏しい不鮮明な過色素性の核圧排像
- 腺分化:細胞質内空胞、球状細胞、乳頭、腺
- 扁平上皮分化:角質化、硬質光屈折性細胞質
- 尿路上皮分化:セルカリア形細胞(細胞質に尾のような形)
- サイトケラチン通常陽性
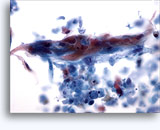
- 転移性悪性黒色腫
- 非結合性の孤立性細胞
- 悪性腫瘍の核の特徴、偏在性を示す核
- パターンの種類:小さな紡錘形または上皮様細胞
- 核サイズのばらつき
- 二核細胞化および多核細胞化がみられる核内偽封入体
- 細胞質内はくすんだ茶色のメラニン色素
- S-100、HMB-45、Melan-A陽性(100%ではない)
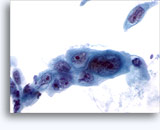
- 悪性リンパ腫
- 非結合性の孤立性細胞
- 開いた顆粒状のクロマチン
- 一部サブタイプの核膜が基盤となる核小体
- 核膜の突出および不整
- 一部サブタイプに乏しい細胞質(高いN/C比)
- 背景にLymphoglandular body
- LCA陽性、B細胞またはT細胞に細胞系統
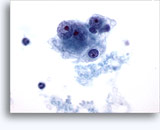
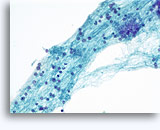
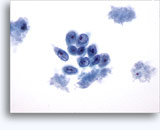
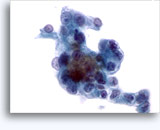
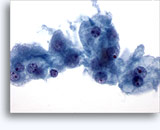
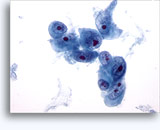
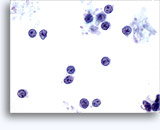
画像 37-38: 高いN/C比、小量の細胞質、開いたクロマチン、膜の突起、膜中心の核小体がみられる非結合性を示す孤立性細胞。
参考文献
- Bommer KK, Ramzy I and Mody D. Fine-Needle Aspiration Biopsy in the Diagnosis and Management of Bone Lesions. Cancer (Cancer Cytopathology) 1997; 81:148-56.
- Caraway NP, Fanning CV, Amato RJ and Sneige N. Fine-Needle Aspiration Cytology of Seminoma: A Review of 16 Cases. Diagnostic Cytopathology 1995; 12:327-33.
- Geisinger KR et al. Modern Cytopathology. Philadelphia, Churchill Livingstone. 2004; pp 579-606, 689-700.
- Kabukcuoglu F, Kabukcuoglu Y, Kuzgun U and Evren I. Fine Needle aspiration of Malignant Bone Lesions. Acta Cytologica 1998;42:875-82.
- Liu J, Fanning CV. Can Renal Oncocytomas be Distinguished from Renal Cell Carcinoma on Fine-Needle Aspiration Specimens? Cancer (Cancer Cytopathol) 2001;93:390-7.
- Nguyen G and Akin MM. Fine Needle Aspiration Cytology of the Kidney, Renal Pelvis and Adrenal. In:Clinics in Laboratory Medicine. Stanley MW editor. Philadelphia. WB Saunders Company. 1998;18(3):429-60.
- Renshaw AA, Granter SR, Cibas ES. Fine-Needle Aspiration of the Adult Kidney. Cancer (Cancer Cytopathol) 1997;81:71-88.
- Renshaw, AA, Lee KR, Madge R, Granter SR. Accuracy of Fine Needle Aspiration in Distinguishing Subtypes of Renal Cell Carcinoma. Acta Cytol 1997;41:987-94.
- Wakely PE, Kneisl, JS. Soft Tissue Aspiration Cytopathology. Cancer (Cancer Cytopathol) 2000;90:292-8.
- Wiatrowska, BA, Zakowski MF. Fine-Needle Aspiration Biopsy of Chromophobe Renal Cell Carcinoma and Oncocytoma. Cancer (Cancer Cytopathol) 1999;87:161-7.
- Wu H H, Cramer HM, Kho J and Elsheikh, TM. Fine Needle Aspiration Cytology of Benign Adrenal Cortical Nodules. Acta Cytologica 1998;42:1352-8.
- Yang B, Syed ZA and Rosenthal DL. CD10 Facilitates the Diagnosis of Metastatic Renal Cell Carcinoma From Primary Adrenal Cortical Neoplasm in Adrenal Fine-Needle Aspiration. Diagn. Cytopathol. 2002;27:149-52.
- Zardauin IM. Renal FNAC Acta Cytol 1999;43:184-90.
- Zhang, PJ, Genega EM, Tomaszewski JE, Pasha TL, LiVolsi VA. The Role of Calretinin, Inhibin, Melan-A, BCL-2, and C-kit in Differentiating Adrenal Cortical and Medullary Tumors: An Immunohistochemical Study. Mod Pathol 2003;16(6):591-7.