ANOMALIES CELLULAIRES ÉPITHÉLIALES
ANOMALIES CELLULAIRES ÉPITHÉLIALES
ADÉNOCARCINOME ENDOCERVICAL :
Raheela Ashfaq, MD
Sur un frottis ThinPrep®, les cellules d’un adénocarcinome endocervical sont bien préservées et conservent les structures et dispositions glandulaires classiques observées dans d’autres méthodes de recueil en milieu liquide, à savoir l’adécarcinome présent dans des échantillons non gynécologiques. En raison de l’augmentation relative et absolue de son incidence, un nombre plus important de diagnostics d’adénocarcinome a récemment été établi. Malheureusement, l’échantillon incomplet du canal endocervical ou la mauvaise conservation du matériel glandulaire des prélèvements conventionnels du col de l’utérus rend souvent ce diagnostic difficile à établir.
Un diagnostic correct d’adénocarcinome endocervical dépend beaucoup du grade de la lésion invasive, ainsi que de la présence ou de l’absence d’une diathèse tumorale. Dans la mesure où des lésions bien différenciées peuvent être confondues avec des lésions in situ, une biopsie chirurgicale est souvent nécessaire pour établir un diagnostic définitif. En raison des techniques de fixation rapides employées avec la méthode ThinPrep, l’attention ne doit pas porter sur la seule architecture tissulaire, mais également sur les caractéristiques nucléaires. Des critères comme l’irrégularité des membranes nucléaires et l’aspect de la chromatine sont importantes pour permettre au cytologiste de distinguer des lésions glandulaires néoplasiques d’un processus bénin de réparation. L’absence de séchage à l’air se traduit par une identification plus nette des caractéristiques nucléaires et élimine la coloration « sale » de la chromatine, facilitant ainsi le diagnostic.
Comme pour d’autres entités diagnostiques, diverses affections glandulaires peuvent accompagner l’adénocarcinome sous forme d’AIS. Il est important de continuer à rechercher la présentation la plus grave de la lésion en établissant une corrélation avec une biopsie.
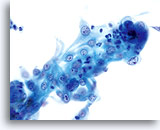
Un prélèvement correct de la lésion facilite l’établissement d’un diagnostic précis d’adénocarcinome endocervical, car des nombreux amas et groupes de cellules atypiques peuvent ainsi être visualisés au grossissement de dépistage. On note la présence du critère classique d’amas et groupes 2D. Ces groupes commencent en outre à se rassembler et affichent une différenciation glandulaire inférieure à celle observée dans l’AIS sous la forme de bandes, d’une pseudostratification et d’un encombrement. La bordure des groupes 3D peut paraître festonnée et le noyau peut sembler sortir du cytoplasme. En outre, on peut observer une leucophagocytose (cette caractéristique n’est pas exclusivement associée aux lésions endocervicales ou endométriales).
La morphologie nucléaire de l’adénocarcinome endocervical varie avec la différenciation de la lésion. Les noyaux bien différenciés présentent une chromatine finement granulaire, hyperchromatique et répartie de façon homogène et ressemblent beaucoup à ceux de l’AIS. Lorsque la lésion progresse, ils paraissent de plus en plus atypiques. Leur taille augmente et ils prennent 2/3 ou plus du cytoplasme. La chromatine devient davantage grossière et, souvent, répartie de façon irrégulière avec élimination de la parachromatine. On note également la présence de membranes nucléaires irrégulières, même si elles ont davantage tendance à onduler et à être lisses qu’à afficher les « morsures » et « mottes de terre » des lésions malpighiennes. Des macronucléoles peuvent être présents et irréguliers dans leur présentation. Enfin, la présence éventuelle de diathèse tumorale nécrotique et/ou de sang associée aux critères cellulaires permet d’établir un diagnostic de lésion invasive.
Les critères cytologiques suivants permettent d’établir un diagnostic d’adénocarcinome endocervical :
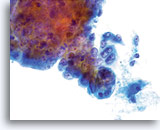
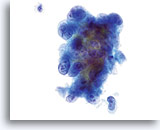
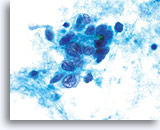
Groupes de cellules glandulaires rassemblés dans la solution PreservCyt et dont le bord peut être festonné. A noter, les bordures cytoplasmiques lisses nettes.
40x
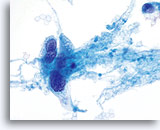
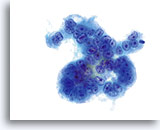
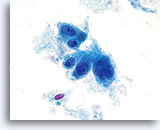
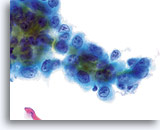
Leucophagocytose observée dans l’adénocarcinome endocervical et endométrial.
60x
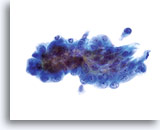
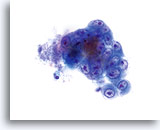
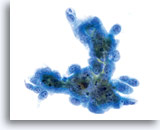
Noyaux dont la taille a augmenté, occupant souvent plus de 2/3 du cytoplasme et généralement ronds à ovales avec membranes nucléaires ondulantes.
60x
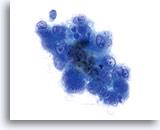
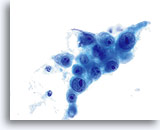
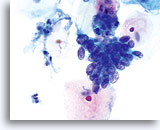
Membranes nucléaires épaissies, irrégulières et ondulantes (absence des “morsures” observées dans les lésions malpighiennes).
40x
Chromatine finement à grossièrement granulaire et pouvant sembler répartie de façon homogène bien que grossière et en motte. Noyaux hyperchromatiques et présentant une profondeur de champ supérieure à l’entité normale.
60x
Élimination évidente de la parachromatine avec noyaux présentant une profondeur de champ supérieure à ceux des cellules endocervicales normales.
60x
Lorsqu’ils sont présents, les nucléoles sont proéminents et souvent multiples et irréguliers.
60x
Diathèse tumorale paraissant “tissée” avec présentation dense ou linéaire de débris au centre et matériel à l’aspect effiloché ou arraché autour des bords du groupe.
60x
Cellules accompagnées d’hématies fantômes.
60x
Entités semblables* :
| Carcinome endocervical | Adénocarcinome in situ | Réparation endocervicale | Carcinome épidermoïde (impliquant les glandes) | |
| Présentation tissulaire | Quelques cellules isolées et amas/groupes 2D avec bordures bien définies (festonnées) | Bandes d’épithélium glandulaire avec pseudostratification, bordures en « plume », rosettes, quelques cellules isolées | Groupes plats d’épithélium | Composant malpighien définitif, amas d’épithélium mal défini avec cytoplasme mousseux et absence de différenciation glandulaire |
| Cytoplasme | Finement vacuolisé avec vacuoles discrètes multiples prédominantes, rapport N/C 2:1 | Vacuolisé, certaine différenciation des cellules prismatiques conservée, augmentation du rapport N/C | Abondant, aspect de « culture tissulaire », rapport N/C faible | Finement vacuolisé, absence de vacuoles discrètes, cytoplasme mal défini aux bords du groupe (aspect effiloché) |
| Noyau | Augmentation de la taille, rond à ovale | Augmentation de la taille, ovale à allongé | De taille variable dans un même groupe, rond | Variable, rond à ovale |
| Membrane nucléaire | Lisse à irrégulière (ondulante), épaissie | Lisse à légèrement irrégulière | Lisse | Lisse à irrégulière (morsures et mottes de terre) |
| Chromatine | Grossière, répartition non homogène, élimination de la parachromatine, augmentation de la profondeur de champ | Finement granulaire, répartition homogène, hyperchromatique, augmentation de la profondeur de champ | Finement à grossièrement granulaire, répartition homogène, hyperchromatique, absence de profondeur de champ | Finement granulaire, répartition homogène, augmentation de la profondeur de champ |
| Nucléoles | Larges, proéminents, lisses à irréguliers, isolés à multiples | Indistincts pouvant atteindre une taille modérée et être réguliers | Petits, parfois multiples, présents dans tous les noyaux | Absents à occasionnels, petits |
* Les critères ci-dessus concernent l’aspect classique de chaque entité diagnostique. Néanmoins, ces entités peuvent se chevaucher, ce qui complique l’établissement d’un diagnostic définitif. Ces critères ne constituent par conséquent qu’une base à adapter aux divers aspects épithéliaux et seuils diagnostiques.
Adénocarcinome endocervical
40x
Adénocarcinome in situ
60x
Réparation endocervicale
40x
Carcinome épidermoïde impliquant le collet glandulaire
60x
- Ashfaq R et al: ThinPrep Pap Test accuracy for glandular disease. Acta Cytol 1999;43: 81-85.
- Bai H et al: ThinPrep® Pap Test promotes detection of glandular lesions of the endocervix. Diag Cytopathol 2000; 23 (1): 19-22.
- Johnson JE and Rahemtulla A: Endocervical glandular neoplasia and its mimics in ThinPrep Pap Tests. A descriptive study. Acta Cytol 1999; 43(3): 369-75.
- Roberts JM et al: Comparison of ThinPrep and Pap Smear in relation to prediction of Adenocarcinoma In Situ. Acta Cytol 1999 Jan-Feb:43(1):74-802
- Smith HO et al: The rising incidence of adenocarcinoma relative to squamous cell carcinoma of the uterine cervix in the United States – A 24-year population-based study. Gynecol Onc 2000; 78, 97-105