Die Mamma besteht aus Fett- und Bindegewebe, die das glanduläre Gewebe unterstützen dieses stellt ein verzweigtes Drüsengangsystem dar, diese führen zu 6–10 Hauptgängen, die sich in die Brustwarze öffnen. In der Mamma können sich gutartige und bösartige Neoplasien entwickeln. Bei jüngeren Patientinnen handelt es sich zumeist um Fibroadenome, mit zunehmendem Alter werden jedoch die fibrozystischen Veränderungen häufiger. Weitere benigne Läsionen sind beispielsweise Fettgewebsnekrosen und entzündliche Erkrankungen wie der Mammaabszess und die Mastitis. Auch seltenere benigne Neoplasien wie Hamartome und pseudoangiomatöse Hyperplasie können auftreten. Zu den fibrozystischen Veränderungen gehört auch die duktale Hyperplasie. Eine atypische duktale Hyperplasie kann von einem geringgradigen duktalen Carcinoma in situ schwer zu unterscheiden sein; diese Neoplasien stehen für ein Krankheitsspektrum, aus dem sich ein Mammakarzinom entwickeln kann. Durch Strahlung kann ein Tumor entstehen, der in der Aspirationszytologie Atypiezeichen aufweisen kann. Ähnlich können auch schwangerschafts- oder laktationsbedingte Veränderungen in Aspiraten mit Malignomen verwechselt werden, daher sind klinische Daten für eine exakte zytologische Diagnostik unerlässlich.
In der Mamma können primäre Malignome oder Tumormetastasen auftreten. Zu letzteren gehören Lymphome, maligne Melanome und weitere Sekundärgeschwülste wie Metastasen von Nieren-, Bronchial-, Eierstock- und Lungenkarzinomen. Aus der diagnostischen Perspektive ist beim primären Mammakarzinom der nicht näher bezeichnete (not otherwise specified, NOS) duktale Typ am bedeutsamsten. Die zweithäufigste primäre Neoplasie der Mamma ist das lobuläre Karzinom. Das duktale wie auch das lobuläre Carcinoma in situ sind durch Exzisionsbiopsie leicht zu diagnostizieren, zytologisch jedoch deutlich schwerer zu befunden.
Die Zytologie der Mamma spielt sowohl für Screening-Zwecke als auch für die Diagnostik eine Rolle. Aus jeder bei einem Mammographie-Screening entdeckten Neoplasie kann mit einer feinen Nadel eine Probe entnommen werden, bei palpablen Tumoren durch direkte Aspiration und bei nicht-palpablen, unter stereotactischer oder Kontrolle. Bei unbefriedigenden oder nicht eindeutigen zytologischen Resultaten können die Stanzbiopsie bzw. Gefrierschnitte eingesetzt werden. Aspirate aus palpierbaren Mammatumoren sind problemlos zu aspirieren und für eine schnelle Diagnostik rasch zu verarbeiten.
Die Zytologie von Feinnadelaspiraten ist ein wichtiges Hilfsmittel bei der Diagnostik von palpablen und nicht-palpablen Tumoren der Mamma. Es ist ein sicheres, schnelles, preiswertes (im Vergleich zur Stanzbiopsie) und relativ schmerzloses Verfahren, das sowohl Kliniker als auch Pathologen durchführen können. Bei Zytopathologen kommt es nur selten zu unzureichenden Ergebnissen, da die Probe mittels Schnellfärbung auf ihre Adäquanz untersucht, und das Verfahren ggf. wiederholt werden kann. In den Händen erfahrener Zytopathologen ist die zyto-histologische Korrelation ausgezeichnet. Ein kleiner Nachteil von Feinnadelaspiraten ist, dass nicht immer zwischen invasiven Tumoren und Carcinomata in situ unterschieden werden kann, aber dieses Problem tritt manchmal auch bei Stanzbiopsien auf.
Das aspirierte Material wird entweder auf einem Glas-Objektträger ausgestrichen oder in Cytolyt® Lösung ausgespült, wobei die Nadel nach jedem Arbeitsgang mit derselben Lösung ausgespült wird. Die Flüssigkeit kann verwendet werden, um mehrere fast identische Objektträger zu präparieren, wodurch dem Labor Material für Spezialfärbungen wie, Östrogen- bzw. Progesteronrezeptoren und die HER2/neu-Protein Überexpression, zur Verfügung steht.
Aspirate aus Bereichen mit Mastitis bzw. -Mammaabszess enthalten zahlreiche Neutrophile, Histiozyten, mehrkernige histiozytäre Riesenzellen, wenige degenerierte Epithelzellen und ein proteinhaltiges Material, das eine Nekrose imitieren kann. Derartige Befunde sind bei stillenden Müttern nicht ungewöhnlich. Fettgewebsnekrose entsteht nach Traumata, z.B. durch einen direkten Schlag auf die Mamma bzw. nach chirurgischen Eingriffen oder einer Bestrahlungstherapie. Klinisch und mammographisch imitiert eine Fettgewebsnekrose ein Mammakarzinom, indem sie einen harten, unregelmäßigen Tumor bildet. Allerdings unterstützt das Aspirat die Diagnostik, da es aus degenerierenden Fettzellen und zahlreichen Lipophagen zusammengesetzt ist.
Fibroadenome imponieren als feste, glatte, bewegliche Mammatumoren. Sie fühlen sich gewöhnlich gummiartig an die Nadelspitze kann sich festsetzen. Die Aspirate sind normalerweise zellreich und weisen große, verzweigte Verbände gutartiger Duktuszellen mit einigen ‚Sesamsamen’ (Myoepithelzellen) auf der Oberfläche auf. Auf ThinPrep-Ausstrichen zeigen die einzelnen Myoepithelzellen im Hintergrund die Tendenz, sich angrenzend an die Duktuszellen zusammenzuballen. Bei den Duktuszellen kommt es häufig zur Überlappung, ein Hinweis auf duktale Hyperplasie. Erkennbar sind Bindegewebsfragmente in verschiedenen Größen mit spindelförmigen Zellkernen.
Auch die Zusammensetzung niedrigmaligner phylloides Tumoren (zellreiches, intrakanalikuläres Fibroadenom) ist fibroepithelial, wobei das glanduläre Element deutlich ein Fibroadenoms imitiert. Allerdings ist eine duktale Hyperplasie bei Cystosarcoma-Phylloides-Tumoren wesentlich häufiger. Die Bindegewebskomponente ist zumeist markant und weist große, hyperzelluläre Bindegewebsfragmente auf. Es können ferner zahlreiche Verbände von Stromazellen beobachtet werden. Maligne Phylloides-Tumoren zeigen eindeutige Merkmale von der Malignität.
Bei der fibrozystischen Veränderungen handelt es sich um eine ziemlich häufig auftretende, zystische Veränderung, die von einer apokrinen Metaplasie, einer duktalen Hyperplasie des gewöhnlichen Typs und sonstigen Formen der Epithelproliferation begleitet ist.. Zytologisch findet man hierbei beispielsweise Verbände und Gruppen gutartiger, sich überlappender Duktuszellen mit Myoepithelien, apokrine Metaplasiezellen, schaumige Makrophagen und Kalzium. Die Merkmale können zytologisch die eines Fibroadenoms imitieren, typisch für einen klinischen Befund allerdings ist eher eine schlecht definierte Verdickung oder Leiste, anstelle des glatten beweglichen Tumors eines Fibroadenoms. Zystische Veränderungen können bis zu palpierbaren, leicht zu aspirierenden Zysten ausbilden. Die Flüssigkeit kann klar und farblos oder trüb, braun, grün oder blutig sein. Zystenflüssigkeiten enthalten proteinhaltiges Material, gutartige Duktuszellen, die degeneriert oder leicht atypisch aussehen können, apokrin metaplastische Zellen und schaumige Makrophagen. Braune oder grüne Zystenflüssigkeit ist ein Hinweis auf vorangegangene Blutungen, die durch das Vorhandensein hämosiderinhaltiger Makrophagen auf dem Objektträger bestätigt werden. Apokrin metaplastische Zellen zeigen reichlich granuliertes Zytoplasma und runde Zellkerne mit prominenten Nukleolen. Sie können doppelkernig sein und aufgrund der unterschiedlichen Zellkerngröße atypisch erscheinen.
Kollagene Sphärulose ist eine benigne Läsion, die eine duktale oder lobuläre Hyperplasie begleiten kann. Die Aspirate enthalten Kügelchen von extrazellulärem Material (die sich in der Papanicolaou-Färbung blass-blau und mit DiffQuik rosa färben), benigne Duktuszellen, apokrin metaplastische Zellen und Myoepithelien. Zur Differenzialdiagnose gehört das adenoid-zystisches Karzinom.
Duktuskarzinome treten zumeist unilateral auf. Klinisch treten sie in Form eines festen bis harten, unregelmäßigen Tumors in Erscheinung, der mammographisch das charakteristische Erscheinungsbild eines Tumors, einer sternförmigen Masse oder von Mikroverkalkungen aufweist. Obwohl vermutet wird, dass das duktale Carcinoma in situ, der Vorgänger eines invasiven Duktuskarzinoms ist, kann es auch zusammen mit einem invasiven lobulären Karzinom auftreten. In ähnlicher Weise kann auch ein lobuläres Carcinoma in situ sowohl mit einem Duktuskarzinom als auch mit einem invasiven lobulären Karzinom assoziiert sein. Die Aspirate der duktalen Carcinomata in situ zeigen Malignitätskriterien, können aber auch, von Myoepithelien überlagerte, Zellcluster aufweisen. Aspirate des invasiven Duktuskarzinoms (NOS) sind zellreich und bestehen aus großen, oft pleomorphen Tumorzellen. Es kann schwierig sein, zwischen den Zellen niedrigmaligner Duktuskarzinome und benignen Duktuszellen zu unterscheiden. Werden Tumorzellen gefunden, die zwischen die Fettzellen infiltrieren, ist dies ein Hinweis auf einen invasiven Prozess.
Lobuläre Karzinome sind häufig bilateral. Klinisch ist dieser Tumor schlecht definiert und zeigt kein typisches mammographisches Erscheinungsbild. Ein lobuläres Carcinoma in situ tritt in Form abgerundeter Verbände kleiner maligner Zellen auf, die zum Teil intrazytoplasmatische Vakuolen aufweisen, häufig finden sich darüber liegenden Myoepithelzellen. Aspirate invasiver lobulärer Karzinome sind spärlich und führen oft zu dem Befund ‚nicht zufrieden stellend’ oder ‚atypisch’. Die Zellen sind kleiner als beim Duktuskarzinom, häufig vereinzelt, mit exzentrischen Zellkernen und intrazytoplasmatischen Vakuolen. Zumeist sind keine Nukleoli erkennbar. Die Zellen sind häufig in einer Reihe (Gänsemarsch-Anordung) angeordnet. In den Aspiraten lobulärer Karzinome können Siegelringzellen vorhanden sein.
Ferner gibt es noch besondere Formen von Duktuskarzinomen, beispielsweise tubuläre, kolloidale (muzinöse), metaplastische, medulläre, apokrine und die Plattenepithel-Karzinome. Die Definition vieler dieser Spezialformen von Mammatumoren beruht auf dem Nachweis, dass mehr als 90 % der Neoplasien die typischen Charakteristika des betreffenden Typs aufweist. Da für die Zytologie nur eine Probe aus einem Teilbereich des Tumors verwendet wird, ist es nicht exakt, diese Tumoren zytologisch als tubulär oder muzinös zu kategorisieren. Der Verdacht kann im Befund geäußert werden, indem anstelle der Angabe eines definitiven Typs, der sich von dem der Exzisionsprobe unterscheiden kann, ein Zusatz wie „Duktuskarzinom mit muzinösen oder tubulären Merkmalen“ hinzugefügt wird. Tubuläre Karzinome bestehen häufig aus tubulo-azinären Strukturen. Die Aspirate muzinöser Karzinome sind zumeist sehr schleimig und zeigen auf dem Ausstrich eine große Menge an Schleim. Es können auch seltene Formen wie das adenoid-zystische Karzinom auftreten, das identisch mit dem Speicheldrüsenkarzinom ist. Dieser Tumor imitiert die gutartige kollagene Sphärulose, denn er enthält ebenfalls extrazelluläres hyalines Material, das zwar dieselben Färbeeigenschaften aufweist, aber in Form globulärer und tubulärer oder zylindrischer Strukturen auftritt. Die begleitenden Tumorzellen sind klein und bland mit wenig Zytoplasma, allerdings sind keine benignen duktalen, apokrinen oder metaplastischen Zellen zu sehen.
Erinnerung: Sie können auf jedes Bild klicken, um dieses vergrößert zu betrachten.
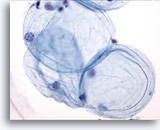
Abbildung 1
Feinnadelaspiration der Mamma, Fett.
Fettzellen oder Adipozyten sind große kugelige Zellen mit durchscheinendem Zytoplasma und kleinen exzentrischen Zellkernen. Sie sind sowohl in benignen als auch malignen Aspiraten vorhanden.
40x
Abbildung 1
Feinnadelaspiration der Mamma, Fett.
Fettzellen oder Adipozyten sind große kugelige Zellen mit durchscheinendem Zytoplasma und kleinen exzentrischen Zellkernen. Sie sind sowohl in benignen als auch malignen Aspiraten vorhanden.
40x
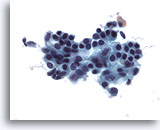
Abbildung 2
Feinnadelaspiration der Mamma, Benigne Duktuszellen.
In normalen Aspiraten der Mamma finden sich benigne Duktuszellen, oft zusammen mit Myoepithelzellen.
40x
Abbildung 2
Feinnadelaspiration der Mamma, Benigne Duktuszellen.
In normalen Aspiraten der Mamma finden sich benigne Duktuszellen, oft zusammen mit Myoepithelzellen.
40x
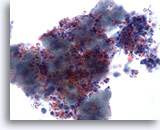
Abbildung 3
Feinnadelaspiration der Mamma, Abszess.
In Feinnadelaspiraten von Mammaabszessen sind normalerweise keine Epithelzellen vorhanden. Allgemein-Kriterien sind Zelltrümmer, lysierte Erythrozyten und Neutrophile.
40x
Abbildung 3
Feinnadelaspiration der Mamma, Abszess.
In Feinnadelaspiraten von Mammaabszessen sind normalerweise keine Epithelzellen vorhanden. Allgemein-Kriterien sind Zelltrümmer, lysierte Erythrozyten und Neutrophile.
40x
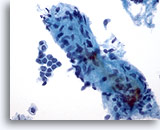
Abbildung 4: Feinnadelaspiration der Mamma, Fibroadenom.
Erkennbar ist ein großes, wenige kleine, spindelförmige Zellkerne enthaltendes Bindegewebsfragment. Bindegewebsfragmente können in Aspiraten von benignem Mammagewebe, aber auch in fibroepithelialen Läsionen wie Fibroadenomen vorkommen. Bindegewebsfragmente von Phylloides-Tumoren sind erheblich zellreicher. Zu sehen ist ferner eine kleine Gruppe benigner Duktuszellen.
40x
Abbildung 4
Feinnadelaspiration der Mamma, Fibroadenom.
Erkennbar ist ein großes, wenige kleine, spindelförmige Zellkerne enthaltendes Bindegewebsfragment. Bindegewebsfragmente können in Aspiraten von benignem Mammagewebe, aber auch in fibroepithelialen Läsionen wie Fibroadenomen vorkommen. Bindegewebsfragmente von Phylloides-Tumoren sind erheblich zellreicher. Zu sehen ist ferner eine kleine Gruppe benigner Duktuszellen.
40x
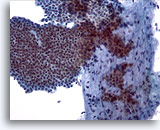
Abbildung 5
Feinnadelaspiration der Mamma, Fibroadenom.
Größerer verzweigter Verband, unimorpher, benigner Duktuszellen mit guter Zellkohäsion, der ein Bindegewebsfragment überlagert. Innerhalb des Bindegewebsfragments sind kleine, leicht spindelförmige Zellkerne von Stromazellen zu sehen.
20x
Abbildung 5
Feinnadelaspiration der Mamma, Fibroadenom.
Größerer verzweigter Verband, unimorpher, benigner Duktuszellen mit guter Zellkohäsion, der ein Bindegewebsfragment überlagert. Innerhalb des Bindegewebsfragments sind kleine, leicht spindelförmige Zellkerne von Stromazellen zu sehen.
20x
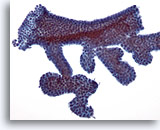
Abbildung 6
Feinnadelaspiration der Mamma, Fibroadenom.
Aspirate von Fibroadenomen enthalten normalerweise größere verzweigte Verbände benigner Duktuszellen, wie auf dieser Abbildung zu sehen.
20x
Abbildung 6
Feinnadelaspiration der Mamma, Fibroadenom.
Aspirate von Fibroadenomen enthalten normalerweise größere verzweigte Verbände benigner Duktuszellen, wie auf dieser Abbildung zu sehen.
20x
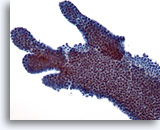
Abbildung 7
Feinnadelaspiration der Mamma, Fibroadenom.
Ein weiteres Beispiel für die Verästelung der Duktuszellverbände bei Fibroadenomen.
20x
Abbildung 7
Feinnadelaspiration der Mamma, Fibroadenom.
Ein weiteres Beispiel für die Verästelung der Duktuszellverbände bei Fibroadenomen.
20x
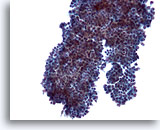
Abbildung 8
Feinnadelaspiration der Mamma, Fibroadenom.
Manchmal weisen die Duktuszellverbände anstelle der, auf den beiden vorhergehenden Bildern zu sehenden, langen Verzweigungen auch wie hier, kleine abgerundete Vorsprünge auf.
20x
Abbildung 8
Feinnadelaspiration der Mamma, Fibroadenom.
Manchmal weisen die Duktuszellverbände anstelle der, auf den beiden vorhergehenden Bildern zu sehenden, langen Verzweigungen auch wie hier, kleine abgerundete Vorsprünge auf.
20x
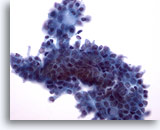
Abbildung 9: Feinnadelaspiration der Mamma, Fibroadenom.
Vermutlich aufgrund der Verarbeitung im wässrigen Medium sind die Ränder der Duktuszellengruppe in diesem Bereich nicht glatt wie auf den beiden vorhergehenden Bildern. Innerhalb der Duktuszellengruppe und am oberen Rand sind wenige Myoepithelzellen zu sehen. Bei Verarbeitung mit ThinPrep treten Myoepithelzellen häufig angrenzend an Gruppen von Duktuszellen auf, anstatt wie bei herkömmlichen Ausstrichen verstreut im Hintergrund.
40x
Abbildung 9
Feinnadelaspiration der Mamma, Fibroadenom.
Vermutlich aufgrund der Verarbeitung im wässrigen Medium sind die Ränder der Duktuszellengruppe in diesem Bereich nicht glatt wie auf den beiden vorhergehenden Bildern. Innerhalb der Duktuszellengruppe und am oberen Rand sind wenige Myoepithelzellen zu sehen. Bei Verarbeitung mit ThinPrep treten Myoepithelzellen häufig angrenzend an Gruppen von Duktuszellen auf, anstatt wie bei herkömmlichen Ausstrichen verstreut im Hintergrund.
40x
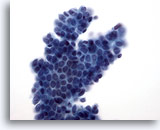
Abbildung 10
Feinnadelaspiration der Mamma, Fibroadenom.
Ein verzweigter, von Myoepithelzellen überlagerter, Verband benigner Duktuszellen führt zum charakteristischen „Sesambrötchen“-Erscheinungsbild.
40x
Abbildung 10
Feinnadelaspiration der Mamma, Fibroadenom.
Ein verzweigter, von Myoepithelzellen überlagerter, Verband benigner Duktuszellen führt zum charakteristischen „Sesambrötchen“-Erscheinungsbild.
40x
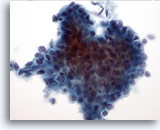
Abbildung 11: Feinnadelaspiration der Mamma, Geringgradiger Phylloides-Tumor.
Phylloides-Tumoren sind fibroepitheliale Läsionen, ebenso wie Fibroadenome. Allerdings können sogar die niedrigmalignen Läsionen rezidivieren, wenn sie nicht weiträumig exzidiert werden. Die glanduläre Komponente ähnelt zwar derjenigen bei Fibroadenomen, kann jedoch ein deutlich zellreicheres und hyperplastisches Erscheinungsbild zeigen. In dieser Abbildung ist ein dreidimensionaler Verband von Duktuszellen mit Kernüberlappung und Kerndrängeln (Crowding) erkennbar, ein Hinweis auf hyperplastische Veränderungen.
40x
Abbildung 11
Feinnadelaspiration der Mamma, Geringgradiger Phylloides-Tumor.
Phylloides-Tumoren sind fibroepitheliale Läsionen, ebenso wie Fibroadenome. Allerdings können sogar die niedrigmalignen Läsionen rezidivieren, wenn sie nicht weiträumig exzidiert werden. Die glanduläre Komponente ähnelt zwar derjenigen bei Fibroadenomen, kann jedoch ein deutlich zellreicheres und hyperplastisches Erscheinungsbild zeigen. In dieser Abbildung ist ein dreidimensionaler Verband von Duktuszellen mit Kernüberlappung und Kerndrängeln (Crowding) erkennbar, ein Hinweis auf hyperplastische Veränderungen.
40x
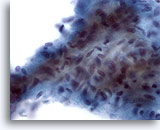
Abbildung 12
Feinnadelaspiration der Mamma, Geringgradiger Phylloides-Tumor.
Dieses Bindegewebsfragment ist hyperzellulär und enthält dicht gelagerte, plumpe Spindelzellen. Ferner sind im Hintergrund dieser Läsion zahlreiche einzelne Stroma-Spindelzellen zu sehen.
60x
Abbildung 12
Feinnadelaspiration der Mamma, Geringgradiger Phylloides-Tumor.
Dieses Bindegewebsfragment ist hyperzellulär und enthält dicht gelagerte, plumpe Spindelzellen. Ferner sind im Hintergrund dieser Läsion zahlreiche einzelne Stroma-Spindelzellen zu sehen.
60x
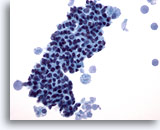
Abbildung 13
Feinnadelaspiration der Mamma, Fibrozystische Veränderungen.
Dieser Bereich zeigt einen dichten Verband benigner Duktuszellen mit schaumigen Makrophagen an jeder Seite und Sekretmaterial im Hintergrund.
40x
Abbildung 13
Feinnadelaspiration der Mamma, Fibrozystische Veränderungen.
Dieser Bereich zeigt einen dichten Verband benigner Duktuszellen mit schaumigen Makrophagen an jeder Seite und Sekretmaterial im Hintergrund.
40x
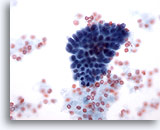
Abbildung 14
Feinnadelaspiration der Mamma, Fibrozystische Veränderungen.
Diese kleine Gruppe benigner Duktuszellen stammt aus dem Aspirat einer fibrozystischen Veränderung.
40x
Abbildung 14
Feinnadelaspiration der Mamma, Fibrozystische Veränderungen.
Diese kleine Gruppe benigner Duktuszellen stammt aus dem Aspirat einer fibrozystischen Veränderung.
40x
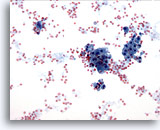
Abbildung 15
Feinnadelaspiration der Mamma, Fibrozystische Veränderungen.
Bei fibrozystischen Veränderungen sind Sekretniederschläge im Hintergrund, Blut und apokrine metaplastische Zellen zu sehen.
20x
Abbildung 15
Feinnadelaspiration der Mamma, Fibrozystische Veränderungen.
Bei fibrozystischen Veränderungen sind Sekretniederschläge im Hintergrund, Blut und apokrine metaplastische Zellen zu sehen.
20x
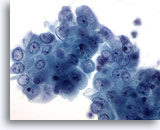
Abbildung 16
Feinnadelaspiration der Mamma, Zystenflüssigkeit.
Dieser Verband benigner Duktuszellen weist eine leichte Atypie in Form sichtbarer Nukleoli und einer geringfügigen Zellkernvergrößerung auf. Derartige minimale Veränderungen werden häufig in Mammazysten beobachtet.
60x
Abbildung 16
Feinnadelaspiration der Mamma, Zystenflüssigkeit.
Dieser Verband benigner Duktuszellen weist eine leichte Atypie in Form sichtbarer Nukleoli und einer geringfügigen Zellkernvergrößerung auf. Derartige minimale Veränderungen werden häufig in Mammazysten beobachtet.
60x
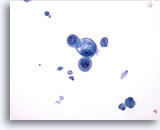
Abbildung 17
Feinnadelaspiration der Mamma, Zystenflüssigkeit.
Dieser Bereich zeigt eine kleine Gruppe benigner Epithelzellen, von denen eine vakuolisiert ist, mit Zystendetritus im Hintergrund.
40x
Abbildung 17
Feinnadelaspiration der Mamma, Zystenflüssigkeit.
Dieser Bereich zeigt eine kleine Gruppe benigner Epithelzellen, von denen eine vakuolisiert ist, mit Zystendetritus im Hintergrund.
40x
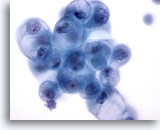
Abbildung 18
Feinnadelaspiration der Mamma, Zystenflüssigkeit.
Benigne Duktuszellen in Zystenflüssigkeit können degenerative Veränderungen wie die hier abgebildete Vakuolisierung aufweisen. Diese Veränderungen sollten nicht als Karzinom befundet werden.
60x
Abbildung 18
Feinnadelaspiration der Mamma, Zystenflüssigkeit.
Benigne Duktuszellen in Zystenflüssigkeit können degenerative Veränderungen wie die hier abgebildete Vakuolisierung aufweisen. Diese Veränderungen sollten nicht als Karzinom befundet werden.
60x
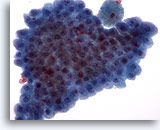
Abbildung 19
Feinnadelaspiration der Mamma, Apokrine Metaplasie.
Benigne apokrine Zellen treten oft in flachen Verbänden auf. Sie werden gewöhnlich in Zystenflüssigkeiten und Feinnadelaspiraten aus Bereichen mit fibrozystischen Veränderungen beobachtet.
40x
Abbildung 19
Feinnadelaspiration der Mamma, Apokrine Metaplasie.
Benigne apokrine Zellen treten oft in flachen Verbänden auf. Sie werden gewöhnlich in Zystenflüssigkeiten und Feinnadelaspiraten aus Bereichen mit fibrozystischen Veränderungen beobachtet.
40x
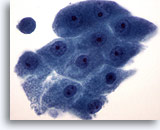
Abbildung 20
Feinnadelaspiration der Mamma, Apokrine Metaplasie.
Apokrine Zellen weisen weites, granuliertes Zytoplasma und runde Zellkerne mit prominenten Nukleolen auf. Ihre Zellgrenzen sind sie normalerweise eindeutig voneinander abgegrenzt.
60x
Abbildung 20
Feinnadelaspiration der Mamma, Apokrine Metaplasie.
Apokrine Zellen weisen weites, granuliertes Zytoplasma und runde Zellkerne mit prominenten Nukleolen auf. Ihre Zellgrenzen sind sie normalerweise eindeutig voneinander abgegrenzt.
60x
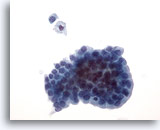
Abbildung 21: Feinnadelaspiration der Mamma, Zystisch-papilläre Läsion.
Aspirate von zystisch-papillären Läsionen enthalten epitheliale Zellen sowie schaumige Makrophagen. Die benignen Duktuszellen in diesem Verband sind von einheitlicher Größe und Form und zeigen an einem Rand eine Palisadenanordnung. Oberhalb des Verbandes sind ein schaumiger Makrophage und eine einzelne benigne Duktuszelle zu sehen. Das Vorliegen leichter Zellatypien kann die Unterscheidung zwischen einer benignen und einer malignen papillären Läsion erschweren.
40x
Abbildung 21
Feinnadelaspiration der Mamma, Zystisch-papilläre Läsion.
Aspirate von zystisch-papillären Läsionen enthalten epitheliale Zellen sowie schaumige Makrophagen. Die benignen Duktuszellen in diesem Verband sind von einheitlicher Größe und Form und zeigen an einem Rand eine Palisadenanordnung. Oberhalb des Verbandes sind ein schaumiger Makrophage und eine einzelne benigne Duktuszelle zu sehen. Das Vorliegen leichter Zellatypien kann die Unterscheidung zwischen einer benignen und einer malignen papillären Läsion erschweren.
40x
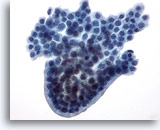
Abbildung 22
Feinnadelaspiration der Mamma, Zystisch-papilläre Läsion.
Dieser Verband benigner Duktuszellen weist einen abgerundeten, palisadenförmigen Rand auf und sieht dadurch wie eine papilläre Struktur aus, obwohl kein fibrovaskulärer Kern erkennbar ist.
40x
Abbildung 22
Feinnadelaspiration der Mamma, Zystisch-papilläre Läsion.
Dieser Verband benigner Duktuszellen weist einen abgerundeten, palisadenförmigen Rand auf und sieht dadurch wie eine papilläre Struktur aus, obwohl kein fibrovaskulärer Kern erkennbar ist.
40x
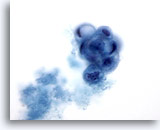
Abbildung 23: Feinnadelaspiration der Mamma, Zystisch-papilläre Läsion.
In diesem Bereich ist neben Sekretmaterial ein rundlicher papillärer Verband degenerierender, vakuolisierter Duktuszellen zu sehen. Dieses Zellbild sollte als atypisch befundet werden, da nicht immer zwischen benignen und malignen papillären Läsionen unterschieden werden kann. Sind apokrin metaplastischer Zellen vorhanden, so deutet dies gewöhnlich auf einen benignen Prozess hin.
60x
Abbildung 23
Feinnadelaspiration der Mamma, Zystisch-papilläre Läsion.
In diesem Bereich ist neben Sekretmaterial ein rundlicher papillärer Verband degenerierender, vakuolisierter Duktuszellen zu sehen. Dieses Zellbild sollte als atypisch befundet werden, da nicht immer zwischen benignen und malignen papillären Läsionen unterschieden werden kann. Sind apokrin metaplastischer Zellen vorhanden, so deutet dies gewöhnlich auf einen benignen Prozess hin.
60x
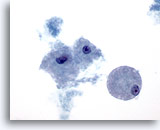
Abbildung 24
Feinnadelaspiration der Mamma, Zystisch-papilläre Läsion.
Schaumige Makrophagen, wie hier abgebildet, werden sowohl bei benignen als auch malignen zystischen Läsionen beobachtet, unabhängig davon, ob diese papillär sind.
60x
Abbildung 24
Feinnadelaspiration der Mamma, Zystisch-papilläre Läsion.
Schaumige Makrophagen, wie hier abgebildet, werden sowohl bei benignen als auch malignen zystischen Läsionen beobachtet, unabhängig davon, ob diese papillär sind.
60x
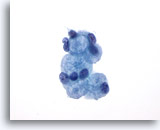
Abbildung 25: Feinnadelaspiration der Mamma, Kollagene Sphärulose.
Hierbei handelt es sich um eine benigne Läsion, gewöhnlich ein Zufallsbefund bei Mammabiopsien. Sie bildet selten eine palpierbare Masse. Das Aspirat enthält Anzeichen für eine benigne duktale Hyperplasie, benigne Duktuszellen und apokrin metaplastische Zellen, Myoepithelzellen sowie von kleinen benignen Epithelzellen umgebene Kügelchen extrazellulären Materials. Ein ähnliches Bild bieten Aspirate aus adenoid-zystischen Mammakarzinomen.
60x
Abbildung 25
Feinnadelaspiration der Mamma, Kollagene Sphärulose.
Hierbei handelt es sich um eine benigne Läsion, gewöhnlich ein Zufallsbefund bei Mammabiopsien. Sie bildet selten eine palpierbare Masse. Das Aspirat enthält Anzeichen für eine benigne duktale Hyperplasie, benigne Duktuszellen und apokrin metaplastische Zellen, Myoepithelzellen sowie von kleinen benignen Epithelzellen umgebene Kügelchen extrazellulären Materials. Ein ähnliches Bild bieten Aspirate aus adenoid-zystischen Mammakarzinomen.
60x
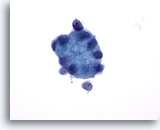
Abbildung 26
Feinnadelaspiration der Mamma, Kollagene Sphärulose.
Dieses große Kügelchen aus hyalinem Material ist von kleinen Epithelzellen umgeben.
60x
Abbildung 26
Feinnadelaspiration der Mamma, Kollagene Sphärulose.
Dieses große Kügelchen aus hyalinem Material ist von kleinen Epithelzellen umgeben.
60x
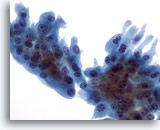
Abbildung 27
Feinnadelaspiration der Mamma, Kollagene Sphärulose/apokrine Metaplasie.
Im Aspirat des oben abgebildeten Falls einer kollagenen Sphärulose war ein Verband apokrine metaplastischer Zellen mit relativ weitem Zytoplasma erkennbar.
40x
Abbildung 27
Feinnadelaspiration der Mamma, Kollagene Sphärulose/apokrine Metaplasie.
Im Aspirat des oben abgebildeten Falls einer kollagenen Sphärulose war ein Verband apokrine metaplastischer Zellen mit relativ weitem Zytoplasma erkennbar.
40x
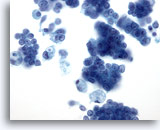
Abbildung 28: Feinnadelaspiration der Mamma, Duktales Carcinoma in situ.
Zellreiches Aspirat mit Tumorzellverbänden, einzelnen malignen Zellen und schaumigen Makrophagen. Das duktale Carcinoma in situ (Ductal carcinoma in situ, DCIS) zeigt häufig von Myoepithelien überlagerte maligne Zellcluster. Die Tumorzellen treten eher in Verbänden auf anstatt einzeln wie bei invasiven Tumoren. Außerdem sind Tubulusstrukturen nicht mit DCIS assoziiert. Bei der Comedo-Form des DCIS findet man typischerweise Nekrose und Kalzium vor.
40x
Abbildung 28
Feinnadelaspiration der Mamma, Duktales Carcinoma in situ.
Zellreiches Aspirat mit Tumorzellverbänden, einzelnen malignen Zellen und schaumigen Makrophagen. Das duktale Carcinoma in situ (Ductal carcinoma in situ, DCIS) zeigt häufig von Myoepithelien überlagerte maligne Zellcluster. Die Tumorzellen treten eher in Verbänden auf anstatt einzeln wie bei invasiven Tumoren. Außerdem sind Tubulusstrukturen nicht mit DCIS assoziiert. Bei der Comedo-Form des DCIS findet man typischerweise Nekrose und Kalzium vor.
40x
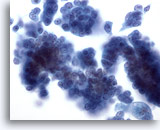
Abbildung 29
Feinnadelaspiration der Mamma, Duktales Carcinoma in situ.
Zu sehen sind Verbände relativ blander Tumorzellen. Die Zellgruppe rechts vermittelt einen vagen Eindruck eines fibrovaskulären Kerns.
40x
Abbildung 29
Feinnadelaspiration der Mamma, Duktales Carcinoma in situ.
Zu sehen sind Verbände relativ blander Tumorzellen. Die Zellgruppe rechts vermittelt einen vagen Eindruck eines fibrovaskulären Kerns.
40x
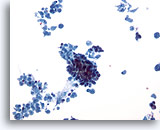
Abbildung 30
Feinnadelaspiration der Mamma, Duktuskarzinom.
Dieser Fall eines invasiven Duktuskarzinoms zeigt bei schwacher Vergrößerung eine ausgeprägte zelluläre Nekrose mit einem dichten Zellverband in der Mitte.
20x
Abbildung 30
Feinnadelaspiration der Mamma, Duktuskarzinom.
Dieser Fall eines invasiven Duktuskarzinoms zeigt bei schwacher Vergrößerung eine ausgeprägte zelluläre Nekrose mit einem dichten Zellverband in der Mitte.
20x
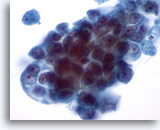
Abbildung 31
Feinnadelaspiration der Mamma, Duktuskarzinom.
Bei stärkerer Vergrößerung der neoplastischen Zellen sind die dichte Zelllagerung und prominente Nukleolen erkennbar. Das Chromatin ist atypisch blass, aber abnormal.
60x
Abbildung 31
Feinnadelaspiration der Mamma, Duktuskarzinom.
Bei stärkerer Vergrößerung der neoplastischen Zellen sind die dichte Zelllagerung und prominente Nukleolen erkennbar. Das Chromatin ist atypisch blass, aber abnormal.
60x
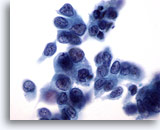
Abbildung 32
Feinnadelaspiration der Mamma, Duktuskarzinom.
Die Tumorzellen in diesem Bereich weisen eine gewisse Dissoziation, Pleomorphie, nukleäre Unregelmäßigkeit, Hyperchromasie und Nukleoli auf.
60x
Abbildung 32
Feinnadelaspiration der Mamma, Duktuskarzinom.
Die Tumorzellen in diesem Bereich weisen eine gewisse Dissoziation, Pleomorphie, nukleäre Unregelmäßigkeit, Hyperchromasie und Nukleoli auf.
60x
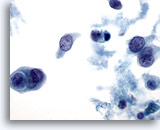
Abbildung 33
Feinnadelaspiration der Mamma, Duktuskarzinom.
Auf diesem Bild sind Nekrose, Kannibalismus der Tumorzellen und Zelldissoziation erkennbar.
60x
Abbildung 33
Feinnadelaspiration der Mamma, Duktuskarzinom.
Auf diesem Bild sind Nekrose, Kannibalismus der Tumorzellen und Zelldissoziation erkennbar.
60x
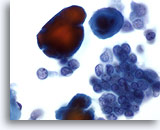
Abbildung 34
Feinnadelaspiration der Mamma, Duktuskarzinom, niedrig maligne.
Hier sind, neben den durch Papanicolaou-Färbung rot gefärbten Kalziumpartikeln, Karzinomzellverbände und einzelne Karzinomzellen erkennbar. Das monomorphe Erscheinungsbild der Zellen, die glatte Kernränder und Mikronukleoli aufweisen, deutet auf ein niedrigmalignes Duktuskarzinom hin.
60x
Abbildung 34
Feinnadelaspiration der Mamma, Duktuskarzinom, niedrig maligne.
Hier sind, neben den durch Papanicolaou-Färbung rot gefärbten Kalziumpartikeln, Karzinomzellverbände und einzelne Karzinomzellen erkennbar. Das monomorphe Erscheinungsbild der Zellen, die glatte Kernränder und Mikronukleoli aufweisen, deutet auf ein niedrigmalignes Duktuskarzinom hin.
60x
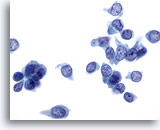
Abbildung 35
Feinnadelaspiration der Mamma, Duktuskarzinom, niedrig maligne.
In diesem Bereich sind viele einzelne Karzinomzellen zu erkennen. Die Zellkerne sind zwar blass, aber das Chromatinmuster ist eindeutig atypisch. In diesem Fall sind die Nukleolen nicht vergrößert.
60x
Abbildung 35
Feinnadelaspiration der Mamma, Duktuskarzinom, niedrig maligne.
In diesem Bereich sind viele einzelne Karzinomzellen zu erkennen. Die Zellkerne sind zwar blass, aber das Chromatinmuster ist eindeutig atypisch. In diesem Fall sind die Nukleolen nicht vergrößert.
60x
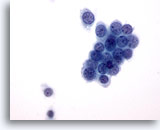
Abbildung 36
Feinnadelaspiration der Mamma, Duktuskarzinom, niedrig maligne.
Dies ist ein Beispiel für ein niedrig malignes Duktuskarzinom. Einige Tumorzellen bilden einen dichten Verband sowie einige wenige, einzelne Zellen. Beachtenswert sind die runden Kernränder.
60x
Abbildung 36
Feinnadelaspiration der Mamma, Duktuskarzinom, niedrig maligne.
Dies ist ein Beispiel für ein niedrig malignes Duktuskarzinom. Einige Tumorzellen bilden einen dichten Verband sowie einige wenige, einzelne Zellen. Beachtenswert sind die runden Kernränder.
60x
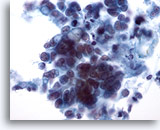
Abbildung 37
Feinnadelaspiration der Mamma, Duktuskarzinom.
Dieser Bereich zeigt Tumorzellen, die einzeln oder in kleinen Verbänden vorliegen. Manche Zellen scheinen intrazytoplasmatische Vakuolen zu enthalten. Anisonukleose innerhalb der Zellverbände.
40x
Abbildung 37
Feinnadelaspiration der Mamma, Duktuskarzinom.
Dieser Bereich zeigt Tumorzellen, die einzeln oder in kleinen Verbänden vorliegen. Manche Zellen scheinen intrazytoplasmatische Vakuolen zu enthalten. Anisonukleose innerhalb der Zellverbände.
40x
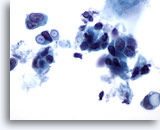
Abbildung 38
Feinnadelaspiration der Mamma, Duktuskarzinom.
Diese malignen Zellen weisen eindeutig abgegrenzte intrazytoplasmatische Vakuolen auf, die zum Teil „schießscheibenartig“ („targetoid“) sind. Dieses Merkmal gilt zwar normalerweise als charakteristisch für das lobuläre Karzinom, kann aber auch bei Duktuskarzinomen vorhanden sein.
60x
Abbildung 38
Feinnadelaspiration der Mamma, Duktuskarzinom.
Diese malignen Zellen weisen eindeutig abgegrenzte intrazytoplasmatische Vakuolen auf, die zum Teil „schießscheibenartig“ („targetoid“) sind. Dieses Merkmal gilt zwar normalerweise als charakteristisch für das lobuläre Karzinom, kann aber auch bei Duktuskarzinomen vorhanden sein.
60x
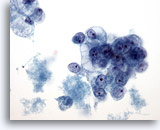
Abbildung 39
Feinnadelaspiration der Mamma, Duktuskarzinom, Grad II.
Erkennbar sind Verbände vakuolisierter maligner Zellen mit runden Zellkernen und prominenten Nukleolen. Zu beachten ist die Nekrose im Hintergrund.
40x
Abbildung 39
Feinnadelaspiration der Mamma, Duktuskarzinom, Grad II.
Erkennbar sind Verbände vakuolisierter maligner Zellen mit runden Zellkernen und prominenten Nukleolen. Zu beachten ist die Nekrose im Hintergrund.
40x
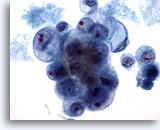
Abbildung 40
Feinnadelaspiration der Mamma, Duktuskarzinom, Grad II.
Von demselben Fall wie in Abbildung 39. Zellkerne und Nukleolen der Tumorzellen weisen deutliche Größenunterschiede auf. Nekrose. Dieses Aspirat wurde als mäßig differenziertes Duktuskarzinom befundet.
60x
Abbildung 40
Feinnadelaspiration der Mamma, Duktuskarzinom, Grad II.
Von demselben Fall wie in Abbildung 39. Zellkerne und Nukleolen der Tumorzellen weisen deutliche Größenunterschiede auf. Nekrose. Dieses Aspirat wurde als mäßig differenziertes Duktuskarzinom befundet.
60x
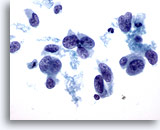
Abbildung 41
Feinnadelaspiration der Mamma, Duktuskarzinom, hochmaligne.
Dieser Bereich veranschaulicht die bei Duktuskarzinomen vorkommende Formenvielfalt (Polymorphie) der Zellkerne. Manche Zellkerne sind fast spindelförmig. Die meisten Zellkerne sind deutlich größer als die benachbarten Neutrophilen bzw. Lymphozyten. Das Chromatinmuster ist verklumpt und aufgelockert.
Abbildung 41
Feinnadelaspiration der Mamma, Duktuskarzinom, hochmaligne.
Dieser Bereich veranschaulicht die bei Duktuskarzinomen vorkommende Formenvielfalt (Polymorphie) der Zellkerne. Manche Zellkerne sind fast spindelförmig. Die meisten Zellkerne sind deutlich größer als die benachbarten Neutrophilen bzw. Lymphozyten. Das Chromatinmuster ist verklumpt und aufgelockert.
60x
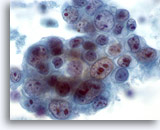
Abbildung 42
Feinnadelaspiration der Mamma, Duktuskarzinom, hochmaligne.
Dies ist ein weiteres Beispiel für die Pleomorphie bei Duktuskarzinomen. Dieser Tumorzellcluster enthält Zellkerne in verschiedenen Größen. Einige Zellen weisen mehrere Makronukleolen auf. Im Hintergrund ist Nekrose erkennbar.
60x
Abbildung 42
Feinnadelaspiration der Mamma, Duktuskarzinom, hochmaligne.
Dies ist ein weiteres Beispiel für die Pleomorphie bei Duktuskarzinomen. Dieser Tumorzellcluster enthält Zellkerne in verschiedenen Größen. Einige Zellen weisen mehrere Makronukleolen auf. Im Hintergrund ist Nekrose erkennbar.
60x
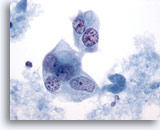
Abbildung 43
Feinnadelaspiration der Mamma, Duktuskarzinom, hochmaligne.
Die malignen Zellen in diesem Bereich sind mehrkernig mit blassen Zellkernen, die verklumptes und aufgelockertes Chromatin aufweisen.
60x
Abbildung 43
Feinnadelaspiration der Mamma, Duktuskarzinom, hochmaligne.
Die malignen Zellen in diesem Bereich sind mehrkernig mit blassen Zellkernen, die verklumptes und aufgelockertes Chromatin aufweisen.
60x
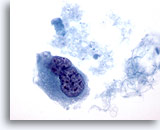
Abbildung 44
Feinnadelaspiration der Mamma, Duktuskarzinom, hochmaligne.
Von demselben Fall wie Abbildung 43, zeigt eine zweikernige Zelle mit hyperchromatischen Zellkernen und verklumptem, aufgelockertem Chromatin.
60x
Abbildung 44
Feinnadelaspiration der Mamma, Duktuskarzinom, hochmaligne.
Von demselben Fall wie Abbildung 43, zeigt eine zweikernige Zelle mit hyperchromatischen Zellkernen und verklumptem, aufgelockertem Chromatin.
60x
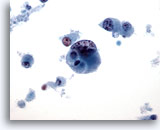
Abbildung 45
Feinnadelaspiration der Mamma, Duktuskarzinom, hochmaligne.
Dies ist ein Beispiel für ein hochmalignes, schlecht differenziertes Duktuskarzinom. In den vereinzelt liegenden Zellen sind atypisches Chromatin und Nukleoli zu sehen; im Hintergrund ist zelluläre Nekrose erkennbar.
40x
Abbildung 45
Feinnadelaspiration der Mamma, Duktuskarzinom, hochmaligne.
Dies ist ein Beispiel für ein hochmalignes, schlecht differenziertes Duktuskarzinom. In den vereinzelt liegenden Zellen sind atypisches Chromatin und Nukleoli zu sehen; im Hintergrund ist zelluläre Nekrose erkennbar.
40x
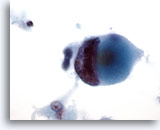
Abbildung 46
Feinnadelaspiration der Mamma, Duktuskarzinom, hochmaligne.
In dieser malignen Zelle vom selben Fall wie in Abbildung 45 sind die ausgeprägte Verklumpung und Auflockerung des Chromatins zu beachten.
60x
Abbildung 46
Feinnadelaspiration der Mamma, Duktuskarzinom, hochmaligne.
In dieser malignen Zelle vom selben Fall wie in Abbildung 45 sind die ausgeprägte Verklumpung und Auflockerung des Chromatins zu beachten.
60x
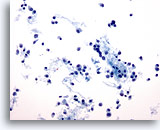
Abbildung 47
Feinnadelaspiration der Mamma, Lobuläres Karzinom.
Aspirate lobulärer Karzinome weisen zumeist nur wenige Zellen auf, können aber, wie in diesem Beispiel, gelegentlich auch zahlreiche Zellen enthalten. Die Tumorzellen treten einzeln auf, können aber kleinere Aggregate bilden, die häufig reihenartig angeordnet sind.
20x
Abbildung 47
Feinnadelaspiration der Mamma, Lobuläres Karzinom.
Aspirate lobulärer Karzinome weisen zumeist nur wenige Zellen auf, können aber, wie in diesem Beispiel, gelegentlich auch zahlreiche Zellen enthalten. Die Tumorzellen treten einzeln auf, können aber kleinere Aggregate bilden, die häufig reihenartig angeordnet sind.
20x
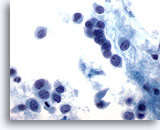
Abbildung 48
Feinnadelaspiration der Mamma, Lobuläres Karzinom.
Die neoplastischen Zellen sind gewöhnlich klein mit runden bis unregelmäßigen Kernmembranen und exzentrischer Kernlage, was ihnen, wie hier erkennbar, ein plasmazellenartiges Aussehen verleiht.
60x
Abbildung 48
Feinnadelaspiration der Mamma, Lobuläres Karzinom.
Die neoplastischen Zellen sind gewöhnlich klein mit runden bis unregelmäßigen Kernmembranen und exzentrischer Kernlage, was ihnen, wie hier erkennbar, ein plasmazellenartiges Aussehen verleiht.
60x
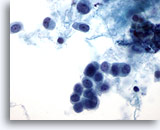
Abbildung 49
Feinnadelaspiration der Mamma, Lobuläres Karzinom.
Hier sind plasmacytoide Zellen mit runden Zellkernen zu sehen. Das Hintergrundmaterial scheint eher proteinös als nekrotisch zu sein. In der Mitte des Bereichs ist eine kurze, aus drei Zellen bestehende Reihe erkennbar.
60x
Abbildung 49
Feinnadelaspiration der Mamma, Lobuläres Karzinom.
Hier sind plasmacytoide Zellen mit runden Zellkernen zu sehen. Das Hintergrundmaterial scheint eher proteinös als nekrotisch zu sein. In der Mitte des Bereichs ist eine kurze, aus drei Zellen bestehende Reihe erkennbar.
60x
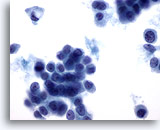
Abbildung 50
Feinnadelaspiration der Mamma, Lobuläres Karzinom.
Intrazytoplasmatische Vakuolen kommen, wie an der einzelnen Zelle in der oberen linken Bereich erkennbar, in Aspiraten von lobulären Karzinomen häufig vor. Vakuolen sind allerdings nicht auf lobuläre Karzinome beschränkt, sondern werden auch bei Duktuskarzinomen beobachtet.
60x
Abbildung 50
Feinnadelaspiration der Mamma, Lobuläres Karzinom.
Intrazytoplasmatische Vakuolen kommen, wie an der einzelnen Zelle in der oberen linken Bereich erkennbar, in Aspiraten von lobulären Karzinomen häufig vor. Vakuolen sind allerdings nicht auf lobuläre Karzinome beschränkt, sondern werden auch bei Duktuskarzinomen beobachtet.
60x
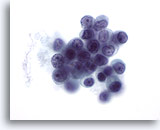
Abbildung 51
Feinnadelaspiration der Mamma, Lobuläres Karzinom.
Nukleolen sind zwar kein verbreitetes Merkmal lobulärer Karzinome (mit Ausnahme des pleomorphen lobulären Karzinoms), werden aber manchmal beobachtet.
60x
Abbildung 51
Feinnadelaspiration der Mamma, Lobuläres Karzinom.
Nukleolen sind zwar kein verbreitetes Merkmal lobulärer Karzinome (mit Ausnahme des pleomorphen lobulären Karzinoms), werden aber manchmal beobachtet.
60x
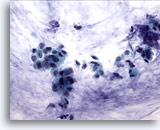
Abbildung 52
Feinnadelaspiration der Mamma, Kolloides (muzinöses) Karzinom.
Vor einem Hintergrund aus Schleim sind Verbände kleiner Zellen und einige Einzelzellen zu sehen. Da die Diagnose von der Schleimproduktion des Tumors insgesamt abhängt, sollten derartige Fälle nicht als kolloide oder muzinöse Karzinome, sondern als Duktuskarzinome mit muzinöser Differenzierung befundet werden.
40x
Abbildung 52
Feinnadelaspiration der Mamma, Kolloides (muzinöses) Karzinom.
Vor einem Hintergrund aus Schleim sind Verbände kleiner Zellen und einige Einzelzellen zu sehen. Da die Diagnose von der Schleimproduktion des Tumors insgesamt abhängt, sollten derartige Fälle nicht als kolloide oder muzinöse Karzinome, sondern als Duktuskarzinome mit muzinöser Differenzierung befundet werden.
40x
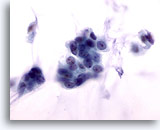
Abbildung 53
Feinnadelaspiration der Mamma, Kolloides Karzinom.
Bei den malignen Zellen in dieser Läsion handelt es sich um blande Zellen mit glatten Kernrändern und gleichmäßig verteiltem Chromatin, die keine sichtbaren Nukleoli aufweisen. Sofern Muzinder Schleim übersehen wird, könnten die Zellen fälschlich als benigne interpretiert werden.
60x
Abbildung 53
Feinnadelaspiration der Mamma, Kolloides Karzinom..
Bei den malignen Zellen in dieser Läsion handelt es sich um blande Zellen mit glatten Kernrändern und gleichmäßig verteiltem Chromatin, die keine sichtbaren Nukleoli aufweisen. Sofern Muzinder Schleim übersehen wird, könnten die Zellen fälschlich als benigne interpretiert werden.
60x
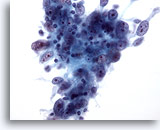
Abbildung 54
Feinnadelaspiration der Mamma, Medulläres Karzinom.
Wie hier erkennbar, findet man bei Feinnadelaspiraten dieser Tumore typischerweise Verbände großer, pleomorpher Tumorzellen mit prominenten Nukleolen und einer Beimengung von Lymphozyten. Es können auch Plasmazellen vorhanden sein.
40x
Abbildung 54
Feinnadelaspiration der Mamma, Medulläres Karzinom.
Wie hier erkennbar, findet man bei Feinnadelaspiraten dieser Tumore typischerweise Verbände großer, pleomorpher Tumorzellen mit prominenten Nukleolen und einer Beimengung von Lymphozyten. Es können auch Plasmazellen vorhanden sein.
40x
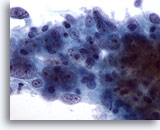
Abbildung 55
Feinnadelaspiration der Mamma, Medulläres Karzinom.
An diesem Zellcluster sind große zentrale Nukleolen und ein atypisches Chromatin zu erkennen. Ebenfalls zu sehen sind Lymphozyten.
60x
Abbildung 55
Feinnadelaspiration der Mamma, Medulläres Karzinom.
An diesem Zellcluster sind große zentrale Nukleolen und ein atypisches Chromatin zu erkennen. Ebenfalls zu sehen sind Lymphozyten.
60x
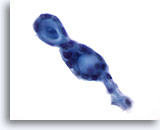
Abbildung 56
Feinnadelaspiration der Mamma, Adenoid-zystisches Karzinom.
Diese Tumoren enthalten gewöhnlich extrazelluläres Hyalin in Form von Kügelchen oder als zylinder- bzw. tubuläres Material, das von kleinen, blanden neoplastischen Zellen umgeben von ist. In diesem Bereich sind zwei benachbarte Kugelstrukturen erkennbar.
60x
Abbildung 56
Feinnadelaspiration der Mamma, Adenoid-zystisches Karzinom.
Diese Tumoren enthalten gewöhnlich extrazelluläres Hyalin in Form von Kügelchen oder als zylinder- bzw. tubuläres Material, das von kleinen, blanden neoplastischen Zellen umgeben von ist. In diesem Bereich sind zwei benachbarte Kugelstrukturen erkennbar.
60x
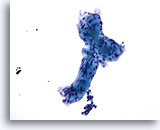
Abbildung 57
Feinnadelaspiration der Mamma, Adenoid-zystisches Karzinom.
Hier ist das extrazelluläre Hyalin anschaulich dargestellt, Es bildet eine angedeutete Tubulusform mit zwei damit verbundenen Kugelstrukturen.
20x
Abbildung 57
Feinnadelaspiration der Mamma, Adenoid-zystisches Karzinom.
Hier ist das extrazelluläre Hyalin anschaulich dargestellt, Es bildet eine angedeutete Tubulusform mit zwei damit verbundenen Kugelstrukturen.
20x

Abbildung 58
Feinnadelaspiration der Mamma, Adenoid-zystisches Karzinom.
In diesem Bereich ist eine von kleinen Tumorzellen überlagerte Ansammlung von Hyalinkügelchen zu erkennen. Die Differenzialdiagnose ist kollagene Sphärulose, eine benigne Läsion, bei der neben Hyalinkügelchen benigne oder hyperplastische Duktuszellen vorhanden sind.
60x
Abbildung 58
Feinnadelaspiration der Mamma, Adenoid-zystisches Karzinom.
In diesem Bereich ist eine von kleinen Tumorzellen überlagerte Ansammlung von Hyalinkügelchen zu erkennen. Die Differenzialdiagnose ist kollagene Sphärulose, eine benigne Läsion, bei der neben Hyalinkügelchen benigne oder hyperplastische Duktuszellen vorhanden sind.
60x
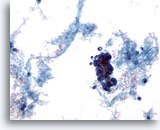
Abbildung 59
Feinnadelaspiration der Mamma, Maligne Zyste.
Nicht alle Zysten sind gutartig. Manche Duktuskarzinome können wie in diesem Beispiel als zystische Läsionen auftreten. Die Ansicht bei schwacher Vergrößerung zeigt proteinhaltiges Material, Blut und einen Verband hyperchromatischer Zellen.
20x
Abbildung 59
Feinnadelaspiration der Mamma, Maligne Zyste.
Nicht alle Zysten sind gutartig. Manche Duktuskarzinome können wie in diesem Beispiel als zystische Läsionen auftreten. Die Ansicht bei schwacher Vergrößerung zeigt proteinhaltiges Material, Blut und einen Verband hyperchromatischer Zellen.
20x
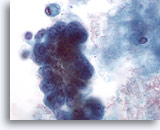
Abbildung 60
Feinnadelaspiration der Mamma, Maligne Zyste.
Bei stärkerer Vergrößerung weist der Verband aus Abbildung 59 Pleomorphie, sichtbare Kernkörperchen und Vakuolisierung auf. Die Exzisionsbiopsie ergab ein Duktuskarzinom.
60x
Abbildung 60
Feinnadelaspiration der Mamma, Maligne Zyste.
Bei stärkerer Vergrößerung weist der Verband aus Abbildung 59 Pleomorphie, sichtbare Kernkörperchen und Vakuolisierung auf. Die Exzisionsbiopsie ergab ein Duktuskarzinom.
60x
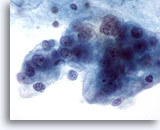
Abbildung 61
Feinnadelaspiration der Mamma, Maligne Zyste.
Ein weiteres Beispiel für ein Duktuskarzinom, das anhand eines Zystenaspirats diagnostiziert wurde. In diesem Bereich sind deutlich pleomorphe, vakuolisierte, maligne Zellen mit Nukleolen und atypischem Chromatin zu erkennen.
60x
Abbildung 61
Feinnadelaspiration der Mamma, Maligne Zyste.
Ein weiteres Beispiel für ein Duktuskarzinom, das anhand eines Zystenaspirats diagnostiziert wurde. In diesem Bereich sind deutlich pleomorphe, vakuolisierte, maligne Zellen mit Nukleolen und atypischem Chromatin zu erkennen.
60x
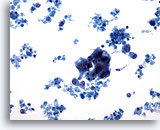
Abbildung 62
Feinnadelaspiration der Mamma, Maligne Zyste.
Dieser Bereich zeigt einen hyperchromatischen Verband epithelialer Zellen mit zahlreichen Zelltrümmern im Hintergrund, ein Hinweis auf ein Karzinom.
20x
Abbildung 62
Feinnadelaspiration der Mamma, Maligne Zyste.
Dieser Bereich zeigt einen hyperchromatischen Verband epithelialer Zellen mit zahlreichen Zelltrümmern im Hintergrund, ein Hinweis auf ein Karzinom.
20x
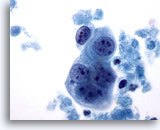
Abbildung 63
Feinnadelaspiration der Mamma, Maligne Zyste.
Es ist ein kleinekleiner Tumorzellverband mit prominenten Nukleolen und relativ glatten Zellkernrändern zu sehen. Zu beachten ist die Einbettung in nekrotisches Material.
60x
Abbildung 63
Feinnadelaspiration der Mamma, Maligne Zyste.
Es ist ein kleinekleiner Tumorzellverband mit prominenten Nukleolen und relativ glatten Zellkernrändern zu sehen. Zu beachten ist die Einbettung in nekrotisches Material.
60x
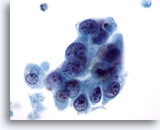
Abbildung 64
Feinnadelaspiration der Mamma, Maligne Zyste.
Derselbe Fall wie Abbildung 63. Die Zellen weisen Überlagerungen, allerdings auch Anzeichen von Separation sowie irreguläre Kernmembranen, atypisches Chromatin und sichtbare Nukleolen auf.
60x
Abbildung 64
Feinnadelaspiration der Mamma, Maligne Zyste.
Derselbe Fall wie Abbildung 63. Die Zellen weisen Überlagerungen, allerdings auch Anzeichen von Separation sowie irreguläre Kernmembranen, atypisches Chromatin und sichtbare Nukleolen auf.
60x
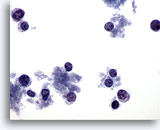
Abbildung 65
Feinnadelaspiration der Mamma, Lymphom.
In diesem Bereich sind dissoziieerte Zellen mit sehr wenig Zytoplasma zu sehen. Es sind keine Verbände vorhanden. Die Zellen weisen runde Zellkerne mit einem Zytoplasmarand an einer Seite auf. Die Merkmale sind eher lymphatisch als epithelial.
40x
Abbildung 65
Feinnadelaspiration der Mamma, Lymphom.
In diesem Bereich sind dissoziieerte Zellen mit sehr wenig Zytoplasma zu sehen. Es sind keine Verbände vorhanden. Die Zellen weisen runde Zellkerne mit einem Zytoplasmarand an einer Seite auf. Die Merkmale sind eher lymphatisch als epithelial.
40x
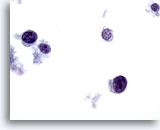
Abbildung 66
Feinnadelaspiration der Mamma, Lymphom.
Bei starker Vergrößerung ist erkennbar, dass es sich um lymphatische Zellen handelt, die ein charakteristisches Chromatinmuster aufweisen. Eine immunzytochemische LCA-Färbung (Leukocyte Common Antigen) auf einem ungefärbten ThinPrep-Objektträger würde die Diagnose bestätigen.
60x
Abbildung 66
Feinnadelaspiration der Mamma, Lymphom.
Bei starker Vergrößerung ist erkennbar, dass es sich um lymphatische Zellen handelt, die ein charakteristisches Chromatinmuster aufweisen. Eine immunzytochemische LCA-Färbung (Leukocyte Common Antigen) auf einem ungefärbten ThinPrep-Objektträger würde die Diagnose bestätigen.
60x


































































