Einführung
Latha Pisharodi, MD
Der Gastrointestinaltrakt (GI-Trakt) oder Verdauungstrakt wird unterteilt in Speiseröhre, Magen, Dünndarm und Dickdarm. Diese werden durch Schließmuskeln voneinander getrennt, die die Passage der Inhalte aus einem Teil des GI-Trakts in den nächsten steuern. Darüber hinaus unterscheiden sich jeder dieser Bereiche durch eine andere Art Mukosa, der auskleidenden Zellen. Der GI-Trakt ist das Verdauungssystem des Körpers, ein endokrines Organ und der Ort, an dem Immunität entsteht.
Probenentnahme
Zytologische Proben aus dem GI-Trakt werden durch Bürstenabstriche, Spülungen oder Feinnadelaspirationsbiopsien (FNAs) unter sonographischer Kontrolle gewonnen. In der Regel wird eine Bürstenabstrichprobe entnommen, indem man eine, von einer durchsichtigen Hülle umgebene, Bürste durch das Endoskop einschiebt und fünf- bis zehnmal in die Läsion eintaucht. Anschließend wird die Bürste wieder entnommen und das Zellmaterial auf einen Glas-Objektträger ausgestrichen oder in einem Konservierungsmittel ausgelöst.
Bei der endoskopischen FNA wird die Nadel durch ein Fiberendoskop eingeführt. Sobald die Läsion lokalisiert ist, gibt man einen negativen Druck auf die Nadel und bewegt diese in der Läsion vor- und zurück. Nach Ablassen des Unterdrucks kann die Nadel herausgezogen und die Probe in eine Konservierungslösung überführt werden.
Die Proben können beispielsweise in CytoLyt® Lösung gesammelt und mit dem ThinPrep® 2000 Gerät verarbeitet werden; es ist aber auch möglich, sie in andere Konservierungslösungen einzubringen und als Cytospins oder herkömmliche Ausstriche zu verarbeiten.
Speiseröhre
Die Speiseröhre wird normalerweise von einem nicht verhornendem Plattenepithel ausgekleidet. Selten können auch Metaplasiezellen beobachtet werden, die aus den Drüsen der Submukosa stammen werden auch aus den submukosalen Drüsen stammende metaplastische Zellen beobachtet. Zylindrische Drüsenzellen können aus dem Magen oder einem Barrett-Ösophagus stammen.
Eine unspezifische Ösophagitis geht in der Regel mit einer akuten bzw. chronischen Entzündung mit reaktiven Veränderungen einher. Eine Herpes-Ösophagitis zeigt klassische zytopathische Effekte wie Mehrkernigkeit, eosinophile Viruseinschlüsse und Milchglaschromatin der Zellkerne. Bei einer Candida-Ösophagitis sind Pilzsporen und septierte Pseudohyphen nachweisbar. In seltenen Fällen werden andere Organismen wie z.B. Aspergillus beobachtet.
Zytologische Untersuchungen des Ösophagus sind ein wichtiges Verfahren für die Diagnostik von Ösophaguskarzinomen, insbesondere in Ländern mit einer hohen Inzidenz von Speiseröhrenkrebs wie China und Japan, wo diese sogar als ein Massenscreenings-Programm durchgeführt werden. Verschiedene Autoren haben aufgezeigt, dass eine Kombination aus Zytologie und Biopsie das bevorzugte Verfahren für die Diagnostik von Neoplasien des oberen GI-Trakts ist 1, 2.Bei einer glandulären Dysplasie, die sich aus einem Barrett-Ösophagus entwickelt hat, sind typischerweise verstreute atypische Zellen nachweisbar, die einige, aber nicht alle Merkmale eines Adenokarzinoms aufweisen. Gut differenzierte Plattenepithelkarzinome sind durch atypische squamöse Zellen in bizarren Formen, Hyperchromasie und Pleomorphismus charakterisiert. Bei wenig differenzierten Plattenepithelkarzinomen sind in der Regel ausgeprägt pleomorphe Zellen mit hoher Kern-Plasma-Relation, Kernkörperchen Nukleoli und dichtes Zytoplasma vorhanden. Typisch für Adenokarzinome sind Gruppen und dreidimensionale Verbände neoplastischer Epithelzellen.
Magen
Der Magen ist mit einem zylindrischen Drüsenepithel ausgekleidet, das mann, normalerweise in Verbänden mit Bienenwabenstruktur vorfindet. Gelegentlich sind Schleimvakuolen zu beobachten. Parietal- und Hauptzellen werden in Bürstenabstrichen des Magens selten gefunden. Parietalzellen weisen mit der Papanicolaou-Färbung ein azidophiles Zytoplasma auf. Hauptzellen lassen sich am besten durch die Romanowsky-Färbung nachweisen 3. Bei Helicobacter pylori handelt es sich um gram-negative, mit den Färbeverfahren nach Papanicolaou, Romanowsky, Warthin-Starry und H & E einfach nachzuweisende spiralige Bakterien. Peptische Ulzera und Gastritis sind durch unspezifisch reaktive und reparative Veränderungen, Entzündungszellen, mitotische Aktivität und prominente Nukleolen charakterisiert. Bei den Adenokarzinomen des Magens sind maligne Epithelzellen mit ausgeprägten Atypien nachweisbar. Es können Siegelringzellen vorhanden sein. Sollten maligne Plattenepithelzellen gefunden werden, so können diese entweder, auf ein adenosquamöses Karzinom, das seltene reine Plattenepithelkarzinom des Magens, oder auf eine Ausdehnung eines Plattenepithelkarzinoms der Speiseröhre in den Magen hindeuten. Andere Tumoren wie Karzinoide oder Stromatumoren werden durch eine Bürstenzytologie des Magens nur selten diagnostiziert. Jedoch ist bei Anwendung der endoskopischen FNA die diagnostische Sensitivität der Zytologie dieser Tumoren eindeutig höher als beim Bürstenabstrich.
Gallengang
Bürstenabstriche des Gallengangs werden in der Regel durch eine endoskopische retrograde Cholangiopankreatographie (ERCP) gewonnen. Eine Probenentnahme aus Gallenstents ist ebenfalls möglich. Die Hauptindikation für eine Gallengangs-zytologische Untersuchung der Galle ist ein Verdacht auf Malignität bei Patienten mit Gallengangsstriktur. Bei Infektionskrankheiten und primär sklerosierender Cholangitis (PSC) findet man häufig reaktive und reparative Zell-Veränderungen. Im Gallentrakt kann auch eine Dysplasie gefunden werden. Die Zytologischen Merkmale sind Kerndrängeln (Crowding) und Kernüberlappung, erhöhte Kern-Plasma-Relation und eine atypische Chromatinstruktur. Diese Atypien sind jedoch weniger ausgeprägt als beim Adenokarzinom. Adenokarzinome im Gallentrakt (Cholangiokarzinome) ähneln zytologisch denjenigen im GI-Trakt. Die schleimreiche Variante kann aufgrund ihrer wenig ausgeprägten zytologischen Merkmale besonders schwierig zu diagnostizieren sein. Diese Zellen enthalten sehr große Mengen an Schleim und können mit Histiozyten verwechselt werden.
Kolon
Zellen können durch endoskopische Bürstenabstriche, Spülung oder FNA gewonnen werden. Normale Kolonschleimhaut zeigt hochprismatische, in einschichtigen Verbänden angeordnete bzw. einzeln liegende Zylinderzellen. Gelegentlich sind Becherzellen zu beobachten. Einige Autoren haben zytologische Befunde von Adenomen beschrieben, wonach tubuläre Adenome flachere und stärker abstumpfte Zellen aufweisen, villöse Adenome dagegen gestreckte und spindelförmige Zellen 4. Adenokarzinome des Kolons zeigen kohärente, höchst atypische Drüsenzellverbände mit markanten Kernkörperchen und einem nekrotischen Hintergrund. Bei Kolon-Bürstenabstrichen zur Diagnostik von Kolonkarzinomen liegt die Empfindlichkeit Besser: Sensitivität zwischen 70 % und 85 %5. Die größte Genauigkeit wurde allerdings mit einer Kombination aus Zytologie und Biopsie erzielt 6.
Bürstenabstriche des Anus
Ebenso wie die Transformationszone der Zervix ist auch der Plattenepithel-Zylinderepithel-Übergang des Analkanals anfällig für Neoplasien7. Das zytologische Erscheinungsbild der beiden Präparatetypen ist sehr ähnlich. Befunde können entsprechend den im Bethesda-System definierten Kriterien klassifiziert werden 8.
Zytologisches Material zur Auswertung kann einfach durch direkte Abstrichentnahme des Bereichs und Ausstreichen auf einen Glas-Objektträger bzw. durch Auswaschen in einer Konservierungsflüssigkeit gewonnen werden. Darüber hinaus werden Papanicolaou-Abstriche des Analbereichs mehr und mehr für Screenings zur Untersuchung dysplastischer Veränderungen eingesetzt, insbesondere in HIV-positiven Populationen 9. Plattenepithelkarzinome im Analbereich weisen charakteristische neoplastische Plattenepithelzellen in unterschiedlichen Differenzierungsgraden auf.
Quellenangaben
- C P Shroff, S A Nanivadekar: Endoscopic brushing cytology and biopsy in the diagnosis of upper gastrointestinal tract lesions. A study of 350 cases. Acta Cytol 1988: 32 (4}: 455-60.
- O Donoghue, P G Horgan, M K Donohoe et al: Adjunctive endoscopic brush cytology in the detection of upper gastrointestinal malignancy. Acta Cytol 1995: 39(1}: 28-33.
- M Drake: Gastric cytology: normal and abnormal. In Gastroesophageal Cytology. Basel: Karger, 1985, page 120.
- V Kannan, CB Masters: Cytodiagnosis of colonic adenoma: morphology and clinical importance. Diag Cytopathol 1991 7(4}: 13-16
- RG Bardawil, FG Ambrosio, SI Hajdu: Colonic cytology. A retrospective study with histologic correlation. Acta Cytol 1990; 34 (5}: 10-12
- M Halpern, R Gal, L Rath-Wolfson, R Koren et al. Brush cytology and biopsy in the diagnosis of colorectal cancer. A comparison. Acta Cytol 1997; 41 (3}: 628-32.
- Goldstone et al. High Prevalence of Anal Squamous Intraepithelial Lesions and Squamous Cell Carcinoma in Men Who Have Sex with Men as Seen in a Surgical Practice. Dis Colon Rectum 2001;44:690-698.
- Darragh et al. Comparison of Conventional Cytologic Smears and ThinPrep Preparations from the Anal Canal. Acta Cytol 1997;41:1167-70.
- MA Friedlander, E Stier, O Lin. Anorectal cytology as a screening tool for anal squamous lesions: cytologic, anoscopic, and histologic correlation. Cancer 2004: 102(1}:19-26.
Zytologie der Speiseröhre

Erinnerung: Sie können auf jedes Bild klicken, um dieses vergrößert zu betrachten.
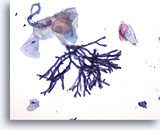
Abbildung 1
Bürstenabstrich der Speiseröhre – Aspergillus
Bürstenbiopsie des Ösophagus, die die Aspergillus-Spezies mit septierte und im Winkel von 45 Grad verzweigten Hyphen aufweist. In seltenen Fällen wird eine assoziierte Atypie der Plattenepithelzellen beobachtet.
20x
Abbildung 1
Bürstenabstrich der Speiseröhre – Aspergillus
Bürstenbiopsie des Ösophagus, die die Aspergillus-Spezies mit septierte und im Winkel von 45 Grad verzweigten Hyphen aufweist. In seltenen Fällen wird eine assoziierte Atypie der Plattenepithelzellen beobachtet.
20x
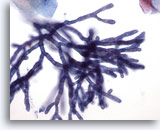
Abbildung 2
Bürstenabstrich der Speiseröhre – Aspergillus
Septierung und Verzweigung im Winkel von 45 Grad sind bei stärkerer Vergrößerung gut zu sehen.
40x
Abbildung 2
Bürstenabstrich der Speiseröhre – Aspergillus
Septierung und Verzweigung im Winkel von 45 Grad sind bei stärkerer Vergrößerung gut zu sehen.
40x
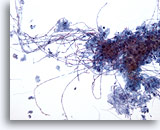
Abbildung 3
Bürstenabstrich der Speiseröhre – Candida
Die Candida-Ösophagitis ist durch den Nachweis länglicher Pseudohyphen- und eiförmiger Hefearten charakterisiert.
20x
Abbildung 3
Bürstenabstrich der Speiseröhre – Candida
Die Candida-Ösophagitis ist durch den Nachweis länglicher Pseudohyphen- und eiförmiger Hefearten charakterisiert.
20x
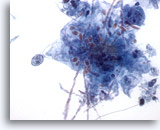
Abbildung 4
Bürstenabstrich der Speiseröhre – Candida
Knospenbildende Formen der Hefe sind leicht erkennbar.
60x
Abbildung 4
Bürstenabstrich der Speiseröhre – Candida
Knospenbildende Formen der Hefe sind leicht erkennbar.
60x
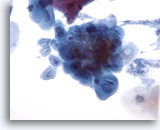
Abbildung 5
Bürstenabstrich der Speiseröhre – Herpes
Eine Herpesinfektion wird durch klassische zytologische Merkmale wie Mehrkernigkeit, gegenseitiges Eindellen der Kerne (Molding) und milchglasartiges Chromatin nachgewiesen.
40x
Abbildung 5
Bürstenabstrich der Speiseröhre – Herpes
Eine Herpesinfektion wird durch klassische zytologische Merkmale wie Mehrkernigkeit, gegenseitiges Eindellen der Kerne (Molding) und milchglasartiges Chromatin nachgewiesen.
40x

Abbildung 6
Bürstenabstrich der Speiseröhre – Herpes
Bei Herpesinfektionen können eosinophile Kerneinschlüsse beobachtet werden.
40x
Abbildung 6
Bürstenabstrich der Speiseröhre – Herpes
Bei Herpesinfektionen können eosinophile Kerneinschlüsse beobachtet werden.
40x
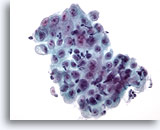
Abbildung 7
Bürstenabstrich der Speiseröhre – Ulkus
Von Entzündungszellen überlagerter Epithelzellenverband mit reaktiven Veränderungen.
40x
Abbildung 7
Bürstenabstrich der Speiseröhre – Ulkus
Von Entzündungszellen überlagerter Epithelzellenverband mit reaktiven Veränderungen.
40x
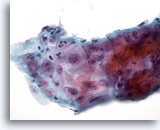
Abbildung 8
Bürstenabstrich der Speiseröhre – Ulkus
Atypisches Reparationsepithel bei Ösophagusulkus mit entzündlichem Infiltrat, reaktiver Atypie mit prominenten Nukleoli, markanten Kernkörperchen, glatten Kernmembranen und feinkörnigem Chromatin.
60x
Abbildung 8
Bürstenabstrich der Speiseröhre – Ulkus
Atypisches Reparationsepithel bei Ösophagusulkus mit entzündlichem Infiltrat, reaktiver Atypie mit prominenten Nukleoli, markanten Kernkörperchen, glatten Kernmembranen und feinkörnigem Chromatin.
60x
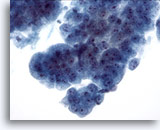
Abbildung 9
Bürstenabstrich der Speiseröhre, Barrett-Oesophagus: Schwere Dysplasie.
Kohäsive Verbände atypischer Drüsenzellen, die einige, jedoch nicht alle der Adenokarzinom-Merkmale zeigen.
40x
Abbildung 9
Bürstenabstrich der Speiseröhre, Barrett-Oesophagus: Schwere Dysplasie.
Kohäsive Verbände atypischer Drüsenzellen, die einige, jedoch nicht alle der Adenokarzinom-Merkmale zeigen.
40x
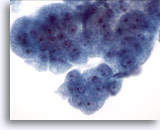
Abbildung 10
Bürstenabstrich der Speiseröhre, Barrett-Oesophagus: Schwere Dysplasie.
Gruppe zusammenhängender Kohäsive Zellverbände mit unterschiedlich großen Zellkernen, hoher Kern-Plasma-Relation, Kerndrängeln und –überlappungen. Zytologische Merkmale sind für die definitive Diagnose eines Adenokarzinoms nicht ausreichend.
60x
Abbildung 10
Bürstenabstrich der Speiseröhre, Barrett-Oesophagus: Schwere Dysplasie.
Gruppe zusammenhängender Kohäsive Zellverbände mit unterschiedlich großen Zellkernen, hoher Kern-Plasma-Relation, Kerndrängeln und –überlappungen. Zytologische Merkmale sind für die definitive Diagnose eines Adenokarzinoms nicht ausreichend.
60x
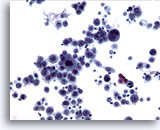
Abbildung 11
Bürstenabstrich der Speiseröhre, Plattenepithelkarzinom.
Höchst atypische Epithelzellen bestätigen die Diagnose eines gering differenzierten Karzinoms.
20x
Abbildung 11
Bürstenabstrich der Speiseröhre, Plattenepithelkarzinom..
Höchst atypische Epithelzellen bestätigen die Diagnose eines gering differenzierten Karzinoms.
20x
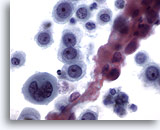
Abbildung 12
Bürstenabstrich der Speiseröhre, gering differenziertes Plattenepithelkarzinom.
Atypische Epithelzellen mit atypischem Chromatin. Keine eindeutige Plattenepithel-Differenzierung.
60x
Abbildung 12
Bürstenabstrich der Speiseröhre, gering differenziertes Plattenepithelkarzinom.
Atypische Epithelzellen mit atypischem Chromatin. Keine eindeutige Plattenepithel-Differenzierung.
60x
Zytologie des Magens
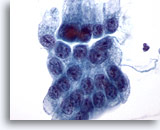
Abbildung 13
Bürstenabstrich des Magens, Magendysplasie.
Flacher Verband atypischer Magenepithelzellen mit vergrößerten Zellkernen, Zelldrängeln und zentraler Zellüberlagerung.
60x
Abbildung 13
Bürstenabstrich des Magens, Magendysplasie.
Flacher Verband atypischer Magenepithelzellen mit vergrößerten Zellkernen, Zelldrängeln und zentraler Zellüberlagerung.
60x
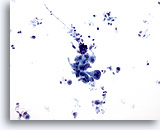
Abbildung 14
Bürstenabstrich des Magens, Adenokarzinom des Magens.
Zusammenhängende Gruppe atypischer Zellen. Zu beachten ist der schmutzige Hintergrund.
20x
Abbildung 14
Bürstenabstrich des Magens, Adenokarzinom des Magens.
Zusammenhängende Gruppe atypischer Zellen. Zu beachten ist der schmutzige Hintergrund.
20x
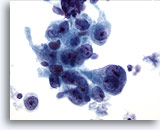
Abbildung 15
Bürstenabstrich des Magens, Adenokarzinom des Magens.
Pleomorphe neoplastische Epithelzellen mit prominenten Nukleolen Kernkörperchen.
60x
Abbildung 15
Bürstenabstrich des Magens, Adenokarzinom des Magens.
Pleomorphe neoplastische Epithelzellen mit prominenten Nukleolen Kernkörperchen.
60x
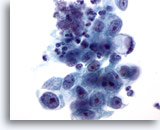
Abbildung 16
Bürstenabstrich des Magens, Adenokarzinom des Magens.
Adenokarzinom mit einer Siegelringzelle an einem Ende. Siegelringzellen sind durch riesige Schleimvakuolen charakterisiert, die den Zellkern halbmondförmig gegen die Kernmembran pressen.
60x
Abbildung 16
Bürstenabstrich des Magens, Adenokarzinom des Magens.
Adenokarzinom mit einer Siegelringzelle an einem Ende. Siegelringzellen sind durch riesige Schleimvakuolen charakterisiert, die den Zellkern halbmondförmig gegen die Kernmembran pressen.
60x
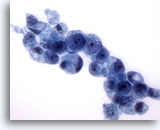
Abbildung 17
Bürstenabstrich des Magens, Adenokarzinom des Magens.
Weitere Siegelringzellen mit der typischen Morphologie.
60x
Abbildung 17
Bürstenabstrich des Magens, Adenokarzinom des Magens.
Weitere Siegelringzellen mit der typischen Morphologie.
60x
Zytologie des Kolons
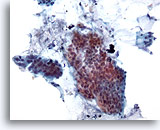
Abbildung 18
Bürstenabstrich des Kolons, Adenokarzinom des Kolons.
Der Bürstenabstrich des Kolons zeigt schon bei schwacher Vergrößerung atypische Epithelzellen.
20x
Abbildung 18
Bürstenabstrich des Kolons, Adenokarzinom des Kolons.
Der Bürstenabstrich des Kolons zeigt schon bei schwacher Vergrößerung atypische Epithelzellen.
20x
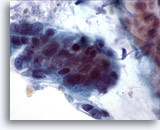
Abbildung 19
Bürstenabstrich des Kolons, Adenokarzinom des Kolons.
Bei starker Vergrößerung sind Pleomorphie, Zelldrängeln und Zellüberlagerung zu erkennen.
60x
Abbildung 19
Bürstenabstrich des Kolons, Adenokarzinom des Kolons.
Bei starker Vergrößerung sind Pleomorphie, Zelldrängeln und Zellüberlagerung zu erkennen.
60x
Pankreaskarzinom
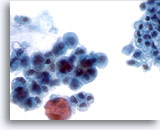
Abbildung 20
Bürstenabstrich des Pankreasgangs, Adenokarzinom der Bauchspeicheldrüse.
Der Bürstenabstrich des Pankreas weist zytologische Merkmale eines Adenokarzinoms des Pankreas auf. Vergleichen Sie mit dem angrenzendem, nicht neoplastischen Epithel.
40x
Abbildung 20
Bürstenabstrich des Pankreasgangs, Adenokarzinom der Bauchspeicheldrüse.
Der Bürstenabstrich des Pankreas weist zytologische Merkmale eines Adenokarzinoms des Pankreas auf. Vergleichen Sie mit dem angrenzendem, nicht neoplastischen Epithel.
40x
Zytologie des Gallengangs
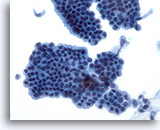
Abbildung 21
Bürstenabstrich des Gallengangs, reguläres Gallengangsepithel.
Bienenwabenstruktur des Epithelzell verbandes ohne Atypie.
40x
Abbildung 21
Bürstenabstrich des Gallengangs, reguläres Gallengangsepithel.
Bienenwabenstruktur des Epithelzell verbandes ohne Atypie.
40x

Abbildung 22
Bürstenabstrich des Gallengangs, Cholangiokarzinom.
An normales Gallengangsepithel angrenzende maligne Epithelzellen.
20x
Abbildung 22
Bürstenabstrich des Gallengangs, Cholangiokarzinom.
An normales Gallengangsepithel angrenzende maligne Epithelzellen.
20x
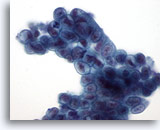
Abbildung 23
Bürstenabstrich des Gallengangs, hoch differenziertes, schleimbildendes Adenokarzinom.
Synzytialer Verband eines schleimbildenden Epithels mit Zellkernhyperchromasie und unregelmäßigen Kernmembranen.
60x
Abbildung 23
Bürstenabstrich des Gallengangs, hoch differenziertes, schleimbildendes Adenokarzinom.
Synzytialer Verband eines schleimbildenden Epithels mit Zellkernhyperchromasie und unregelmäßigen Kernmembranen.
60x
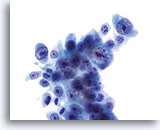
Abbildung 24
Bürstenabstrich des Gallengangs, Cholangiokarzinom.
Schlecht differenziertes Adenokarzinom mit ausgeprägten Kernatypien und (markanten Kernkörperchen) prominenten Nukleolen.
60x
Abbildung 24
Bürstenabstrich des Gallengangs, Cholangiokarzinom.
Schlecht differenziertes Adenokarzinom mit ausgeprägten Kernatypien und (markanten Kernkörperchen) prominenten Nukleolen.
60x
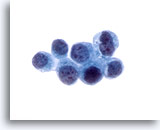
Abbildung 25
Bürstenabstrich des Gallengangs, Metastasierendes Mamma-Karzinom.
Zellen eines metastatischen Adenokarzinoms der Brust. Diagnose wurde durch immunhistochemische Färbung eines Zellblockpräparats bestätigt.
60x
Abbildung 25
Bürstenabstrich des Gallengangs, Metastasierendes Mamma-Karzinom.
Zellen eines metastatischen Adenokarzinoms der Brust. Diagnose wurde durch immunhistochemische Färbung eines Zellblockpräparats bestätigt.
60x
Zytologie des Analbereichs
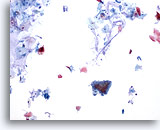
Abbildung 26
Bürstenabstrich des Anus, reguläres Drüsenepithel.
Bürstenabstriche des Analbereichs enthalten normalerweise Schleim im Hintergrund sowie normales Drüsen- und Plattenepithel. Typisch ist eine ausgeprägte Hyperkeratose.
10x
Abbildung 26
Bürstenabstrich des Anus, reguläres Drüsenepithel.
Bürstenabstriche des Analbereichs enthalten normalerweise Schleim im Hintergrund sowie normales Drüsen- und Plattenepithel. Typisch ist eine ausgeprägte Hyperkeratose.
10x
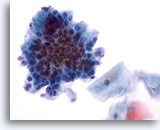
Abbildung 27
Bürstenabstrich des Anus, reguläres Drüsenepithel.
Bei stärkerer Vergrößerung wird die Pflasterstein- und “Palisadenzaun“-Morphologie offensichtlich.
40x
Abbildung 27
Bürstenabstrich des Anus, reguläres Drüsenepithel.
Bei stärkerer Vergrößerung wird die Pflasterstein- und “Palisadenzaun“-Morphologie offensichtlich.
40x

Abbildung 28
Bürstenabstrich des Anus, Abnorme Plattenepithelzellen (Atypical squamous cells, ASC).
In die Kategorie ASC fallen Veränderungen, die zwar auf HPV hinweisen, für die Diagnose LSIL aber nicht ausreichen.
40x
Abbildung 28
Bürstenabstrich des Anus, Abnorme Plattenepithelzellen (Atypical squamous cells, ASC).
In die Kategorie ASC fallen Veränderungen, die zwar auf HPV hinweisen, für die Diagnose LSIL aber nicht ausreichen.
40x
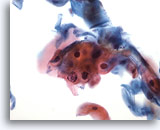
Abbildung 29
Bürstenabstrich des Anus, Abnorme Plattenepithelzellen (Atypical squamous cells, ASC).
Zur Kategorie ASC gehört die atypische Parakeratose (PK), die eine Diagnose einer LSIL nicht bestätigt.
40x
Abbildung 29
Bürstenabstrich des Anus, Abnorme Plattenepithelzellen (Atypical squamous cells, ASC).
Zur Kategorie ASC gehört die atypische Parakeratose (PK), die eine Diagnose einer LSIL nicht bestätigt.
40x
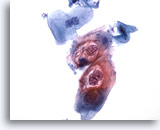
Abbildung 30
Bürstenabstrich des Anus, Intraepitheliale Läsion des Anus, geringgradig
Diese Zellen weisen die mit HPV-Infektionen assoziierte Zweikernigkeit und Höhlenbildung im Zytoplasma auf und bestätigen die Diagnose einer geringgradig intraepithelialen Läsion.
40x
Abbildung 30
Bürstenabstrich des Anus, Intraepitheliale Läsion des Anus, geringgradig
Diese Zellen weisen die mit HPV-Infektionen assoziierte Zweikernigkeit und Höhlenbildung im Zytoplasma auf und bestätigen die Diagnose einer geringgradig intraepithelialen Läsion.
40x

Abbildung 31
Bürstenabstrich des Anus, Intraepitheliale Läsion des Anus, geringgradig
Geringgradige anale intraepitheliale Läsionen können durch metaplastische Plattenepithelzellen mit vergrößerten Zellkernen charakterisiert sein.
40x
Abbildung 31
Bürstenabstrich des Anus, Intraepitheliale Läsion des Anus, geringgradig
Geringgradige anale intraepitheliale Läsionen können durch metaplastische Plattenepithelzellen mit vergrößerten Zellkernen charakterisiert sein.
40x
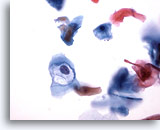
Abbildung 32
Bürstenabstrich des Anus, Intraepitheliale Läsion des Anus, geringgradig
Durch HPV hervorgerufene Höhlenbildung bestätigt die Diagnose geringgradiger analer intraepithelialer Läsionen.
40x
Abbildung 32
Bürstenabstrich des Anus, Intraepitheliale Läsion des Anus, geringgradig
Durch HPV hervorgerufene Höhlenbildung bestätigt die Diagnose geringgradiger analer intraepithelialer Läsionen.
40x
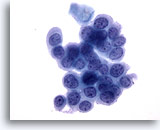
Abbildung 33
Bürstenabstrich des Anus, Intraepitheliale Läsion des Anus, höhergradig
Runde Zellen mit hoher Kern-Plasma-Relation und gleichmäßig verteiltes Chromatin sind die zytologischen Merkmale, die eine Diagnose einer hochgradigen analen intraepithelialen Läsion bestätigen.
40x
Abbildung 33
Bürstenabstrich des Anus, Intraepitheliale Läsion des Anus, höhergradig
Runde Zellen mit hoher Kern-Plasma-Relation und gleichmäßig verteiltes Chromatin sind die zytologischen Merkmale, die eine Diagnose einer hochgradigen analen intraepithelialen Läsion bestätigen.
40x
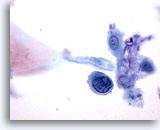
Abbildung 34
Bürstenabstrich des Anus, Intraepitheliale Läsion des Anus, höhergradig
Einzelne Zellen mit hoher Kern-Plasma-Relation und hyperchromatische Zellkerne bestätigen die Diagnose von hochgradigen analen intraepithelialen Läsionen.
60x
Abbildung 34
Bürstenabstrich des Anus, Intraepitheliale Läsion des Anus, höhergradig
Einzelne Zellen mit hoher Kern-Plasma-Relation und hyperchromatische Zellkerne bestätigen die Diagnose von hochgradigen analen intraepithelialen Läsionen.
60x
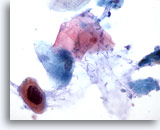
Abbildung 35
Bürstenabstrich des Anus, Intraepitheliale Läsion des Anus, höhergradig
Bei hochgradigen analen intraepithelialen Läsionen werden manchmal atypische keratinisierte Zellen mit vergrößerten hyperchromatischen Zellkernen beobachtet.
60x
Abbildung 35
Bürstenabstrich des Anus, Intraepitheliale Läsion des Anus, höhergradig
Bei hochgradigen analen intraepithelialen Läsionen werden manchmal atypische keratinisierte Zellen mit vergrößerten hyperchromatischen Zellkernen beobachtet.
60x
Zurück nach oben
Rückkehr zu den Inhaltsverzeichnis



































