Cytologia degli aspirati con ago sottile
Introduzione
David B. Kaminsky, medico, Accademia internazionale di citologia (FIAC)

La nascita della citopatologia è riconducibile alla messa a punto dello screening del cancro della cervice da parte del dott. George Papanicolaou. L’introduzione poi della biopsia per aspirazione con ago sottile e della citologia su base liquida è stata una vera e propria rivoluzione. La combinazione dei due esami rappresenta un efficace strumento diagnostico in grado di semplificare gli studi molecolari e ancillari nel campo delle malattie oncologiche e infettive. Entrambe sono ritenute procedure standard e all’avanguardia. Insieme rappresentano il maggior fondamento della citopatologia moderna, sono divenuti esami indispensabili.
La biopsia per aspirazione con ago sottile (FNAB) nasce a Stoccolma, al Karolinska Institute-Radiumhemmet, grazie al lavoro di pionieri come Franzen, Zajicek ed Esposti, i cui indispensabili studi, avvalorati dai dati bioptici, hanno consentito di confermare che i criteri per la diagnosi cellulare corrispondevano ai pattern dei tessuti e che la sonda ad ago era un pratico strumento diagnostico in grado di fornire informazioni tessuto-equivalenti attraverso un metodo poco invasivo.
Negli anni ’30 la comunità medica americana respinse scetticamente il tentativo di Martin di introdurre la FNAB, come c nuova tecnologia competitiva nei confronti delle sezioni congelate e della citologia esfoliativa. La provocatoria proposta venne accettata in alcuni centri medici universitari, dove i patologi impararono a interpretare i pattern cellulari ed i clinici superarono ogni ambivalenza e scetticismo.
Grazie all’influenza di appassionati patologi come Koss e Frable, la biopsia per aspirazione iniziò a diffondersi e la Società Americana di Citopatologia introdusse corsi al riguardo durante i congressi scientifici annuali. Il dott. Frable ed io abbiamo partecipato a seminari pratici con l’intenzione di insegnare a utilizzare la tecnica dell’aspirazione, i relativi criteri e la correlazione con i pattern istologici, rassicurando i nostri colleghi circa la precisione, l’efficacia e la sicurezza di questo tipo di procedura. La FNAB ha conquistato altri patologi ed è infine divenuta una procedura accettata inserita nei programmi di internato, nei corsi di studio e, da ultimo, nella pratica comune . Il più grande successo è però stato raggiunto grazie alla collaborazione con gli esperti di radiologia interventistica , che con l’utilizzo della tomografia computerizzata, l’ecografia e la radiografia ha permesso l’accesso visivamente controllato a lesioni viscerali profonde con rischi accettabili e ottimi risultati. Una società informata con il pesante fardello della sfida ai tumori e la crescente pressione finanziaria per garantire cure adeguate era alla ricerca di una tecnica accurata, economicamente conveniente e poco invasiva adatta a trattamenti ambulatoriali ed era pronta ad accogliere il parere degli esperti e la vantaggiosa applicazione di questo tipo di terapia. La tecnica era la perfetta risposta ai tentativi di migliorare la qualità terapeutica perché costituiva uno sforzo basato sui dati e orientato al risultato. L’introduzione della citologia su base liquida aggiungeva una nuova dimensione: l’ago poteva essere risciacquato nel fluido di raccolta per fornire una riserva di cellule che garantivano l’integrità e la conservazione del campione e consentivano lo svolgimento di una più approfondita analisi citologica e di tecniche complementari.

La biopsia per aspirazione con ago sottile è stata riconosciuta come la protagonista assoluta nella cura dei pazienti e riveste un ruolo mediatore tra figure professionali quali citopatologi, medici, esperti di radiologia interventistica , pazienti e terzi paganti. Rappresenta il collegamento tra citoarchitettura, anatomia dei tessuti, immunocitochimica, citometria di flusso, colture cellulari, diagnostica molecolare, terapia mirata e correlazione clinica. È vantaggiosa dal punto di vista economico, presenta basso rischio e si prefigge risultati raggiungibili. È una soluzione che ha carattere, personalità, autonomia.
Indicazioni
La presenza di una massa palpabile sulla superficie del corpo o un’inspiegabile lesione rilevata grazie a una radiografia rappresentano indicazioni per l’esecuzione di una biopsia per aspirazione con ago sottile per mezzo di visualizzazione diretta o guidata da immagini. Più in particolare, questa tecnica viene utilizzata per:
- Garantire l’impiego di una modalità diagnostica affidabile, vantaggiosa ed economicamente conveniente
- Distinguere una patologia benigna da una maligna con un intervento poco invasivo
- Invalidare un parere medico di non resezione
- Confermare la presenza di metastasi
- Ottenere informazioni tessuto-equivalenti per pazienti con restrizioni mediche
- Discriminare in base alla composizione cellulare: prescrizione di radioterapia, chemioterapia, immunoterapia, chirurgia o sorveglianza
- Acquisire materiale per coltura, analisi al microscopio elettronico, citometria a flusso, immunocitochimica, analisi di immagini del DNA e sonde di DNA
Controindicazioni
Ci sono poche controindicazioni all’utilizzo della biopsia per aspirazione con ago sottile nella pratica clinica e tra queste ricordiamo la diatesi emorragica, la terapia anticoagulante, le malformazioni aterovenose e le cisti idatidee. Se viene eseguita un’aspirazione dal torace, altre controindicazioni potrebbero essere: l’ipertensione polmonare, la tosse incontrollabile, l’enfisema avanzato e l’ incapacità del paziente di collaborare trattenendo il respiro quando richiesto.
Complicazioni
Durante la biopsia per aspirazione di masse palpabili con visualizzazione diretta potrebbero verificarsi complicazioni causate da lieve sanguinamento (controllato dalla pressione) e raramente da infezione. Se si utilizza una tecnica antisettica appropriata, il rischio di infezione è estremamente raro. Le complicazioni associate alla biopsia per aspirazione di lesioni profonde guidata da immagini comprendono emorragie, infezioni e trasferimento di cellule tumorali (evento raro), mentre le sonde toraciche possono causare pneumotorace, embolia gassosa ed enfisema sottocutaneo.
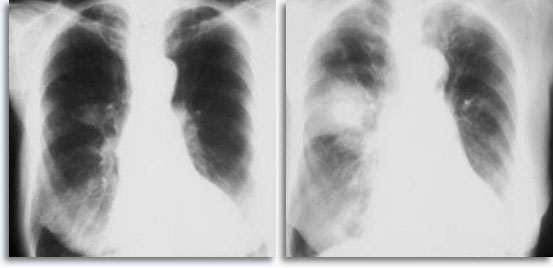
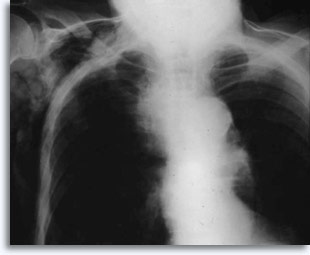
Se si prendono come riferimento gli aspirati polmonari percutanei transtoracici, è possibile prevedere un’emorragia quando l’ago attraversa la pleura e penetra nel parenchima polmonare e questa complicazione è in genere visibile nelle radiografie post-puntura del torace come un accrescimento dell’area di interesse.
|
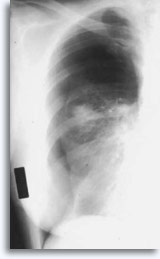
L’emorragia è sporadicamente associata a emottisi autolimitante, espressione clinica di un’infiltrazione intraparenchimale. Lo pneumotorace rappresenta un comune problema legato alla biopsia transtoracica per aspirazione perché l’ago attraversa la pleura per raggiungere la zona parenchimale da analizzare e provocando in certa misura il collasso polmonare; è lo pneumotorace sintomatico ad essere considerato una complicazione e a richiedere spesso l’inserimento di un tubo di drenaggio per consentire la ri-espansione del polmone.
 |
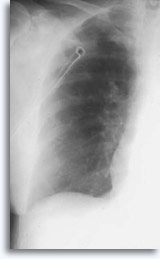 |
I fattori che influenzano il verificarsi di uno pneumotorace sintomatico comprendono: età del paziente, taglia, posizione e profondità della lesione, numero di punture, presenza di enfisema, indagine minuziosa con successive radiografie ed esperienza di chi esegue l’ agoaspirazione.
L’embolia gassosa può essere evitata se il radiologo utilizza un rubinetto a tre vie o si preoccupa di evitare che entri aria nell’ago durante il breve intervallo tra la rimozione del mandrino e l’inserimento nella siringa. L’enfisema sottocutaneo può verificarsi quando l’aria filtra attraverso i tessuti molli provocando una permeazione crepitante autolimitante.
 |
Studi approfonditi su un gran numero di pazienti sottoposti a biopsia per aspirazione presso il Karolinska Institute hanno dimostrato che il trasferimento di cellule maligne lungo il tratto dell’ago è un’eventualità estremamente rara, se non aneddotica, che si verifica forse in un caso su migliaia ed è in genere associata a un tumore altamente maligno che si sarebbe comunque disseminato in modo spontaneo.
La maggior parte delle fatalità è riconducibile all’uso di aghi trancianti al posto di aghi sottili e rappresenta un evento estremamente raro se si utilizzano aghi da 22 gauge. Tali eventi sono dovuti a emorragie endobronchiali provocate da aghi trancianti.
Tecnica per FNAB superficiale con visualizzazione diretta
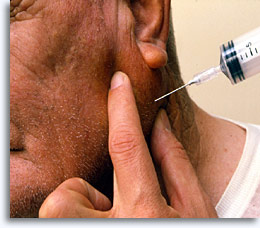
La biopsia per aspirazione con ago sottile rappresenta un metodo sicuro ed efficace per ottenere cellule utili per la valutazione diagnostica citologica delle masse superficiali palpabili di seno, tiroide, ghiandole salivari, linfonodi, cisti e tumori metastatici. Si utilizza una siringa da 20 cc, un ago da 22 gauge ed eventualmente una pistola per siringhe.
 |
 |
La preparazione del paziente è minima: è necessario illustrare la procedura, descrivere eventuali complicazioni, effetti collaterali, limitazioni e aspettative in termini di risultati, prendere nota dell’anamnesi (comprese allergie, terapia anticoagulante o tendenze al sanguinamento), ottenere un consenso informato firmato, rispettare i criteri dettati dall’etica e dalla normativa HIPAA (compresa la presenza di un’assistente qualora la paziente sia di sesso femminile), eseguire un esame della zona da analizzare ed effettuare un’adeguata antisepsi. Se necessario, l’esame può essere eseguito in anestesia locale.
Dopo la palpazione e il trattamento antisettico, l’ago viene inserito nell’area di interesse, lo stantuffo viene estratto per creare pressione negativa e l’ago viene fatto oscillare diverse volte in varie direzioni. Viene quindi ristabilito l’equilibrio delle pressioni e si procede alla rimozione dell’ago. La procedura giunge al termine quando l’aspirazione viene effettuata a un adeguato livello di penetrazione o quando nel cono della siringa compare il materiale desiderato. A questo punto, la siringa viene rimossa dall’ago e riempita d’aria affinché fornisca la forza di espulsione necessaria quando viene riconnessa all’ago. La siringa può essere utilizzata da sola o con una pistola per siringhe.
Le cellule ottenute grazie all’aspirazione vengono collocate su vetrini etichettati posizionando l’ago a contatto con il vetro con la parte smussata rivolta verso il basso ed espellendo una goccia di materiale. Utilizzando un secondo vetrino, la goccia viene distribuita dalla tensione superficiale in un monostrato circolare. I vetrini vengono separati con movimento veloce e perpendicolare, evitando lo strisciamento, e vengono immediatamente immersi in una soluzione di etanolo al 95%. È essenziale evitare il formarsi di artefatti dovuti all’essiccamento all’aria, salvo nel caso in cui i vetrini vengano volutamente fatti essiccare per eseguire una colorazione Romanowsky. L’ago può essere quindi risciacquato in soluzione salina o nella fiala ThinPrep®È possibile preparare un blocco di cellule utilizzando materiale solido.
 |
Se viene eseguita l’aspirazione di un linfonodo, è possibile eseguire “passaggi” aggiuntivi per preparare i vetrini per una colorazione rapida Diff-Quick e i campioni per il medium RPMI necessario per la citometria di flusso. Una diagnosi preliminare viene documentata e opportunamente comunicata al medico o al personale sanitario responsabile.
Tecnica per FNAB delle lesioni profonde guidata da immagini
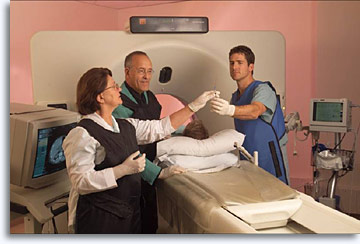
Le lesioni profonde non palpabili possono essere raggiunte indirizzando l’ago da 22 gauge verso l’area di interesse servendosi dell’ecografia, della radiografia o della tomografia computerizzata come guida. In genere, è un esperto di radiologia interventistica ad eseguire la puntura, coadiuvato da un citopatologo che ha la responsabilità di stabilire l’adeguatezza del campione, fornire una diagnosi immediata quando possibile e valutare la necessità di utilizzare tecniche complementari per assicurare l’elaborazione e la valutazione ottimali del campione. La presenza del citopatologo durante la procedura consente di garantire l’adeguatezza del campione, aumentare notevolmente la precisione della diagnosi da un punto di vista statistico, ridurre il numero di “passaggi” necessari e di pneumotoraci secondari negli aspirati del torace e di offrire suggerimenti immediati riguardo la scelta del trattamento. Il radiologo introduce il paziente alla procedura, decide la traiettoria, somministra l’anestetico, posiziona l’ago, preleva il campione e prescrive la terapia per eventuali complicazioni. Il radiologo ha il vantaggio di avere la certezza che il campione sia adeguato e l’elaborazione appropriata; il citopatologo è in grado di meglio comprendere il problema clinico e le relazioni anatomiche della lesione oggetto della biopsia. Il chirurgo può scegliere il miglior approccio operativo e mettere a punto strategie per la programmazione degli interventi in sala operatoria e per la gestione amministrativa. Infine, il paziente gode di tutti i benefici derivanti dalla collaborazione del team sanitario.
 |
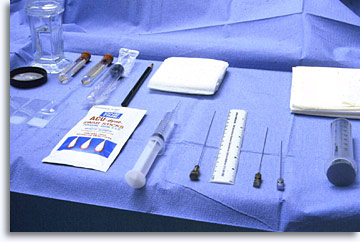
I materiali e i reagenti presenti sul vassoio della FNAB devono comprendere una soluzione antisettica, xilocaina all’1% con siringhe/aghi per l’iniezione, siringhe da 20 cc, aghi spinali flessibili da 22 gauge con mandrini, pistola per siringhe (opzionale), tamponi di garza sterile, vetrini puliti, etanolo al 95%, soluzione salina fisiologica, provette vuote sterili con tappo, fiale ThinPrep® , flacone con formalina al 10%.
 |
Dopo aver illustrato la procedura descritta in precedenza per gli aspirati ottenuti con visualizzazione diretta dalle lesioni palpabili, compresa l’acquisizione del consenso informato, il radiologo individua la posizione della lesione e decide la traiettoria utilizzando la modalità di visualizzazione delle immagini selezionata. Per gli aspirati della tiroide, il metodo più indicato per guidare l’ago in tempo reale e stabilire la posizione della punta nell’area di interesse è l’ecografia. È anche possibile ottenere un fermo immagine per verificare la corretta posizione della punta dell’ago.
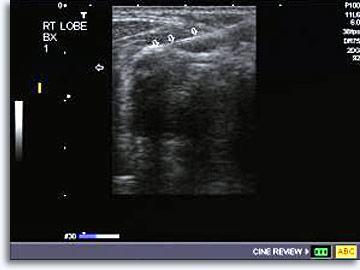 |
Per le lesioni polmonari e addominali, spesso si utilizza la TAC per guidare l’ago in modo preciso e accurato e documentare l’origine cellulare dall’area di interesse.
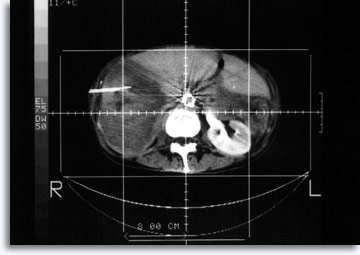 |
La radiografia viene impiegata raramente per le lesioni polmonari perché le innovazioni nel campo della TAC e la rapidità di generazione delle immagini hanno notevolmente migliorato l’efficacia dell’aspirazione. Di seguito viene riportato un esempio di FNAB tradizionale guidata tramite radiografia con l’ago nell’area di interesse.
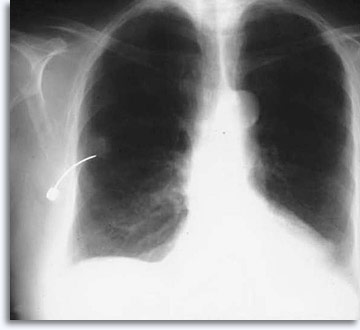 |
Dopo aver ottenuto le immagini per stabilire la corretta posizione dell’obiettivo (immagini di riferimento), il paziente viene trattato con l’antisettico e coperto per creare un campo sterile. Si somministra l’anestetico e quindi si inserisce nella lesione (lesioni toraciche e addominali) l’ago spinale flessibile da 22 gauge, con il mandrino inserito, alla profondità precedentemente stabilita oppure si posiziona l’ago da 22 gauge, inserito in una siringa da 20 cc, nell’area di interesse utilizzando l’ecografia come riferimento. Si controlla la punta dell’ago. Se si usa il mandrino, viene rimosso. Si collega la siringa all’ago e lo stantuffo viene estratto mentre l’ago oscilla diverse volte in varie posizioni. Una volta raggiunto l’equilibrio delle pressioni, l’ago viene rimosso dal corpo del paziente e staccato dalla siringa. Si fa entrare aria nella siringa, quindi viene nuovamente inserito l’ago. Il materiale viene espulso dall’ago su vetrini per l’analisi, viene distribuito e immediatamente immerso in una soluzione di etanolo al 95%. L’ago viene risciacquato in soluzione salina, nella fiala ThinPrep® o nell’RPMI. In genere, quando si analizzano lesioni e linfonodi toraco-addominali, il paziente viene trattenuto mentre si procede alla colorazione e all’interpretazione rapida dei vetrini per verificarne l’adeguatezza, l’urgenza del trattamento e la diagnosi. L’analisi della tiroide richiede in genere tre “passaggi” per area di interesse e il materiale viene colorato e interpretato dopo aver concluso l’ecografia.
 |
Tipi di campioni ottenuti mediante biopsia per aspirazione con ago sottile
Con un ago da 22 gauge è possibile prelevare campioni da qualsiasi regione del corpo, comprese parti insolite come il cervello, l’orbita oculare, i testicoli e il pene. L’approccio cambia in base all’area da analizzare, ma la tecnica rimane pressoché invariata. In teoria, la FNAB di qualsiasi tumore fornisce materiale contenente cellule che riflettono i pattern dell’architettura istologica e che consentono la classificazione di carcinomi, sarcomi, linfomi, melanomi e malattie indifferenziate.
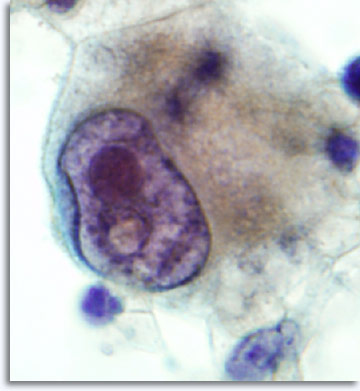
|
Se il riconoscimento del pattern non consente una diagnosi o una una classificazione specifiche, alcune tecniche complementari come l’immunocitochimica possono essere in grado di fornire informazioni utili. In presenza di processi infettivi, è possibile isolare gli agenti eziologici specifici dell’infezione grazie alla colorazione di Papanicolaou, alla colorazione Giemsa per i batteri, AFB per bacilli acido-resistenti, PAS e GMS per miceti.
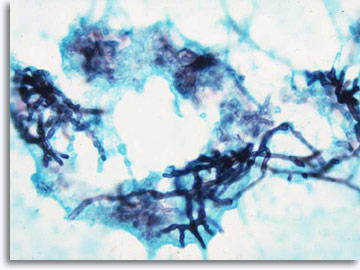
|
L’aspetto dei campioni può variare leggermente a seconda che le cellule vengano poste direttamente sui vetrini o trattate con la tecnica ThinPrep®su base liquida . Gli strisci ottenuti direttamente contengono detriti e sangue di fondo e i nuclei delle cellule maligne appaiono di solito più densi e ipercromici. Nelle analisi ThinPrep, l’aggregazione cellulare viene conservata, il sangue del fondo viene lisato e i nuclei delle cellule maligne possono apparire meno densi e ipercromici. L’aspetto vescicolare a vetro smerigliato tipica del carcinoma papillare della tiroide può rappresentare un’eccezione perché i cambiamenti visibili nei nuclei sono simili sia nei preparati convenzionali che in quelli in fase liquida.
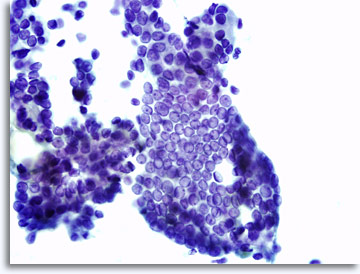 |
Striscio diretto
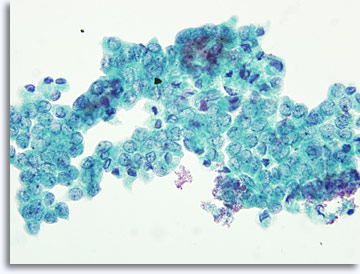 |
ThinPrep®
Il problema dell’adeguatezza dei campioni viene affrontato dalla Società Americana di Citopatologia e dalla Papanicolaou Society of Cytopathology attraverso la diffusione di linee guida per la FNA di specifici organi . Le linee guida FNA per il seno sono in fase di sviluppo presso la Società Americana di Citopatologia, mentre la Papanicolaou Society of Cytopathology ha già fornito linee guida specifiche per quanto riguarda la tiroide e il polmone. Vi è un certo grado di soggettività nella determinazione dell’adeguatezza dei campioni e non è pensabile una standardizzazione totale perché l’interpretazione varia in base all’esperienza dell’osservatore. Hologic, Inc. sta acquisendo esperienza per quanto riguarda i criteri che consentono di stabilire l’adeguatezza dei campioni raccolti e interpretati grazie alla tecnologia in fase liquida. Ad esempio, Hologic classifica come inadeguati i campioni che contengono solo sangue, fibrina senza epitelio (in presenza di cisti), solo cellule infiammatorie o colloide della tiroide senza cellule. Una rapida interpretazione al momento dell’esecuzione della biopsia per aspirazione consente di verificare immediatamente l’adeguatezza del campione e di accelerare la prassi clinica qualora fosse possibile formulare una diagnosi definitiva.
Considerazioni economiche
Se si esegue un confronto tra i costi della FNAB e quelli della biopsia tradizionale, risulta immediatamente evidente un notevole risparmio, in particolare se la FNAB viene eseguita in sede ambulatoriale. Il reale contenimento dei costi nell’offerta di cure mediche è strettamente legato alla produttività e in questo contesto l’aspirazione con ago presenta un grosso vantaggio. La raccolta di cellule grazie a una tecnica relativamente conveniente che non richiede ospedalizzazione e classifica l’urgenza del trattamento in base a protocolli terapeutici non chirurgici, compresa la terapia mirata, comporta molti vantaggi finanziari e un accesso più immediato all’assistenza in un sistema sanitario sempre più congestionato. Dal punto di vista ospedaliero, è possibile gestire più efficacemente le risorse delle sale operatorie perché il sistema risulta alleggerito e si può dare la precedenza a interventi chirurgici diversi da quelli per le biopsie, che altrimenti verrebbero rimandati, trasferiti o, in alcuni casi, mai eseguiti. Nelle piccole strutture ospedaliere, dove i posti letto sono limitati, non ospedalizzare i pazienti che necessitano di una biopsia consente di riservare il posto a coloro che da un punto di vista clinico devono veramente essere ricoverati. La FNAB consente di liberare i chirurghi, gli anestesisti, gli infermieri, e i patologi dalle responsabilità terapeutiche e analitiche post-biopsia. La riduzione del carico di lavoro dei tecnologi può contribuire a limitare la necessità di personale senza compromettere in alcun modo la qualità del servizio di assistenza offerto.
Il sistema sanitario statale o le assicurazioni provvederanno a rimborsare entrambe le componenti professionali e tecniche necessarie per l’esecuzione dell’aspirato come l’ immediata verifica dell’adeguatezza del campione la formulazione della diagnosi, l’interpretazione dell’ agoaspirato e quindi l’esame di preparati successivi come l’elaborazione ThinPrep®e i cell blocks e le preparazioni per l’immunocitochimica e la citometria di flusso. Se i “passaggi” multipli da una sede singola, ad esempio un nodulo unilaterale della tiroide, vengono considerati un’unica operazione ai fini del rimborso, la FNAB di sedi separate, come i noduli bilaterali della tiroide, viene rimborsata considerando il numero di sedi di accesso. Di seguito vengono elencati i codici CPT per facilitare la redazione della fattura.
| Codice CPT | Descrizione |
| 10021 | FNA senza guida tramite immagini |
| 88172 | Valutazione immediata dell’adeguatezza della FNA |
| 88173 | Interpretazione della FNA e risultato |
| 88305 | cell block |
| 88173 | ThinPrep, Cytospin |
| 88180 | Citometria di flusso |
| 87070 | Coltura routinaria |
| 88305 | Biopsia percutanea |
| 87102 | Coltura per bacilli acido-resistenti |
| 87116 | Coltura per miceti |
| 88342 | Immunocitochimica |
| 88312 | Colorazioni speciali |
Considerazioni conclusive
Fortunatamente abbiamo la possibilità di dedicarci alla citopatologia in un’epoca di grandi conquiste per la medicina in termini di microanatomia, diagnostica molecolare e gestione clinica di qualità. La citologia continua ad essere una forza trascinante nel campo dello screening, della diagnostica, della classificazione e della cura dei tumori. La biopsia per aspirazione con ago sottile rappresenta uno strumento unico che consente di raccogliere informazioni diagnostiche sicure, poco invasive, immediate, accurate, economicamente contenute e tessuto-equivalenti con rischi limitati di complicazioni soddisfando completamente il paziente. È una tecnica complementare alla radiografia per quanto riguarda l’esplorazione del corpo umano e la ricerca nel campo della diagnostica molecolare, della genetica e della terapia mirata. La sua applicazione alla citologia su base liquida lascia supporre che sarà possibile raggiungere un livello ancora più elevato di diversificazione e accuratezza.
