Introduction
Latha Pisharodi, MD
Le tube digestif (ou voies gastro-intestinales, voies GI) se compose de l’œsophage, de l’estomac, de l’intestin grêle et du gros intestin, séparés par des sphincters qui contrôlent le passage du contenu entre chaque partie du tube. En outre, chacune de ces divisions est caractérisée par un changement dans la nature muqueuse des cellules qui les tapissent. Les voies GI représentent l’organe digestif du corps, c’est-à-dire une source d’immunité et un système endocrinien.
Recueil des échantillons
Les échantillons cytologiques recueillis dans les voies GI peuvent être prélevés par brossage, lavage ou cytoponction à l’aiguille fine sous guidage radiographique. Un brossage consiste généralement à faire passer dans l’endoscope une brosse contenue dans une gaine transparente, puis à plonger cinq à dix fois la brosse dans la lésion. La brosse est ensuite rétractée et l’échantillon extrait sur des lames de verre ou dans une solution de conservation.
La cytoponction endoscopique à l’aiguille fine implique généralement l’introduction de l’aiguille par le biais d’un endoscope à fibre optique. Une fois la lésion localisée, une pression négative est appliquée à l’aiguille, laquelle est bougée d’avant en arrière dans la lésion. La pression est relâchée, l’aiguille retirée et l’échantillon recueilli dans une solution de conservation.
Les échantillons peuvent être recueillis dans une solution CytoLyt® et traités dans le processeur ThinPrep®2000 ou recueillis dans d’autres solutions de conservation et traités dans une cytocentrifugeuse Cytospin ou sous forme de frottis traditionnels.
Œsophage
Les cellules tapissant normalement l’œsophage sont des cellules épithéliales malpighiennes non kératinisées. On trouve rarement des cellules métaplasiques provenant des glandes sous-muqueuses. Enfin, des cellules glandulaires prismatiques peuvent provenir de l’estomac ou de l’œsophage de Barrett.
Une œsophagite non spécifique présente généralement une inflammation aiguë et/ou chronique avec phénomènes réactionnels. L’œsophagite herpétique présente des effets cytopathogènes classiques (multinucléation, inclusions virales eosinophiles et noyaux d’aspect verre dépoli). Quand à l’œsophagite à Candida, on la diagnostique en détectant des spores fongiques et des hyphes pseudo-cloisonnés. On observe rarement d’autres organismes comme l’Aspergillus.
L’évaluation cytologique de l’oesophage constitue un outil important pour le diagnostic de cancer oesophagien, en particulier dans les pays où l’on note de nombreux cas de cette maladie (par ex. Chine et Japon) et qui font l’objet d’un vaste programme de dépistage. Plusieurs auteurs ont montré qu’une approche associant cytologie et biopsie convient mieux à l’établissement d’un diagnostic de néoplasme des voies GI supérieures 1, 2.La dysplasie glandulaire survenant dans un fond d’œsophage de Barrett présente généralement des cellules atypiques dispersées avec certaines (mais pas toutes) caractéristiques d’un adénocarcinome. Les cellules malpighiennes atypiques avec formes bizarres, hyperchromasie et pléomorphisme caractérisent les épithéliomas spinocellulaires bien différenciés. Les épithéliomas spinocellulaires mal différenciés affichent en général des cellules hautement pléomorphes avec rapport N/C élevé, nucléoles et cytoplasme dense. Enfin, les adénocarcinomes présentent généralement des groupes et amas de cellules épithéliales néoplasiques.
Estomac
L’épithélium qui tapisse l’estomac se compose de cellules glandulaires prismatiques généralement disposées dans des amas présentés en nid d’abeille. Des vacuoles de mucine peuvent être observées. Les brossages gastriques contiennent rarement des cellules pariétales et bordantes. La coloration de Pap fait apparaître le cytoplasme acidophile des cellules pariétales, tandis que les cellules bordantes sont mieux identifiées par la coloration de Romanowsky 3.Les pylores de Helicobacter (Helicobacter pylori) sont des bactéries spiralées Gram négatives facilement identifiables à l’aide de colorations de Pap, Romanowsky, Warthin-Starry et H & E. Les phénomènes réactionnels et réparations non spécifiques, les cellules inflammatoires, l’activité mitotique et les nucléoles proéminents caractérisent les ulcères gastriques et la gastrite. Les adénocarcinomes gastriques présentent des cellules épithéliales malignes avec atypie prononcée. Des cellules en anneau peuvent être présentes. La présence de cellules malpighiennes malignes suggère un carcinome adéno-épidermoïde, un carcinome malpighien pur de l’estomac (rare) ou l’extension dans l’estomac d’un épithélioma spinocellulaire œsophagien. Les autres tumeurs (carcinoïdes, stromales, etc.) sont rarement diagnostiquées par la cytologie des brossages gastriques. La sensibilité diagnostique de ces tumeurs est beaucoup plus élevée avec la cytoponction endoscopique à l’aiguille fine qu’avec le brossage.
Canal biliaire
Les brossages de canal biliaire sont généralement acquis par cholangio-pancréatographie rétrograde endoscopique (CPRE). Des échantillons peuvent également être obtenus à l’aide de tuteurs biliaires. La cytologie biliaire est principalement indiquée en cas de suspicion de tumeur maligne chez les patients présentant un rétrécissement du canal biliaire. Les phénomènes réactionnels et réparations sont fréquemment observés dans les maladies infectieuses et la cholangite sclérosante primitive. Dans le canal biliaire, les caractéristiques cytologiques de la dysplasie incluent l’encombrement et la superposition, l’augmentation du rapport nucléo/cytoplasmique et une répartition anormale de la chromatine. L’atypie est néanmoins moins grave que dans l’adénocarcinome. L’adénocarcinome du canal biliaire (cholangiome) est cytologiquement similaire à celui des voies GI. En raison de ses caractéristiques cytologiques ternes, la variante mucineuse peut être particulièrement complexe à diagnostiquer. Ces cellules contenant de la mucine en abondance sont parfois confondues avec des histiocytes.
Côlon
Les cellules sont obtenues par brossage endoscopique, lavage ou cytoponction à l’aiguille fine. Une muqueuse colique normale est représentée par de grandes cellules prismatiques isolées ou en groupes. On peut observer des cellules caliciformes. Certains auteurs ayant décrit les caractéristiques cytologiques de l’adénome indiquent que l’adénome tubuleux présente davantage de cellules plates et émoussées, tandis que l’adénome villeux affiche des cellules allongées et fuselées 4. L’adénocarcinome du côlon présente des groupes cohésifs hautement atypiques de cellules glandulaires avec nucléoles proéminents et fond nécrotique. La sensibilité du brossage colique dans le diagnostic du cancer du côlon oscille entre 70 et 85 % 5. En revanche, la cytologie associée à la biopsie se traduit par une précision supérieure6.
Brossages anaux
Tout comme la zone de transformation du col de l’utérus, la jonction malpighienne prismatique du canal anal est prédisposée au développement d’une néoplasie7.L’aspect cytologique des deux types d’échantillons est très similaire. En fait, les résultats peuvent être classés selon les critères du système Bethesda 8.
Le matériel cytologique d’évaluation est facilement obtenu par grattage direct de la zone et étalement sur des lames de verre ou rinçage dans une solution de conservation. En outre, les frottis anaux sont de plus en plus employés pour le dépistage des changements dysplasiques, en particulier chez les patients séropositifs9. L’épithélioma spinocellulaire de la région anale présente des cellules malpighiennes néoplasiques caractéristiques avec divers degrés de différenciation.
Références
- C P Shroff, S A Nanivadekar: Endoscopic brushing cytology and biopsy in the diagnosis of upper gastrointestinal tract lesions. A study of 350 cases. Acta Cytol 1988: 32 (4}: 455-60.
- O Donoghue, P G Horgan, M K Donohoe et al: Adjunctive endoscopic brush cytology in the detection of upper gastrointestinal malignancy. Acta Cytol 1995: 39(1}: 28-33.
- M Drake: Gastric cytology: normal and abnormal. In Gastroesophageal Cytology. Basel: Karger, 1985, page 120.
- V Kannan, CB Masters: Cytodiagnosis of colonic adenoma: morphology and clinical importance. Diag Cytopathol 1991 7(4}: 13-16
- RG Bardawil, FG Ambrosio, SI Hajdu: Colonic cytology. A retrospective study with histologic correlation. Acta Cytol 1990; 34 (5}: 10-12
- M Halpern, R Gal, L Rath-Wolfson, R Koren et al. Brush cytology and biopsy in the diagnosis of colorectal cancer. A comparison. Acta Cytol 1997; 41 (3}: 628-32.
- Goldstone et al. High Prevalence of Anal Squamous Intraepithelial Lesions and Squamous Cell Carcinoma in Men Who Have Sex with Men as Seen in a Surgical Practice. Dis Colon Rectum 2001;44:690-698.
- Darragh et al. Comparison of Conventional Cytologic Smears and ThinPrep Preparations from the Anal Canal. Acta Cytol 1997;41:1167-70.
- MA Friedlander, E Stier, O Lin. Anorectal cytology as a screening tool for anal squamous lesions: cytologic, anoscopic, and histologic correlation. Cancer 2004: 102(1}:19-26.
Cytologie Œsophagienne

Rappel : Vous pouvez cliquer sur une image
de l’Atlas pour la voir dans un format plus grand.
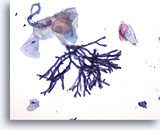
Figure 1
Brossage œsophagien – Aspergillus
Brossage œsophagien montrant une espèce d’Aspergillus avec hyphes cloisonnés et ramifications à 45°. Une atypie cellulaire malpighienne peut être (dans de rares cas) observée.
20x
Figure 1
Brossage œsophagien – Aspergillus
Brossage œsophagien montrant une espèce d’Aspergillus avec hyphes cloisonnés et ramifications à 45°. Une atypie cellulaire malpighienne peut être (dans de rares cas) observée.
20x
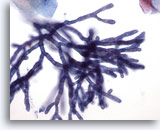
Figure 2
Brossage œsophagien – Aspergillus
Un plus fort grossissement fait apparaître des cloisons et des ramifications à 45°.
40x
Figure 2
Brossage œsophagien – Aspergillus
Un plus fort grossissement fait apparaître des cloisons et des ramifications à 45°.
40x
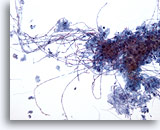
Figure 3
Brossage œsophagien – Candida
Œsophagite à Candida caractérisée par des pseudo-hyphes allongés et des levures ovoïdes.
20x
Figure 3
Brossage œsophagien – Candida
Œsophagite à Candida caractérisée par des pseudo-hyphes allongés et des levures ovoïdes.
20x
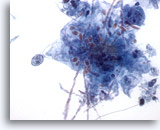
Figure 4
Brossage œsophagien – Candida
Levures de bourgeonnement facilement identifiables.
60x
Figure 4
Brossage œsophagien – Candida
Levures de bourgeonnement facilement identifiables.
60x
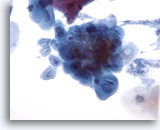
Figure 5
Brossage œsophagien – Herpès
Infection herpétique démontrée par des caractéristiques cytologiques classiques telles que la multinucléation, le moulage nucléaire et la chromatine d’aspect verre dépoli..
40x
Figure 5
Brossage œsophagien – Herpès
Infection herpétique démontrée par des caractéristiques cytologiques classiques telles que la multinucléation, le moulage nucléaire et la chromatine d’aspect verre dépoli..
40x

Figure 6
Brossage œsophagien – Herpès
Des inclusions intranucléaires éosinophiles peuvent être observées dans les infections par le virus de l’herpès.
40x
Figure 6
Brossage œsophagien – Herpès
Des inclusions intranucléaires éosinophiles peuvent être observées dans les infections par le virus de l’herpès.
40x
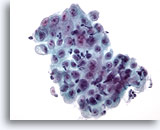
Figure 7
Brossage œsophagien – Ulcère
Amas de cellules épithéliales recouvertes de cellules inflammatoires et changements dus à un phénomène réactionnel. 40x
Figure 7
Brossage œsophagien – Ulcère
Amas de cellules épithéliales recouvertes de cellules inflammatoires et changements dus à un phénomène réactionnel.
40x
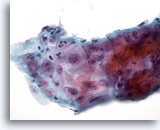
Figure 8
Brossage œsophagien – Ulcère
Réparation atypique dans un ulcère de l’œsophage : infiltrat inflammatoire, atypie réactionnelle avec nucléoles proéminents, membranes nucléaires lisses et chromatine fine.
60x
Figure 8
Brossage œsophagien – Ulcère
Réparation atypique dans un ulcère de l’œsophage : infiltrat inflammatoire, atypie réactionnelle avec nucléoles proéminents, membranes nucléaires lisses et chromatine fine.
60x
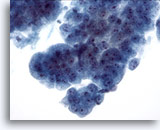
Figure 9
Brossage œsophagien, dysplasie de haut grade dans l’épithélium de Barrett.
Groupes cohésifs de cellules glandulaires atypiques présentant certaines (mais pas toutes) caractéristiques de l’adénocarcinome.
40x
Figure 9
Brossage œsophagien, dysplasie de haut grade dans l’épithélium de Barrett.
Groupes cohésifs de cellules glandulaires atypiques présentant certaines (mais pas toutes) caractéristiques de l’adénocarcinome.
40x
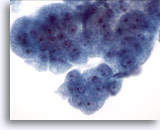
Figure 10
Brossage œsophagien, dysplasie de haut grade dans l’épithélium de Barrett.
Groupe de cellules cohésives avec noyaux de taille variable, rapport nucléo/cytoplasmique élevé, superposition et encombrement. Les caractéristiques cytologiques ne suffisent pas à établir un diagnostic définitif d’adénocarcinome. 60x
Figure 10
Brossage œsophagien, dysplasie de haut grade dans l’épithélium de Barrett.
Groupe de cellules cohésives avec noyaux de taille variable, rapport nucléo/cytoplasmique élevé, superposition et encombrement. Les caractéristiques cytologiques ne suffisent pas à établir un diagnostic définitif d’adénocarcinome.
60x
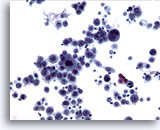
Figure 11
Brossage œsophagien, épithélioma spinocellulaire.
Cellules épithéliales hautement atypiques permettant d’établir un diagnostic de carcinome mal différencié.
20x
Figure 11
Brossage œsophagien, épithélioma spinocellulaire..
Cellules épithéliales hautement atypiques permettant d’établir un diagnostic de carcinome mal différencié.
20x
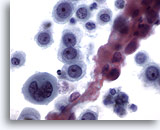
Figure 12
Brossage œsophagien, épithélioma spinocellulaire mal différencié.
Cellules épithéliales atypiques avec chromatine anormale. La différenciation malpighienne n’est pas évidente.
60x
Figure 12
Brossage œsophagien, épithélioma spinocellulaire mal différencié.
Cellules épithéliales atypiques avec chromatine anormale. La différenciation malpighienne n’est pas évidente.
60x
Cytologie gastrique
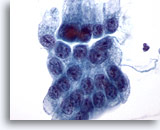
Figure 13
Brossage gastrique, dysplasie gastrique.
Amas plat de cellules épithéliales gastriques atypiques avec noyaux augmentés en taille, encombrement et superposition focale des cellules.
60x
Figure 13
Brossage gastrique, dysplasie gastrique.
Amas plat de cellules épithéliales gastriques atypiques avec noyaux augmentés en taille, encombrement et superposition focale des cellules.
60x
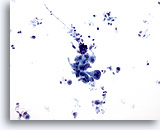
Figure 14
Brossage gastrique, adénocarcinome gastrique.
Groupe cohésif de cellules atypiques. Noter le fond sale..
20x
Figure 14
Brossage gastrique, adénocarcinome gastrique.
Groupe cohésif de cellules atypiques. Noter le fond sale..
20x
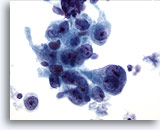
Figure 15
Brossage gastrique, adénocarcinome gastrique.
Cellules épithéliales néoplasiques affichant un pléomorphisme et des nucléoles proéminents.
60x
Figure 15
Brossage gastrique, adénocarcinome gastrique.
Cellules épithéliales néoplasiques affichant un pléomorphisme et des nucléoles proéminents.
60x
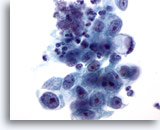
Figure 16
Brossage gastrique, adénocarcinome gastrique.
Adénocarcinome avec une cellule en anneau à une extrémité. Les cellules en anneau (ou “bague à chatons”) sont caractérisées par d’énormes vacuoles de mucine qui compriment le noyau dans un croissant contre la membrane nucléaire.
60x
Figure 16
Brossage gastrique, adénocarcinome gastrique.
Adénocarcinome avec une cellule en anneau à une extrémité. Les cellules en anneau (ou “bague à chatons”) sont caractérisées par d’énormes vacuoles de mucine qui compriment le noyau dans un croissant contre la membrane nucléaire.
60x
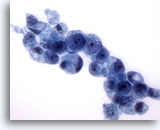
Figure 17
Brossage gastrique, adénocarcinome gastrique.
Davantage de cellules en anneau présentant une morphologie type.
60x
Figure 17
Brossage gastrique, adénocarcinome gastrique.
Davantage de cellules en anneau présentant une morphologie type.
60x
Cytologie colique
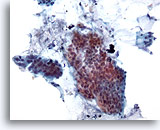
Figure 18
Brossage colique, adénocarcinome colique.
Faible grossissement d’un brossage colique montrant des cellules épithéliales atypiques.
20x
Figure 18
Brossage colique, adénocarcinome colique.
Faible grossissement d’un brossage colique montrant des cellules épithéliales atypiques.
20x
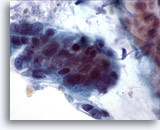
Figure 19
Brossage colique, adénocarcinome colique.
Fort grossissement faisant apparaître le pléomorphisme, l’encombrement et la superposition des cellules.
60x
Figure 19
Brossage colique, adénocarcinome colique.
Fort grossissement faisant apparaître le pléomorphisme, l’encombrement et la superposition des cellules.
60x
Cytologie pancréatique
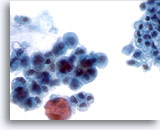
Figure 20
Brossage de canal pancréatique, adénocarcinome pancréatique.
Brossage pancréatique présentant les caractéristiques cytologiques d’un adénocarcinome du pancréas. À comparer avec l’épithélium non néoplasique contigu.
40x
Figure 20
Brossage de canal pancréatique, adénocarcinome pancréatique.
Brossage pancréatique présentant les caractéristiques cytologiques d’un adénocarcinome du pancréas. À comparer avec l’épithélium non néoplasique contigu.
40x
Cytologie du canal biliaire
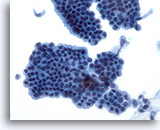
Figure 21
Brossage du canal biliaire, épithélium normal.
Amas de cellules épithéliales disposées en nid d’abeille sans atypie.
40x
Figure 21
Brossage du canal biliaire, épithélium normal.
Amas de cellules épithéliales disposées en nid d’abeille sans atypie.
40x

Figure 22
Brossage de canal pancréatique, cholangiome.
Cellules épithéliales malignes situées à côté d’un épithélium de canal biliaire normal.
20x
Figure 22
Brossage de canal pancréatique, cholangiome.
Cellules épithéliales malignes situées à côté d’un épithélium de canal biliaire normal.
20x
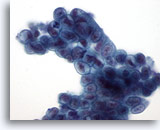
Figure 23
Brossage du canal biliaire, adénocarcinome mucineux bien différencié.
Épithélium mucineux disposé en syncytium avec hyperchromasie nucléaire et membranes nucléaires irrégulières.
60x
Figure 23
Brossage du canal biliaire, adénocarcinome mucineux bien différencié.
Épithélium mucineux disposé en syncytium avec hyperchromasie nucléaire et membranes nucléaires irrégulières.
60x
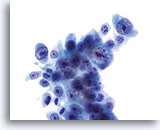
Figure 24
Brossage de canal pancréatique, cholangiome.
Adénocarcinome mal différencié avec atypie nucléaire grave et nucléoles proéminents.
60x
Figure 24
Brossage de canal pancréatique, cholangiome.
Adénocarcinome mal différencié avec atypie nucléaire grave et nucléoles proéminents.
60x
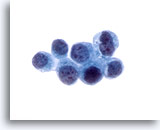
Figure 25
Brossage de canal pancréatique, cancer métastatique du sein.
Adénocarcinome avec métastases dans le sein. Diagnostic confirmé à l’aide de colorations immunohistochimiques du cytobloc.
60x
Figure 25
Brossage de canal pancréatique, cancer métastatique du sein.
Adénocarcinome avec métastases dans le sein. Diagnostic confirmé à l’aide de colorations immunohistochimiques du cytobloc.
60x
Cytologie anale
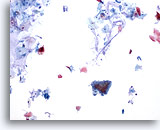
Figure 26
Brossage anal, épithélium glandulaire normal.
Les brossages anaux contiennent systématiquement de la mucine dans le fond, un épithélium glandulaire normal et un épithélium malpighien normal. L’hyperkératose est généralement abondante.
10x
Figure 26
Brossage anal, épithélium glandulaire normal.
Les brossages anaux contiennent systématiquement de la mucine dans le fond, un épithélium glandulaire normal et un épithélium malpighien normal. L’hyperkératose est généralement abondante.
10x
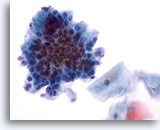
Figure 27
Brossage anal, épithélium glandulaire normal.
Un plus fort grossissement fait apparaître la disposition en galets et en palissade.
40x
Figure 27
Brossage anal, épithélium glandulaire normal.
Un plus fort grossissement fait apparaître la disposition en galets et en palissade.
40x

Figure 28
Brossage œsophagien, atypies cellulaires malpighiennes (ASC).
Changements suggérant un cas de VPH mais ne suffisant pas à établir un diagnostic de LSIL ; échantillon classé dans la catégorie ASC.
40x
Figure 28
Brossage œsophagien, atypies cellulaires malpighiennes (ASC).
Changements suggérant un cas de VPH mais ne suffisant pas à établir un diagnostic de LSIL ; échantillon classé dans la catégorie ASC.
40x
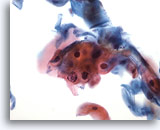
Figure 29
Brossage œsophagien, atypies cellulaires malpighiennes (ASC).
La parakératose (PK) atypique (différente de la LSIL) entre dans la catégorie des ASC.
40x
Figure 29
Brossage œsophagien, atypies cellulaires malpighiennes (ASC).
La parakératose (PK) atypique (différente de la LSIL) entre dans la catégorie des ASC.
40x
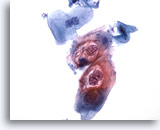
Figure 30
Brossage anal, lésion intra-épithéliale anale de bas grade.
Ces cellules binucléées avec cavités cytoplasmiques associées au VPH permettent d’établir un diagnostic de lésion intra-épithéliale anale de bas grade.
40x
Figure 30
Brossage anal, lésion intra-épithéliale anale de bas grade.
Ces cellules binucléées avec cavités cytoplasmiques associées au VPH permettent d’établir un diagnostic de lésion intra-épithéliale anale de bas grade.
40x

Figure 31
Brossage anal, lésion intra-épithéliale anale de bas grade.
Les lésions intra-épithéliales anales de bas grade peuvent être caractérisées par des cellules malpighiennes métaplasiques avec noyaux augmentés en taille.
40x
Figure 31
Brossage anal, lésion intra-épithéliale anale de bas grade.
Les lésions intra-épithéliales anales de bas grade peuvent être caractérisées par des cellules malpighiennes métaplasiques avec noyaux augmentés en taille.
40x
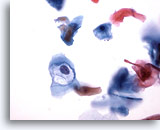
Figure 32
Brossage anal, lésion intra-épithéliale anale de bas grade.
Les cavités associées au VPH permettent d’établir un diagnostic de lésion intra-épithéliale anale de bas grade.
40x
Figure 32
Brossage anal, lésion intra-épithéliale anale de bas grade.
Les cavités associées au VPH permettent d’établir un diagnostic de lésion intra-épithéliale anale de bas grade.
40x
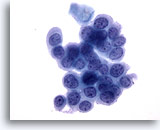
Figure 33
Brossage anal, lésion intra-épithéliale anale de haut grade.
Cellules rondes avec rapports N/C élevés et chromatine répartie de façon homogène, caractéristiques cytologiques des lésions intra-épithéliales anales de haut grade.
40x
Figure 33
Brossage anal, lésion intra-épithéliale anale de haut grade.
Cellules rondes avec rapports N/C élevés et chromatine répartie de façon homogène, caractéristiques cytologiques des lésions intra-épithéliales anales de haut grade.
40x
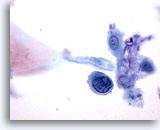
Figure 34
Brossage anal, lésion intra-épithéliale anale de haut grade.
La présence de cellules isolées avec rapports N/C élevés et noyaux hyperchromatiques permet d’établir un diagnostic de lésion intra-épithéliale anale de haut grade.
60x
Figure 34
Brossage anal, lésion intra-épithéliale anale de haut grade.
La présence de cellules isolées avec rapports N/C élevés et noyaux hyperchromatiques permet d’établir un diagnostic de lésion intra-épithéliale anale de haut grade.
60x
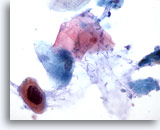
Figure 35
Brossage anal, lésion intra-épithéliale anale de haut grade.
On peut parfois observer des cellules kératinisées atypiques avec noyaux hyperchromatiques augmentés en taille dans les lésions intra-épithéliales anales de haut grade.
60x
Figure 35
Brossage anal, lésion intra-épithéliale anale de haut grade.
On peut parfois observer des cellules kératinisées atypiques avec noyaux hyperchromatiques augmentés en taille dans les lésions intra-épithéliales anales de haut grade.
60x
Retour au début
Retour à la table des matières



































