Atlas Gyn Section Une
REMERCIEMENTS
Suzanne M. Werneke, BA, CT(ASCP)
Je souhaite remercier Kurt Douglass, CT(ASCP), dont la version originale du ThinPrep Morphology Reference Manual (toujours utilisé) a permis à ce projet de voir le jour. Un grand merci également à Mike LeDonne, CT(ASCP) pour ses nombreuses images numériques utilisées dans cet atlas.
Je remercie personnellement tous les rédacteurs pour leur travail assidu qui nous a permis de respecter les délais fixés. Les pathologistes et cytotechnologistes nous ont communiqué leur enthousiasme et leur passion de la cytologie. Nous avons énormément appris à leur contact.
Enfin, un grand merci à Charlotte L. Brahm, CT(ASCP), directrice de la rédaction, dont le nom n’apparaît pas dans cet atlas, mais qui a travaillé sans relâche à sa réalisation.
Collaborateurs :
Raheela Ashfaq, MD
Professor, Department of Pathology, University of Texas Southwestern Medical Center, and Director of Cytopathology and Oncodiagnostic Laboratory, Parkland Health and Hospital, Dallas, TX
R. Marshall Austin, MD, PhD
Medical Director and Director of Cytopathology and Gynecologic Pathology Services, Coastal Pathology Associates, Charleston, SC
John M. Bauer, MD
Medical Director, Piedmont Pathology, Incorporated, Hickory, NC
Diane D. Davey, MD
Professor of Pathology and Laboratory Medicine, Director of Cytopathology and Bone Marrow Service, Director of Cytopathology Fellowship Program, University of Kentucky, Lexington, KY
Luis A. Diaz-Rosario, MD
Medical Director, Anatomic Pathology, Quest Diagnostics, Incorporated, Tampa, FL
Martha L. Hutchinson, MD, PhD
Associate Professor Pathology, Brown University, Providence, RI
Deanna K. Iverson, MHS, SCT(ASCP), HTL
Pathology Manager, Palo Alto Medical Foundation, Palo Alto, CA
Joyce E. Johnson, MD
Associate Professor, Department of Pathology, Director Division of Education, Vanderbilt University Medical Center, Nashville, TN
James Linder, MD
Medical Director, Hologic, Inc., Marlborough, MA; Professor, Pathology and Microbiology,
University of Nebraska Medical Center, Omaha, NE
Jacalyn L. Papillo, BS, CT(ASCP)
Cytopathology Manager, Fletcher Allen Healthcare, Burlington, VT
Pamela Smith Piraino, CT(ASCP)
Clear Path Diagnostics, Syracuse, NY
Richard A. Smith, MD, PhD
Chief of Pathology, Sturdy Memorial Hospital, Attleboro, MA
Zahniser, David, PhD
President, Diagnostic Vision Incorporated, Wellesley, MA
INTRODUCTION
Cet atlas a été conçu pour aider les cytotechnologistes et pathologistes à développer et améliorer leurs capacités d’interprétation du matériel de cytologie gynécologique à l’aide du frottis ThinPrep®.Les premiers travaux de R & D menés par Hologic, Inc. sur cette méthode ont établi une base de comparaison avec des frottis cervico-vaginaux conventionnels. Depuis lors, d’autres cytotechnologistes et pathologistes cliniciens du monde entier ont permis de perfectionner cette base. Cet atlas a pour objectif de servir d’outil éducatif et de référence continue aux utilisateurs des frottis ThinPrep.
L’organisation de l’atlas correspond au système Bethesda développé au National Cancer Institute et résumé dans l’ouvrage de Robert J. Kurman et Diane Solomon, intitulé The Bethesda System for Reporting Cervical/Vaginal Cytologic Diagnoses: Definitions, Criteria and Explanatory Notes for Terminology and Specimen Adequacy (New York: Springer-Verlag, 1994). Cette publication a fait l’objet de mises à jour pour inclure la nomenclature Bethesda 2001. L’ouvrage The Art and Science of Cytopathology du Dr. Richard DeMay a également servi de référence pour les critères cytologiques associés à l’atypie, la dysplasie et des lésions plus graves.
Pour chaque catégorie diagnostique, des images illustrent la morphologie du frottis ThinPrep (TPPT), le frottis conventionnel correspondant, ainsi que les principales entités semblables. Sauf mention contraire, toutes les photographies de cet atlas représentent des lames ThinPrep. Elles ont pour but d’illustrer les résultats types des préparations ThinPrep et peuvent faire l’objet d’interprétations individuelles.
PRÉSENTATION DE LA
MÉTHODE DE PRÉPARATION THINPREP
Le système ThinPrep®pour échantillons de Papanicolaou a été approuvé par la FDA pour remplacer la méthode conventionnelle de détection des atypies cellulaires, du cancer du col et de ses lésions précurseurs, ainsi que d’autres catégories cytologiques définies dans le système Bethesda. Le frottis ThinPrep s’est avéré beaucoup plus efficace que le frottis cervico-vaginal conventionnel dans la détection des lésions malpighiennes intra-épithéliales de bas grade (LSIL) et de lésions plus graves dans différentes populations de patientes. Une étude “direct au flacon” des HSIL a notamment montré que son utilisation induit une augmentation de 59,7 % des lésions malpighiennes intra-épithéliales de haut grade (HSIL) et des lésions de grade supérieur détectées. La qualité des prélèvements est en outre considérablement améliorée par rapport aux préparations conventionnelles.
L’amélioration de la précision des frottis repose sur un prélèvement et une préparation optimales des échantillons. Les différences notées entre les procédures de préparation des frottis conventionnels et des échantillons ThinPrep se retrouvent dans l’aspect microscopique de ces deux méthodes. L’interprétation correcte des lames ThinPrep nécessite la compréhension de la méthode de préparation ThinPrep, en particulier en ce qui concerne la qualité des prélèvements, qui affecte la conservation et la présentation des échantillons. Voici donc un résumé de la méthode de préparation ThinPrep.
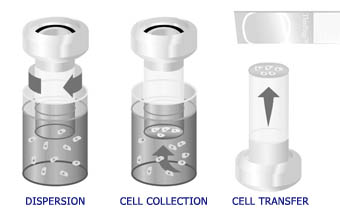
Le traitement automatisé du processeur ThinPrep inclut la dispersion de l’échantillon, une filtration de précision pour recueillir les cellules sur une membrane et le transfert sur une lame de verre.
Processeur ThinPrep :
Principes de fonctionnement
Le procédé ThinPrep commence par le prélèvement de l’échantillon gynécologique de la patiente par le clinicien à l’aide d’un instrument semblable à un balai ou combinant brosse/spatule en plastique. Le dispositif est ensuite rincé dans le flacon contenant le prélèvement et la solution PreservCyt®. Le flacon ThinPrep est enfin fermé, étiqueté et envoyé à un laboratoire équipé d’un processeur ThinPrep.
Au laboratoire, le flacon contenant l’échantillon est comparé au formulaire d’examen cytologique correspondant, puis un numéro cytologique est attribué au formulaire, au flacon et à une lame ThinPrep. Le flacon et la lame correspondante sont placés dans le processeur ThinPrep avec un cylindre de filtration gynécologique jetable (filtre clair), puis l’opérateur sélectionne la séquence de lames appropriée. Le processeur homogénéise l’échantillon en faisant tourner le filtre (T2000) ou le flacon (T3000) afin de créer dans le liquide des forces de cisaillement suffisantes pour briser les gros amas de cellules, le sang, le mucus et les débris non diagnostiques tout en conservant intacts les groupes de cellules. Si elles sont correctement rincées, toutes les cellules recueillies vont dans la solution au lieu de rester sur l’instrument et d’être jetées après un frottis conventionnel. Combinée à la randomisation de l’échantillon de cellules pendant la phase de rotation, cette procédure permet le transfert d’un échantillon cellulaire représentatif sur la lame et une représentation plus précise de l’état de l’épithélium de la patiente.
Les cellules sont ensuite recueillies sur la membrane du filtre TransCyt en appliquant un léger vide pour aspirer le liquide à travers la membrane. Pendant le recueil du matériel du flacon sur la membrane du filtre, les pores de la membrane se bloquent et le processeur arrête l’aspiration. Le débit du filtre TransCyt est constamment surveillé pour réduire au minimum le risque de variations entre les échantillons.
Quand le processeur arrête l’étape de filtration, le cylindre est retiré du flacon et partiellement tourné pour évacuer le filtrat dans la bouteille destinée aux déchets. Une rotation est ensuite appliquée au cylindre jusqu’à la lame de verre, puis une légère pression d’air est appliquée au filtre pour assurer le transfert des cellules entre le filtre et la lame. En raison des propriétés adhésives des cellules et des propriétés électrochimiques des lames ThinPrep, les cellules présentent une affinité supérieure avec la lame de verre qu’avec la membrane du filtre, et une fine couche de cellules est transférée sur la lame dans un cercle de 20 mm de diamètre. Une fois le transfert des cellules terminé, la lame est retirée du contact du cylindre et automatiquement éjectée dans un bain fixateur. Elle est ensuite retirée par l’opérateur et placée dans un portoir de lames (T2000) pour coloration de Papanicolaou et montage entre lame et lamelle. Dans le processeur T3000, la lame est fixée par l’instrument avec une solution fixatrice brumisée et placée dans un portoir de lames pour coloration de Papanicolaou et montage entre lame et lamelle.
RÉFÉRENCES :
- Hutchinson ML, et al: Homogeneous sampling accounts for the increased diagnostic accuracy using the ThinPrep® Processor. Am J of Clin Pathol 1994; 101:215-219.
- ThinPrep® 2000 System Package Insert, Hologic, Inc., 2001.
- TP® 2000 Operator’s Manual, Rev G, Hologic, Inc., 2000.
- TP® 3000 Operator’s Manual, Rev C, Hologic, Inc., 2000-2001.
BASES SCIENTIFIQUES
David Zahniser, PhD
Le frottis cervico-vaginal faux négatif représente un problème de qualité important pour les laboratoires. L’impossibilité de détecter des maladies cervicales est due à des erreurs d’échantillonnage ou de dépistage. Les erreurs d’échantillonnage représentent la majorité (entre 60 et 80 %) des faux négatifs, le reste étant dû à des erreurs de dépistage et d’interprétation. Par le passé, les erreurs d’échantillonnage étaient attribuées au prélèvement effectué par le clinicien. La raison pressentie était la taille ou l’emplacement de la lésion (trop petite ou en haut du canal endocervical). Il est devenu évident que les erreurs d’échantillonnage jouent un rôle important dans la restriction de la sensibilité du frottis cervico-vaginal. Les premiers travaux de développement du système ThinPrep® 2000 ont permis de découvrir les pièges inhérents à la préparation des frottis conventionnels (par la suite définis comme des erreurs d’échantillonnage). Des études montrent à présent que les erreurs d’échantillonnage n’ont pas nécessairement une cause humaine, mais qu’elles sont plus spécifiquement associées aux limites de la technique manuelle de prélèvement.
Les origines de la technologie ThinPrep remontent à une époque où divers travaux de recherche visaient à développer un système quantitatif permettant d’analyser les frottis cervico-vaginaux. Au cours des années 1960, les ordinateurs ont permis la construction de systèmes d’analyse. Depuis le départ, les systèmes d’imagerie assistée par ordinateur étaient limités par le manque de cohérence des préparations manuelles. À l’évidence, les frottis cervicaux traditionnels étaient trop complexes pour permettre leur analyse par un système automatisé. De nombreuses recherches ont débouché sur le développement d’appareils destinés à des préparations lisibles par une machine. La première génération de systèmes de préparation automatisés a été conçue pour obtenir une population cellulaire unique sans groupe approprié à l’analyse par les ordinateurs primitifs. Divers moyens mécaniques ont été testés pour désagréger ces strates et groupes de cellules. Des raclages cervicaux recueillis dans une solution ont été soumis à une vigoureuse action mécanique. Les appareils de préparation les plus performants utilisaient une seringue à grande aiguille pour pomper l’échantillon de cellules et obtenir une seule population de cellules. Ces appareils ont réussi à présenter à l’ordinateur des préparations cellulaires simplifiées. Malheureusement, les pertes cellulaires et la destruction de l’architecture cellulaire accompagnant la mono-dispersion compromettaient l’interprétation humaine. Des travaux menés aux Pays-Bas ont résolu certains des problèmes associés à l’utilisation de la seringue. Ils ont intégré à l’étape de dispersion un cylindre tournant à vitesse élevée dans la suspension cellulaire. L’idée était simple : la rotation du cylindre dans le flacon permettait d’obtenir des forces de cisaillement semblables à l’action de la seringue. Le degré de dispersion pouvait être manipulé grâce au contrôle de la vitesse du cylindre de dispersion. Les processeurs ThinPrep actuels emploient la technique de dispersion par cylindre en appliquant une vitesse de dispersion nettement inférieure pour préserver l’intégrité des liaisons cellulaires naturelles. En outre, des modifications ont été apportées à la solution de recueil pour optimiser encore davantage la préparation des échantillons.
Parallèlement à l’étape de dispersion, une méthode de filtration était également en cours de développement. La qualité des échantillons pouvait encore être améliorée en limitant les éléments non diagnostiques de fond. Il fallait faire attention à ne perdre aucune information essentielle présente dans le prélèvement d’origine. Une membrane de filtration en plastique a été choisie pour concentrer le matériel cellulaire provenant de la suspension liquide et limiter ces artefacts par filtration simple. Le processus utilisé pour produire ces filtres a donné lieu à une distribution aléatoire de pores de taille uniforme.
L’appareil de préparation exigeait une étape supplémentaire pour déposer les cellules en suspension sur une lame de verre. De nombreuses techniques ont été étudiées pour optimiser cette étape afin que l’échantillon puisse faire l’objet d’une analyse humaine et informatique. L’utilisation de la membrane de filtration a permis le transfert des cellules sur la lame en appuyant le filtre et les cellules contre la lame pour obtenir une mince couche uniforme de cellules réparties de façon homogène et présentant une morphologie cellulaire familière.
La pénurie de cytotechnologistes et le nombre croissant de litiges ont expliqué le regain d’intérêt pour l’automatisation des frottis cervico-vaginaux. Le marché compte de nombreux instruments de dépistage informatique. Pourtant, malgré les avancées réalisées par la technologie, il manque toujours une méthode cohérente de préparation des lames. La technologie ThinPrep a permis d’aborder les limites associées à la préparation des lames, tandis que les études cliniques et non cliniques réalisées sur cette technologie ont amélioré la compréhension des limites des frottis.
RÉFÉRENCES :
- Linder J and Zahniser: ThinPrep Papanicolaou testing to reduce false-negative cervical
ÉVALUATION MICROSCOPIQUE DES LAMES THINPREP®
Deanna K. Iverson, MHS, SCT(ASCP), HTL
George Papanicolaou a developpé les critères morphologiques des frottis cervico-vaginaux conventionnels au début des années 1920. Graduellement, des modifications documentées ont été apportées sur la base de nombreuses études. On note peu de changements dans les critères morphologiques de base entre la méthode traditionnelle et le frottis ThinPrep. Les seules différences microscopiques sont généralement associées à la méthode de recueil en milieu liquide utilisée par le système ThinPrep®. Il est important de noter que l’architecture tissulaire n’est pas altérée pendant le traitement par l’instrument et que la morphologie cellulaire classique est utilisée pour l’interprétation. Les similitudes morphologiques de la méthode ThinPrep et des frottis conventionnels l’emportent largement sur les différences. La morphologie conventionnelle est en outre facilement transposable. Voici un résumé des principales caractéristiques morphologiques des frottis ThinPrep et des méthodes permettant de mieux détecter les anomalies. Cliquez pour agrandir l´image.
A l’instar des frottis conventionnels, l’examen des lames ThinPrep doit être réalisé selon un modèle lent systématique et en superposant les champs microscopiques. Sur la lame ThinPrep, le contour circulaire du dépôt de cellules peut servir de point de référence. Avant l’évaluation systématique de la lame à faible grossissement (10x), il peut s’avérer intéressant d’effectuer un examen rapide de la lame avec l’objectif de balayage (4x) pour évaluer la composition cellulaire, identifier le composant endocervical et évaluer la qualité technique de la préparation.
Les cytotechnologistes et pathologistes expérimentés peuvent facilement identifier les différents types de cellules sur les lames ThinPrep. Le cytologiste rencontrera toujours des cas biologiquement complexes qui nécessitent un examen attentif. Des évaluations quantitatives de la cellularité (populations normales et anormales) similaires aux méthodes conventionnelles peuvent toujours être effectuées. En revanche, avec les lames ThinPrep, la quantité de cellules anormales est moins importante que leur présence ou absence définitive.
Les caractéristiques uniques des lames ThinPrep incluent l’uniformité des préparations cellulaires, la fixation liquide, la taille des cellules, la morphologie du frottis et le fond de l’échantillon.
Uniformité des préparations cellulaires :
- Concentration
- Répartition homogène
- Zone circulaire de 20 mm
Comme le matériel cellulaire a été recueilli dans une solution puis filtré, la présentation de l’échantillon sur les lames ThinPrep diffère quelque peu de celle des frottis conventionnels. En effet, ces derniers présentent des zones épaisses et fines, des artefacts de séchage à l’air et souvent une déformation mécanique du matériel cellulaire. Sur les lames ThinPrep, le matériel cellulaire est concentré et réparti de façon homogène dans une zone circulaire de 20 mm. Les strates de l’épithélium sont visibles, mais les cellules sont moins superposées.
Fixation liquide :
- Cellules regroupées dans la solution
- Détail cytoplasmique amélioré
- Solution de recueil à base de méthanol
- Détail nucléaire amélioré
- Chromasie variable
Fixation liquide : Une caractéristique unique des lames ThinPrep réside dans le fait que le matériel cellulaire est recueilli et placé dans une solution de fixation en milieu liquide. La morphologie cellulaire de ces lames est similaire aux échantillons non gynécologiques car les cellules ont tendance à se regrouper dans la solution. En revanche, les divers types de cellules sont faciles à distinguer sur les lames ThinPrep. Les cellules endocervicales peuvent apparaître en 3D et être confondues avec des cellules endométriales. À fort grossissement, la configuration en palissade des cellules endocervicales peut souvent être observée à la périphérie des groupes de cellules.
La solution de fixation en milieu liquide pour frottis ThinPrep contient du méthanol, alcool qui améliore la conservation des cellules et la morphologie cellulaire. L’amélioration des détails cytoplasmiques permet de mieux déterminer l’origine des cellules et l’étape de maturation. La morphologie nucléaire améliorée résulte principalement de la fixation liquide. Il faut veiller à ne pas sur-interpréter les noyaux bien préservés lors de l’évaluation des lames ThinPrep. L’amélioration nucléaire observée sur les lames ThinPrep est similaire à celle observée sur des frottis conventionnels qui ont été fixés dans un liquide composé d’éthanol à 95 %.
L’hyperchromasie nucléaire généralement associée aux lésions malpighiennes pouvant être réduite sur les lames ThinPrep, il peut ne pas s’agir d’un indicateur fiable. La présence d’hyperchromasie doit être prise en compte, mais son absence ne doit pas servir à écarter la possibilité d’anomalies nucléaires. En l’absence d’hyperchromasie, l’interprétation précise des lésions de haut grade peut être particulièrement difficile sur les lames ThinPrep, car elle dépend des variations de taille et forme nucléaires, critères morphologiques souvent négligés ou sous-estimés dans les frottis conventionnels.
Taille des cellules :
- Proportionnellement plus petites
- Cellules isolées plus évidentes
Taille des cellules : En raison de la fixation liquide, les cellules peuvent paraître proportionnellement plus petites dans les préparations ThinPrep. Une cellule intermédiaire bien conservée constitue une référence utile pour déterminer la taille des cellules et des noyaux, en particulier lors de l’évaluation de petites cellules immatures de type métaplasique. L’examen de ces cellules à fort grossissement est essentiel à l’évaluation précise du noyau en vue de détecter une atypie nucléaire, plus particulièrement en l’absence d’hyperchromasie.
Les cellules isolées sont dispersées et font partie d’un “sous-échantillon randomisé”, caractéristique du système ThinPrep. Comme le sang et l’inflammation ne recouvrent pas ces cellules, le nombre de cellules isolées est plus important dans la préparation que sur un frottis conventionnel.
Morphologie du frottis :
- Aspect “frottis” éliminé
- Fond altéré
Morphologie du frottis : En général, l’architecture cellulaire et le fond contextuel des lames ThinPrep sont similaires à ceux observés sur des frottis conventionnels bien conservés. Sur les lames ThinPrep, le matériel cellulaire est uniforme et réparti de façon homogène. L’architecture tissulaire est conservée (strates et syncytium) et la déformation mécanique réduite de façon significative.
Fond : Contrairement aux frottis conventionnels, le fond des lames ThinPrep est généralement propre. Il est donc plus facile d’identifier les populations cellulaires normales et anormales. On note la présence de sang, de mucus, d’inflammation et de diathèse sur les lames ThinPrep. Néanmoins, en raison de la différence de méthode de recueil et de préparation, ces entités ont un aspect légèrement différent de celui des frottis conventionnels. Cette présence masque rarement les cellules sur les lames ThinPrep, sauf s’il s’agit du principal produit prélevé sur la patiente. Le sang frais est lysé par l’agent hémolytique dans le liquide, rendant ainsi les hématies moins colorées (cellules “fantômes”). En raison de sa lyse incomplète, le sang vieilli présente une coloration rouge variable. La possibilité de différencier le sang frais du sang vieilli peut s’avérer utile pour détecter un processus malin.
Réparti de façon plus homogène sur les lames ThinPrep, le matériel inflammatoire est souvent accroché aux cellules épithéliales. Le fond peut occasionnellement prendre un aspect “négligé”. Le matériel présent sur la lame semble sale et en lambeaux ; il contient en outre peu de cellules épithéliales malpighiennes bien conservées. Avec ce type de fond, il est important de prendre en compte les éléments suivants : la présence d’un agent infectieux, de cytolyse et/ou de pathologie maligne (diathèse tumorale). Sur les lames ThinPrep, la diathèse tumorale (cellules inflammatoires, hématies, fibrine, débris cellulaires nécrotiques et matériel protéinacé granulaire) peut être observée dans le fond de la préparation, autour des ou sur les cellules épithéliales (diathèse “accrochée”).