Citología de aspiración con aguja fina
Introducción
David B. Kaminsky, MD, FIAC

El mundo de la citopatología se definió con la llegada del screening del cáncer cervical concebido y promovido por el Dr. George Papanicolaou, y se revolucionó con la llegada de la biopsia por aspiración con aguja fina y de la citología en base líquida. La unión de ambas proporciona una potente herramienta de diagnóstico que facilita los estudios moleculares y auxiliares de enfermedades oncológicas e infecciosas. Ambas representan la vanguardia y la norma de la práctica médica. Juntas suponen el refuerzo de las bases de la citopatología moderna y resultan indispensables.
La biopsia por aspiración con aguja fina [BAAF] tiene sus orígenes en Estocolmo en el Karolinska y Radiumhemmet Hospital, en las manos de los pioneros doctores Franzen, Zajicek y Esposti, cuyo trabajo seminal, corroborado por los datos de biopsias, validó la afirmación de que los criterios de diagnóstico celular eran fiables para los patrones tisulares y que la sonda de aguja constituía una práctica herramienta diagnóstica que podía proporcionar información equivalente a la extraída del tejido de una forma mínimamente invasiva.
En la década de los 30, una escéptica sociedad médica norteamericana rechazó el intento de Martin por introducir una BAAF que hacía la competencia a las nuevas tecnologías, a las secciones congeladas y a la citología exfoliativa. Esta provocativa técnica encontró su camino en ciertos centros médicos universitarios en donde los patólogos aprendieron a interpretar los patrones celulares y en donde los médicos superaron su escepticismo y ambivalencia.
Bajo la influencia de patólogos especialistas como Koss y Frable, la biopsia por aspiración comenzó a florecer y la American Society of Cytopathology introdujo cursos de aprendizaje en su reunión científica anual. El Dr. Frable y yo mismo colaboramos en seminarios prácticos en los que se enseñaba la técnica de aspiración, los criterios a seguir y la correlación con los patrones histológicos, convenciendo a nuestros colegas de la precisión, eficacia y seguridad del procedimiento. Así, conseguimos que otros patólogos se entusiasmaran con la BAAF y, finalmente, se convirtió en un elemento aceptado en los programas de residencia, cursos de especialización y, eventualmente, en la práctica general. La colaboración con radiólogos intervencionistas aseguró su éxito final cuando la tomografía computerizada, la ultrasonografía y la fluoroscopia garantizaron un acceso visual controlado a las lesiones viscerales profundas con un riesgo aceptable y con óptimos resultados. Una sociedad informada con un gran problema de tumores y con una progresiva responsabilidad financiera por su gestión fue receptiva a un procedimiento preciso, rentable y mínimamente invasivo que era adaptable a un entorno de pacientes ambulatorios y que favoreció su participación en la elección y la conveniente implementación de la terapia. La técnica se adecuaba perfectamente a los intentos de mejora de la calidad, ya que ofrecía un esfuerzo orientado a los resultados y basado en datos medibles. La introducción de la citología en base líquida proporcionó una nueva dimensión: la aguja podía lavarse en el fluido de recogida para crear una reserva de células, para preservar y mantener la integridad de la muestra y para aumentar el análisis citológico y las técnicas auxiliares.

La biopsia por aspiración con aguja fina se ha ganado su reconocimiento como protagonista esencial irrevocable en el cuidado de los pacientes y como mediador en las relaciones entre los profesionales de citopatología, los médicos, los radiólogos intervencionistas y las compañías médicas privadas. Constituye el puente desde la estructura citológica hasta la anatomía tisular, la inmunocitoquímica, la citometría de flujo, el cultivo, el diagnóstico molecular, la terapia dirigida y la correlación clínica. Tiene sentido desde un punto de vista financiero, al ofrecer bajos riesgos y resultados factibles. Tiene carácter, personalidad y una vida propia.
Indicaciones:
La presencia de una masa palpable en la superficie de un cuerpo, o de una lesión inexplicable detectada por imagen radiográfica, son señales indicativas de que hay que realizar una biopsia por aspiración con aguja fina bajo visualización directa o guiada por imagen. Más específicamente, esta técnica se emplea para:
- Proporcionar una modalidad diagnóstica fiable, conveniente y rentable
- Diferenciar las enfermedades benignas de las malignas con una invasión mínima
- Eliminar el juicio clínico de no-resección
- Confirmar una enfermedad metastásica
- Obtener información equivalente a la extraída del tejido en pacientes con restricciones médicas
- Selección de la composición celular: asignación de radiación, quimioterapia, inmunoterapia, cirugía o vigilancia
- Adquirir el material necesario para llevar a cabo el cultivo, la microscopía electrónica, la citometría de flujo, la inmunocitoquímica, el análisis de ADN por imagen y las sondas de ADN
Contraindicaciones:
La realización de biopsias por aspiración con aguja fina presenta escasas contraindicaciones en la práctica clínica, y entre ellas se encuentran la diátesis hemorrágica, la terapia anticoagulante, las malformaciones arteriovenosas y la enfermedad quística hidatídica. Si el objetivo a aspirar es el tórax, existen contraindicaciones adicionales entre las que se encuentran la hipertensión pulmonar, la tos incontrolada, el enfisema avanzado y la incapacidad del paciente para cooperar a la hora de mantener la respiración.
Complicaciones:
La biopsia por aspiración de masas palpables bajo visualización directa puede complicarse con sangrados menores [controlados mediante presión] y, raramente, con infección. Si se utiliza la técnica antiséptica apropiada, la infección es sumamente rara. Entre las complicaciones asociadas a las biopsias por aspiración guiadas por imagen se encuentran la hemorragia, infección y traslocación de las células tumorales [suceso raro], mientras que las sondas torácicas podrían producir neumotórax, embolismo aéreo y enfisema subcutáneo.
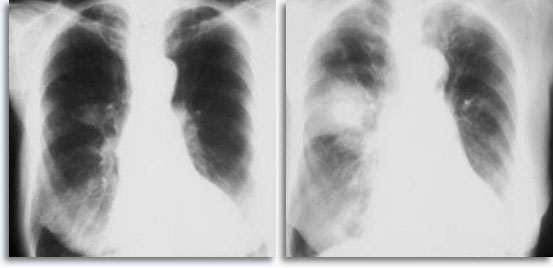
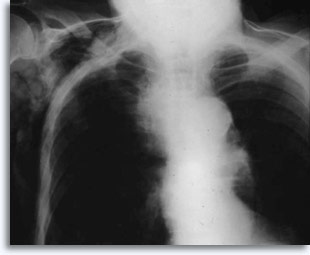
Con los aspirados pulmonares percutáneos transtorácicos como punto de referencia, se espera hemorragia si la aguja atraviesa la pleura y entra en el parénquima pulmonar, y suele ser visible como un aumento del objetivo en las películas torácicas post-punción .
|
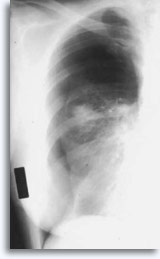
Ocasionalmente, se asocia a la hemoptisis autolimitada como una expresión clínica de filtración intraparenquimal. El neumotórax es un acompañante esperado en la biopsia transtorácica por aspiración, ya que la aguja invade la pleura en el camino hacia su objetivo parenquimal produciendo un cierto grado de colapso pulmonar; se trata de un neumotórax sintomático que se considera como una complicación que suele requerir la inserción de un tubo torácico para conseguir el reinflado pulmonar.
 |
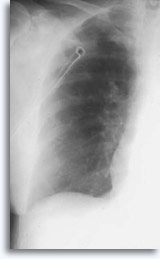 |
Los factores que influyen en la ocurrencia del neumotórax sintomático incluyen la edad del paciente, el tamaño, localización y profundidad de la lesión, el número de punciones, la presencia de enfisema, la intensidad del examen con las películas post-procedimiento y la experiencia de la persona que realiza la aspiración.
El embolismo aéreo se evita si el radiólogo utiliza una llave de tres vías o si es concienzudo a la hora de evitar que entre aire en la aguja durante el corto intervalo de tiempo que queda entre la retirada del estilete y la conexión de la jeringa. El enfisema subcutáneo se puede producir cuando el aire se filtra a través del tejido blando causando una sufusión crepitante que es autolimitada.
 |
En estudios exhaustivos realizados en un gran número de pacientes en los que se realizó una biopsia por aspiración en el Karolinska Institute, la traslocación de células malignas a través del tracto de la aguja fue un suceso raro y anecdótico que representó aproximadamente un caso entre varios miles, normalmente asociado a un tumor altamente maligno que está previsto que se difunda espontáneamente.
La mayor parte de las muertes se deben al uso de agujas cortantes en lugar de agujas finas y se trata de sucesos realmente raros con agujas de calibre 22. Las muertes pulmonares se deben a una hemorragia endobronquial provocada por las agujas cortantes.
La técnica de BAAF superficial bajo visualización directa:
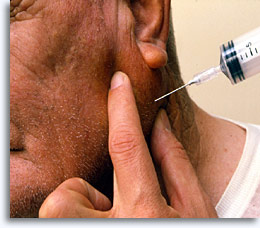
La biopsia por aspiración con aguja fina es un método seguro y eficaz de obtención de células para la evaluación citológica diagnóstica de masas superficiales palpables procedentes de mama, tiroides, glándulas salivares, nódulos linfáticos, quistes y tumores metastáticos, en la que se utiliza una jeringa de 20 cc, una aguja de calibre 22 y soporte opcional para la jeringa [“pistola”].
 |
 |
La preparación del paciente es mínima, y consiste en la explicación del procedimiento; declaración de sus complicaciones con enumeración de los efectos secundarios, limitaciones y resultados esperados; anotación del historial incluyendo las alergias, terapia anticoagulante o tendencia al sangrado; obtención de la firma de consentimiento informado; cumplimiento de todas las normas HIPAA (Ley de transferibilidad y responsabilidad de seguros médicos) y consideraciones éticas, incluyendo la presencia de un ayudante si el paciente es una mujer; examen físico de la zona y asegurar la antisepsia. La utilización de anestesia local es opcional.
Tras la palpación y el tratamiento antiséptico, se inserta la aguja en la zona objetivo, se vacía el émbolo para crear una presión negativa mientras se hace oscilar la aguja varias veces en diferentes direcciones, y se reequilibran las presiones antes de retirar la aguja del paciente. El procedimiento finaliza cuando la persona que realiza la aspiración determina que la penetración es la adecuada o cuando aparece material en el cono de la jeringa. A continuación, se retira la jeringa de la aguja y se rellena con aire para que sirva de fuerza expresiva cuando se vuelva a conectar a la aguja. La jeringa puede sostenerse manualmente o mediante un soporte de jeringa.
Las células obtenidas de la aspiración se extienden sobre portaobjetos etiquetados mediante la colocación de la aguja, con el lado biselado hacia abajo, en contacto con el vidrio, y se extiende una gotita. Utilizando un segundo portaobjetos, se dispersa la gotita mediante tensión superficial para formar una monocapa circular. Los portaobjetos se separan de forma rápida y perpendicular para evitar el extendido, y se sumergen inmediatamente en etanol al 95%. El artefacto de secado al aire debe evitarse a menos que se desee secar al aire los portaobjetos de forma intencionada para realizar tinciones de Romanowsky. La aguja ya puede lavarse en solución salina o en el vial de cytolyt. A partir de material sólido se puede preparar un bloque celular.
 |
Si se aspira un nódulo linfático, se pueden realizar “pases” adicionales para obtener portaobjetos para tinción de Diff Quick y muestras para medios de transporte RPMI para citometría de flujo. Por último, se realiza un diagnóstico preliminar, que se comunica al médico correspondiente y se documenta.
La técnica de BAAF guiada por imagen de lesiones profundas.
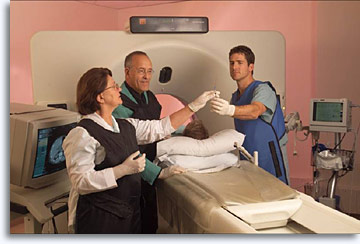
A las lesiones profundas no palpables se puede acceder guiando la aguja de calibre 22 a lo largo de su trayectoria hasta su objetivo por medio de ultrasonido, fluoroscopia o tomografía computerizada. Normalmente, es el radiólogo intervencionista el que realiza la punción en colaboración con el profesional citopatólogo responsable de determinar la adecuación de la muestra, de proporcionar un diagnóstico inmediato cuando sea posible, y de decidir si se requieren técnicas adicionales para asegurar el óptimo procesado y evaluación de la muestra. La presencia de un citopatólogo durante el proceso garantiza la adecuación de la muestra, aumenta estadística y significativamente la precisión del diagnóstico, reduce el número de “pases” y los neumotórax secundarios en los aspirados torácicos, y ofrece decisiones de selección inmediatas. El radiólogo orienta al paciente durante el procedimiento, planifica la trayectoria, administra la anestesia local, coloca la aguja, recoge la muestra y suministra la terapia adecuada a las complicaciones. El beneficio para el radiólogo es asegurarse de que la toma de muestra es óptima y su procesado es el adecuado, mientras que el beneficio para el citopatólogo es comprender mejor el problema clínico y las relaciones anatómicas de las lesiones sometidas a biopsia. El cirujano puede planificar el enfoque operativo y mejorar la estrategia de planificación del tiempo de quirófano y la gestión administrativa. El paciente se beneficia de un enfoque de colaboración en equipo.
 |
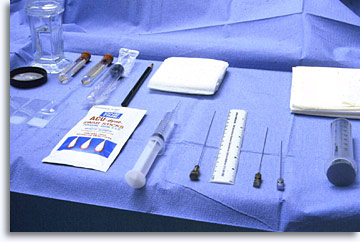
Los materiales y reactivos de una bandeja de BAAF deben incluir una solución antiséptica, xilocaína al 1% con agujas/jeringas para su inyección, jeringas de 20 cc, agujas epidurales flexibles de calibre 22 con estiletes, soporte óptimo para la jeringa, gasas estériles, portaobjetos transparentes, etanol al 95%, solución salina fisiológica, tubos de ensayo estériles y vacíos con tapón, viales con cytolyt, botella con formalina al 10%.
 |
Tras la explicación del procedimiento, tal y como se ha descrito antes para los aspirados obtenidos bajo visualización directa de las lesiones palpables, incluyendo la obtención de la firma de consentimiento informado, el radiólogo determina la posición de la lesión y planifica la trayectoria utilizando la modalidad de imagen seleccionada. Para los aspirados del tiroides, el método del ultrasonido es más adecuado para guiar la aguja en tiempo real y para determinar la posición de la punta de la aguja en la zona objetivo. Así, se puede obtener un documento, todavía fotográfico, que permite comprobar que la punta de la aguja se encuentra en la posición adecuada.
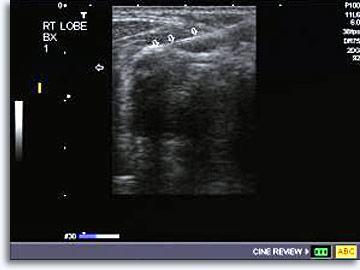 |
En las lesiones pulmonares y abdominales, se emplea frecuentemente la tomografía computerizada para guiar la aguja de forma precisa hasta la posición exacta y para documentar la fuente celular de la zona objetivo deseada.
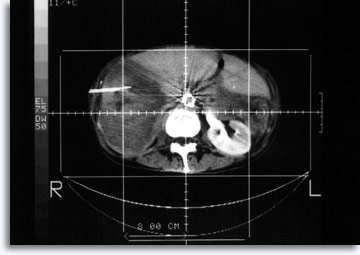 |
La fluoroscopia es la modalidad menos utilizada para las lesiones pulmonares, debido a los avances en imágenes de tomografía computerizada y a la rapidez de generación de imágenes, que ha facilitado la eficacia de la aspiración. A continuación se describe una BAAF convencional guiada fluoroscópicamente con la aguja en la zona objetivo:
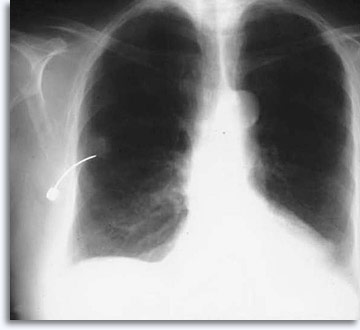 |
Tras completar la toma de imágenes de referencia, se limpia al paciente con una solución antiséptica y se cubre para crear un campo estéril. Se inyecta la anestesia local y, a continuación, se introduce la aguja epidural flexible de calibre 22, con el estilete colocado, en la lesión [torácica o abdominal] a través de la piel hasta una profundidad preestimada, o se coloca la aguja de calibre 22, unida a una jeringa de 20 cc, dentro de la zona objetivo bajo control ultrasonográfico. Se comprueba la posición de la punta de la aguja. Se si usa un estilete, se retira. A continuación, se une la jeringa a la aguja y se vacía el émbolo mientras se hace oscilar la aguja varias veces en diferentes planos. Tras equilibrar las presiones, se retira la aguja del paciente. Se desconecta entonces la aguja de la jeringa, se introduce aire en la jeringa y se vuelve a conectar a la aguja. El material es extendido sobre los portaobjetos, dispersado y sumergido inmediatamente en etanol al 95%. A continuación, la aguja se lava en solución salina, en el vial de cytolyt o en el medio RPMI. En general, en las lesiones torácico-abdominales y en los nódulos linfáticos, se retiene al paciente mientras se tiñen los portaobjetos y se interpreta su adecuación, selección y diagnóstico. Las lesiones tiroideas suelen someterse a tres “pases” por zona objetivo con el material teñido y evaluado tras la conclusión del proceso ultrasónico.
 |
Tipos de muestras adquiridas mediante biopsia por aspiración con aguja fina
Con una aguja de calibre 22 se puede acceder a todos y cada uno de los puntos del cuerpo para tomar una muestra, incluyendo lugares poco comunes como el cerebro, la órbita ocular, los testículos o el pene. El enfoque se modifica en función del punto del cuerpo, pero la técnica sigue siendo consistente. En teoría, la BAAF de cualquier tumor suministra material que contiene células que reflejan los patrones histoestructurales clasificables como carcinoma, sarcoma, linfoma, melanoma y malignidad no diferenciada.
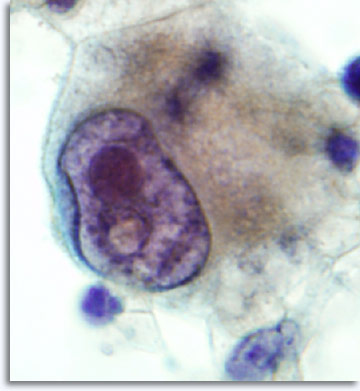
|
Si el reconocimiento del patrón no permite realizar un diagnóstico específico y una categorización de forma inmediata, existen técnicas auxiliares como la inmunocitoquímica que pueden proporcionar información molecular que ayude a la clasificación. En los procesos infecciosos, es posible aislar agentes etiológicos específicos de infección demostrable con tinción de Papanicolaou, tinciones de Giemsa para bacterias, tinciones de AFB para bacilos ácidorresistentes y tinciones de PAS y GMS para hongos.
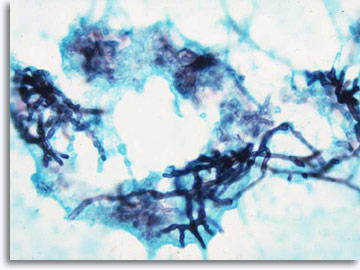
|
La presentación de la muestra puede variar ligeramente dependiendo de si las células se han colocado directamente sobre los portaobjetos o de si han sido procesadas mediante tecnología ThinPrep® en base líquida. El extendido directo contendrá restos y sangre en el fondo; los núcleos de las células malignas aparecerán, en general, más hipercromáticos y densos. Con ThinPrep se preserva la agregación celular, la sangre del fondo está alisada y los núcleos de las células malignas pueden aparecer menos densos e hipercromáticos. Una excepción a esto puede producirse con la vesiculación en cristal esmerilado característica del carcinoma papilar del tiroides, en el que los cambios ópticos de los núcleos son similares en las presentaciones convencionales y en las de base líquida.
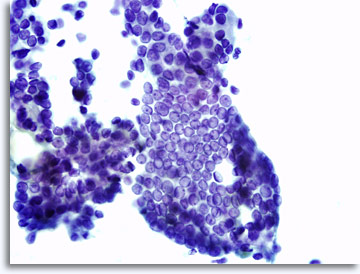 |
Extendido directo
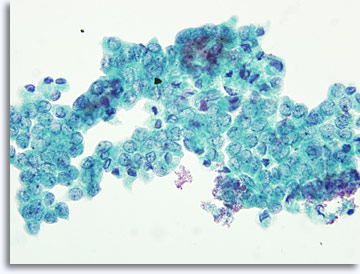 |
ThinPrep®
El concepto de adecuación de la muestra está siendo utilizado por la Sociedad Americana de Citopatología (ASC) y por la Papanicolaou Society a través de las Directrices PAAF para órganos específicos. Las directrices PAAF para mama están siendo desarrolladas por la ASC, y la Papanicolaou Society ha proporcionado las directrices específicas de los órganos para tiroides y pulmón. Existe una cierta subjetividad en cuanto a la adecuación de las muestras sin que se produzca una estandarización definitiva, que varía en función de la experiencia de los intérpretes. Hologic, Inc. está adquiriendo experiencia para determinar qué constituye la adecuación de las muestras recogidas y procesadas mediante la tecnología de base líquida. Hologic se refiere a ejemplos de insatisfactorio cuando existe sangre únicamente, fibrina sin epitelio del contenido de los quistes, inflamación únicamente o coloide de tiroides sin células. La realización de una rápida interpretación en el momento de la biopsia por aspiración proporcionará una evaluación inmediata de la adecuación y acelerará la gestión clínica si se puede realizar un diagnóstico definitivo.
Consideraciones financieras
Cuando se lleva a cabo una comparación de costes de la BAAF y de la biopsia convencional, se observa claramente un espectacular ahorro inmediato, especialmente cuando la BAAF se realiza en el ámbito ambulatorio. El control efectivo de los costes en el suministro de cuidados médicos depende de la productividad y, en este contexto, la aspiración con aguja gana la partida La obtención de células mediante una técnica relativamente barata que elude la hospitalización y selecciona a los pacientes para protocolos terapéuticos no quirúrgicos, incluyendo la terapia dirigida, mejora la situación financiera y permite un acceso inmediato a los cuidados sanitarios en un sistema sanitario saturado. Desde el punto de vista de los hospitales, los recursos de los quirófanos pueden gestionarse de forma más eficaz, liberando al sistema para que pueda realizar las cirugías no basadas en biopsias que, en otro caso, serían aplazadas, transferidas o, en algunos casos, nunca realizadas. En los hospitales públicos en donde las camas son limitadas, el hecho de que los pacientes de las biopsias no ocupen las camas prequirúrgicas libera espacio para aquellos pacientes que, clínicamente, requieren hospitalización. La BAAF libera a los cirujanos, anestesistas, enfermeras, técnicos y patólogos para que prosigan con sus responsabilidades analíticas y terapéuticas post-biopsias. Al reducir la carga de trabajo de los técnicos, se pueden mantener los niveles de personal sin sacrificar la calidad del servicio a los pacientes.
Medicare y otras compañías médicas privadas reembolsan los componentes técnicos y profesionales empleados en la realización del aspirado, en la evaluación inmediata de la adecuación y diagnóstico de la muestra, en la interpretación del aspirado, en el examen de las preparaciones de accesorios como el procesado ThinPrep® y los bloques celulares y en el número de marcadores específicos para inmunocitoquímica y citometría de flujo. Aunque los “pases” múltiples en un único sitio, como en el caso del nódulo unilateral de tiroides, se reembolsan como un todo, las BAAF de diferentes sitios, como los nódulos bilaterales del tiroides, se reembolsan de acuerdo al número de puntos de acceso diferentes. A continuación se enumeran los códigos CPT para facilitar la facturación:
| Código CPT | Descripción |
| 10021 | BAAF sin guía por imagen |
| 88172 | BAAF con evaluación inmediata de la adecuación/td> |
| 88173 | BAAF con interpretación e informe |
| 88305 | Bloque celular |
| 88173 | ThinPrep, Cytospin |
| 88180 | Citometría de flujo |
| 87070 | Cultivo de rutina |
| 88305 | Biopsia con trocar |
| 87102 | Cultivo para bacilos ácidorresistentes |
| 87116 | Cultivo para hongos |
| 88342 | Inmunocitoquímica |
| 88312 | Tinciones especiales |
Observaciones finales:
Tenemos el privilegio de practicar la citopatología en una era moderna de logros médicos que relacionan la morfología celular con la microanatomía, el diagnóstico molecular y la gestión clínica de calidad. La citología continúa siendo la fuerza conductora del screening y del diagnóstico del cáncer, de su clasificación y de la mejora en los resultados. La biopsia por aspiración con aguja fina es una herramienta única que proporciona información diagnóstica segura, mínimamente invasiva, inmediata, precisa, que mantiene los costes y que es equivalente a la extraída del tejido con un bajo riesgo de complicaciones y con una satisfacción universal del paciente. Se trata de una técnica complementaria a la imagen radiográfica que permite explorar el cuerpo humano y realizar investigaciones sobre el diagnóstico molecular, la genética y la terapia dirigida. Su aplicación a la citología en base líquida mantiene el compromiso de una diversidad y precisión aún mayores.
