肝または膵の穿刺吸引(FNA)生検は、多くの医療施設で頻繁に実施されている手技です。肝または膵は通常、腫瘤性病変の評価に穿刺吸引生検が適応とされます。以前は、肝腫瘤の評価にコア針生検が用いられることの方が多かったのですが、現在では大半の病院でFNA生検が標準の手技となりました。ただし膵については、コア針生検の実施によって膵炎を合併するおそれがあるため、FNAの方がよく用いられます。肝ないし膵に対してFNA生検を実施する利点として、1回の実施によって多くの吸引組織を得ることができ、腫瘤の標本採取がほぼ完全に達成することができる点が挙げられます。
肝細胞癌の吸引組織をThinPrep法によって処置すると、辺縁境界部位が明瞭で、複雑に分岐、接着し肥厚した柵状組織が認められ、N/C比が均一に高いことがわかります。柵状組織には厚さによって4種類以上の細胞があり、周辺には「逸脱した」内皮細胞とも呼ばれる内皮細胞がみられます。細胞が孤立性に散在していることもあれば、小さな集塊となって認められることも多く、異型性を示す裸核がみられます。時に、胆汁色素が認められることがあります [1、2、6、7、8、9、10、11、12、13] .
場合によっては、線維性肝細胞癌、小細胞癌および明細胞癌のサブタイプ、肝細胞癌/胆管癌の混在型など、肝細胞癌の変異型が認められることがあります。こうした変異型については、細胞の特徴が標準の教本などに詳細に記載されています[1、2] 。
穿刺吸引標本から異型性所見が得られなかったことを理由に、腺腫または限局性結節性過形成の特異的診断を下すことはできません。このため、細胞学的所見と穿刺針を刺入した位置との相互関係を考慮することが重要です。
最後に、肝は腹部で転移性悪性腫瘍が好発する部位としてはリンパ節に次いで2位であるため、転移性癌の肝穿刺吸引が実施される頻度はきわめて高いです。悪性肝腫瘍全体の90%以上を転移性癌が占めています。肝に波及する転移性癌にみる主要な組織型は、多岐にわたる部位から転移した腺癌であり、結腸直腸癌は特に発生率が高いです。転移性腺癌の細胞形態の特徴は、原発性胆管癌の細胞にみる特徴にきわめて近いです。腺癌のFNA標本には通常、悪性の細胞が凝集して認められ、腺形成をみることがあります。細胞の形状は立方状から円柱状で、細胞質がきめ細かく淡色を呈し、明瞭な核小体を有して偏在する核は、円形のものもあれば不整を呈するものもあります。胆管癌の背景は清浄であるのに対して、結腸直腸癌の背景には「汚い壊死背景」が認められることが多いです。このほか、転移性小細胞癌、黒色腫、悪性リンパ腫および間葉腫瘍など、別の細胞型の癌が認められることがあります[1, 2] 。
仮性膵嚢胞の吸引組織は一般に、細胞性が乏しく上皮細胞がほとんどまたはまったく認められませんが、急性ならびに慢性炎症細胞、組織球、肉芽組織が認められるほか、石灰化病変を伴う壊死組織片の背景が認められます[1, 2]。急性膵炎の細胞学的特徴として、中等度から高度の細胞性が挙げられ、塗抹標本には大量の好中球が認められるとともに、「汚い」背景がみられます[1、2] 。胆管上皮細胞や膵腺房細胞に修復過程を経た異型や炎症性の異型がみられることがあり、脂肪壊死が確認されることがあります。これに対して、慢性膵炎の吸引組織は一般に、細胞の濃度が比較的低く、膵管細胞に急性膵炎ほどの異型や反応性特徴を呈する可能性は低いといえます[1、2] 。慢性炎症を来している細胞が認められることがあります。
膵腺癌の異型としてまれなものには、巨細胞や紡錐形の悪性腫瘍など、多形性の細胞集団が著しく認められる未分化癌(多形性の巨細胞癌)が挙げられます。これはきわめてまれな骨破壊様の膵巨細胞腫瘍であり、核とある程度の量の周辺細胞質が中心に集塊を形成し、骨破壊様の多核巨細胞が散在性に認められるほか、ほぼ同じ様相を呈する単核細胞が存在する腫瘍です[1、2]
膵島細胞腫瘍の吸引組織が細胞性を呈する傾向があり、均一の小細胞が単形の細胞集団として、凝集を来すことなく配列していることが多いです。この腫瘍細胞は小型で、円形から卵円形の核が均等に散在し、微粒から粗大の顆粒状クロマチンのほか、よく見ると核小体が認められます。核は細胞内に偏在性に認められます。これに対して、きわめてまれな膵腺房細胞癌の吸引組織は、細胞が小葉状に配列し、集塊を形成したクロマチンおよび明瞭な核小体とともに、過染性の核が認められます[1、2] 。膵島細胞および膵腺房細胞はいずれも、細胞質が顆粒状を呈します。嚢胞性の乳頭腫瘍にみる細胞形態の特徴としては、淡色のクロマチンとともに1層以上の上皮細胞が配列し、中心が線維血管性を呈する乳頭構造、薄い核膜が挙げられ、時に核の縦溝が認められます[1、2] 。一方、粘液性嚢胞性腫瘍の核は、特に特徴がないものもあれば、異型性を示すもの、いわゆる悪性腫瘍といえるものもあり、多岐にわたります[1、2] 。この細胞は平坦な蜂巣状か、立体的集塊として配列し、細胞内や細胞外に大量の粘液性物質が認められることがあります。このほか、FNAに関する文献に記載されているまれな病変には、漿液性嚢胞腺腫および膵芽腫があります [1、2、20]。最後に、膵への転移性癌のFNAについて説明します [21] 。
注:画像をクリックすると拡大します。
– 肝 –
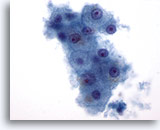
画像 1: 肝FNA – 良性肝細胞 良性肝細胞の小さな集塊。細胞は多角形のものもあれば円形のものもみられ、細胞境界は明瞭です。 核は中心性に位置し、周辺の細胞質は顆粒状を呈しています。細胞質内に色素沈着がみられます。小型の核小体がみられるものの、異型性および高N/C比は認められません。
60倍
画像 1
肝FNA – 良性肝細胞
良性肝細胞の小さな集塊。細胞は多角形のものもあれば円形のものもみられ、細胞境界は明瞭です。 核は中心性に位置し、周辺の細胞質は顆粒状を呈しています。細胞質内に色素沈着がみられます。小型の核小体がみられるものの、異型性および高N/C比は認められません。
60倍
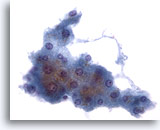
画像 2: 肝FNA – 良性肝細胞
反応性変化を来した良性肝細胞の集塊。細胞境界が明瞭な立方形の細胞が認められます。不透明な細胞質には空胞が認められるものもあれば、幾分顆粒状を呈するものもみられます。辺縁部は擦り切れた状態を呈しています。核はわずかに大小不同で、二核を有する細胞も認められます。小型の核小体がみられます。
40倍
画像 2
肝FNA – 良性肝細胞
反応性変化を来した良性肝細胞の集塊。細胞境界が明瞭な立方形の細胞が認められます。不透明な細胞質には空胞が認められるものもあれば、幾分顆粒状を呈するものもみられます。辺縁部は擦り切れた状態を呈しています。核はわずかに大小不同で、二核を有する細胞も認められます。小型の核小体がみられます。
40倍
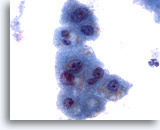
画像 3
肝FNA – 良性肝細胞
核はわずかに大小不同であり、反応性変化を来した肝細胞に典型的な低N/C比を示します。微小な細胞質空胞および細胞質内色素がみられます。
60倍
画像 3
肝FNA – 良性肝細胞
核はわずかに大小不同であり、反応性変化を来した肝細胞に典型的な低N/C比を示します。微小な細胞質空胞および細胞質内色素がみられます。
60倍
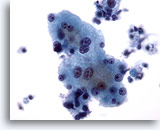
画像 4
肝FNA – 良性肝細胞
反応性変化を来した肝細胞。核は大小不同で、二核を有しています。
40倍
画像 4
肝FNA – 良性肝細胞
反応性変化を来した肝細胞。核は大小不同で、二核を有しています。
40倍
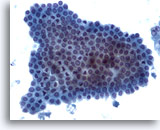
画像 5
肝FNA – 良性胆管細胞
良性胆管細胞の集塊。蜂巣状に配列し、均一な小型の核がみられます。
20倍
画像 5
肝FNA – 良性胆管細胞
良性胆管細胞の集塊。蜂巣状に配列し、均一な小型の核がみられます。
20倍
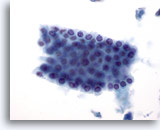
画像 6
肝FNA – 良性胆管細胞. 良性胆管上皮細胞群が蜂巣状に配列しています。細胞は立方形で、均等の間隔をおいて小型の核がみられます。胆管上皮細胞は肝細胞よりもN/C比が高く、細胞質は粒状性を欠き、空胞化や色素がみられます。
40倍
画像 6
肝FNA – 良性胆管細胞
良性胆管上皮細胞群が蜂巣状に配列しています。細胞は立方形で、均等の間隔をおいて小型の核がみられます。胆管上皮細胞は肝細胞よりもN/C比が高く、細胞質は粒状性を欠き、空胞化や色素がみられます。
40倍
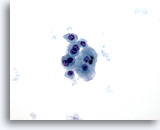
画像 7
肝FNA – 肝硬変
良性肝細胞の疎な結合を示す集塊。二核を有し、N/C比は低値を示しています。
40倍
画像 7
肝FNA – 肝硬変
良性肝細胞の疎な結合を示す集塊。二核を有し、N/C比は低値を示しています。
40倍
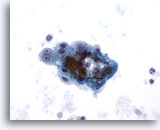
画像 8
肝FNA – 肝硬変
肝硬変結節にみる反応性変化を来した良性肝細胞の疎な結合を示す集塊。二核を有し明瞭な核小体がみられますが、N/C比は低値を示します。
40倍
画像 8
肝FNA – 肝硬変
肝硬変結節にみる反応性変化を来した良性肝細胞の疎な結合を示す集塊。二核を有し明瞭な核小体がみられますが、N/C比は低値を示します。
40倍
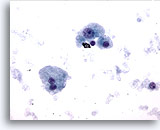
画像 9
肝FNA – 肝硬変
肝硬変結節の良性肝細胞。孤立性に散在しています。核の大小不同がみられますが、核形不整はみられません。二核性の肝細胞が認められ、N/C比は低値を示しています。
40倍
画像 9
肝FNA – 肝硬変
肝硬変結節の良性肝細胞。孤立性に散在しています。核の大小不同がみられますが、核形不整はみられません。二核性の肝細胞が認められ、N/C比は低値を示しています。
40倍
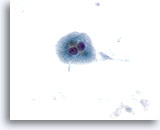
画像 10
肝FNA – 肝硬変
肝硬変結節の良性肝細胞。二核を有し孤立性に散在しています。
40倍
画像 10
肝FNA – 肝硬変
肝硬変結節の良性肝細胞。二核を有し孤立性に散在しています。
40倍
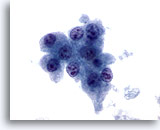
画像 11
肝FNA、肝細胞癌
肝細胞癌の肝細胞。均一に異型が認められ、N/C比が高く、核には不整な核小体が多数みられます。
60倍
画像 11
肝FNA、肝細胞癌
肝細胞癌の肝細胞。均一に異型が認められ、N/C比が高く、核には不整な核小体が多数みられます。
60倍
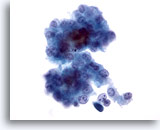
画像 12
肝FNA、肝細胞癌
肝細胞癌からの細胞。肝細胞癌の吸引組織にみる悪性肝細胞。疎性の集塊を形成しています。N/C比が高く、均一に異型が認められます。各肝細胞の間に胆汁色素が認められます。
40倍
画像 12
肝FNA、肝細胞癌
肝細胞癌からの細胞。肝細胞癌の吸引組織にみる悪性肝細胞。疎性の集塊を形成しています。N/C比が高く、均一に異型が認められます。各肝細胞の間に胆汁色素が認められます。
40倍
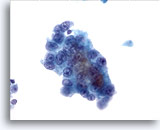
画像 13
肝FNA、肝細胞癌
肝細胞癌からの細胞。高分化肝細胞癌。肝細胞はN/C比が高く、均一に異型が認められます。
40倍
画像 13
肝FNA、肝細胞癌
肝細胞癌からの細胞。高分化肝細胞癌。肝細胞はN/C比が高く、均一に異型が認められます。
40倍
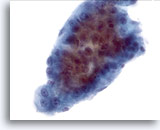
画像 14
肝FNA、肝細胞癌
肝細胞癌からの細胞。肝細胞癌集塊。厚く柵状を呈し、肝細胞癌に典型的な鮮明な境界辺縁がみられます。均一に異型性が認められます。
40倍
画像 14
肝FNA、肝細胞癌
肝細胞癌からの細胞。肝細胞癌集塊。厚く柵状を呈し、肝細胞癌に典型的な鮮明な境界辺縁がみられます。均一に異型性が認められます。
40倍
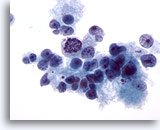
画像 15
肝FNA、肝細胞癌
肝細胞癌からの細胞。低分化型肝細胞癌。疎性に凝集を来した悪性肝細胞がみられ、核の大小不同および核形不整が著明に認められます。
40倍
画像 15
肝FNA、肝細胞癌
肝細胞癌からの細胞。低分化型肝細胞癌。疎性に凝集を来した悪性肝細胞がみられ、核の大小不同および核形不整が著明に認められます。
40倍
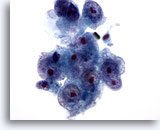
画像 16
肝FNA、肝細胞癌
肝細胞癌からの細胞。低分化型肝細胞癌。高N/C比、核形不整を示しています。明瞭な核小体が多数認められます。
60倍
画像 16
肝FNA、肝細胞癌
肝細胞癌からの細胞。低分化型肝細胞癌。高N/C比、核形不整を示しています。明瞭な核小体が多数認められます。
60倍
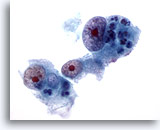
画像 17
肝FNA、肝細胞癌
肝細胞癌からの細胞。低分化型肝細胞癌。著明な核腫大、核形不整を呈し、きわめて明瞭に核小体が認められます。
60倍
画像 17
肝FNA、肝細胞癌
肝細胞癌からの細胞。低分化型肝細胞癌。著明な核腫大、核形不整を呈し、きわめて明瞭に核小体が認められます。
60倍
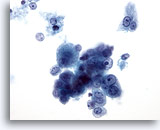
画像 18: 肝FNA、肝細胞癌 肝細胞癌からの細胞。悪性肝細胞が孤立性に散在し、疎性の集塊を形成しています。均一に異型性が認められます。ほぼ立方形で核小体が中心性にみられ、肝細胞の特徴をとどめています。二核性の腫瘍細胞が認められます。N/C比は高値を示します。
40倍
画像 18
肝FNA、肝細胞癌
肝細胞癌からの細胞。悪性肝細胞が孤立性に散在し、疎性の集塊を形成しています。均一に異型性が認められます。ほぼ立方形で核小体が中心性にみられ、肝細胞の特徴をとどめています。二核性の腫瘍細胞が認められます。N/C比は高値を示します。
40倍
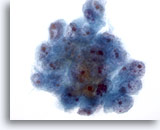
画像 19
肝FNA、肝細胞癌
肝細胞癌からの細胞。肝細胞癌の吸引組織にみる悪性細胞集塊。核腫大およびクロマチン分布不均等を呈し、核小体は1つであることもあれば、複数みられることもあります。N/C比は高値を示します。
40倍
画像 19
肝FNA、肝細胞癌
肝細胞癌からの細胞。肝細胞癌の吸引組織にみる悪性細胞集塊。核腫大およびクロマチン分布不均等を呈し、核小体は1つであることもあれば、複数みられることもあります。N/C比は高値を示します。
40倍
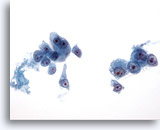
画像 20
肝FNA、肝細胞癌
肝細胞癌からの細胞。肝細胞癌の吸引組織にみる悪性細胞。孤立性に認められるものと、疎な結合を示す集塊を形成したものです。均一に異型性が認められ、悪性細胞のN/C比は高値を示します。核小体は明瞭に認められます。
40倍
画像 20
肝FNA、肝細胞癌
肝細胞癌からの細胞。肝細胞癌の吸引組織にみる悪性細胞。孤立性に認められるものと、疎な結合を示す集塊を形成したものです。均一に異型性が認められ、悪性細胞のN/C比は高値を示します。核小体は明瞭に認められます。
40倍
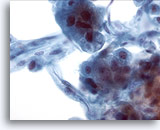
画像 21
肝FNA、肝細胞癌
肝細胞癌からの細胞。肝細胞癌の吸引組織にみる細胞とその周辺の内皮細胞。内皮細胞とは紡錐形の細胞で、核が伸長し不明瞭な細胞質が認められます。
40倍
画像 21
肝FNA、肝細胞癌
肝細胞癌からの細胞。肝細胞癌の吸引組織にみる細胞とその周辺の内皮細胞。内皮細胞とは紡錐形の細胞で、核が伸長し不明瞭な細胞質が認められます。
40倍
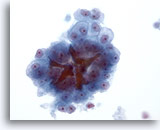
画像 22
肝FNA、肝細胞癌
肝細胞癌からの細胞。均一に異型性を呈し、胆管にも異型肝細胞が認められます。
40倍
画像 22
肝FNA、肝細胞癌
肝細胞癌からの細胞。均一に異型性を呈し、胆管にも異型肝細胞が認められます。
40倍
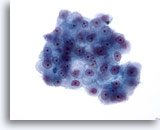
画像 23
肝FNA、肝細胞癌 肝細胞癌からの細胞。悪性細胞の集塊。N/Cが高く、核形は卵円形のものから幾分不整を呈するものまで差が認められます。明瞭な核小体が認められます。細胞質は顆粒状を呈することもあれば淡色を示すこともあり、その境界は明瞭です。
40倍
画像 23
肝FNA、肝細胞癌
肝細胞癌からの細胞。悪性細胞の集塊。N/Cが高く、核形は卵円形のものから幾分不整を呈するものまで差が認められます。明瞭な核小体が認められます。細胞質は顆粒状を呈することもあれば淡色を示すこともあり、その境界は明瞭です。
40倍
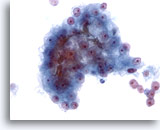
画像 24
肝FNA、肝細胞癌
肝細胞癌からの細胞。肝細胞癌の吸引組織にみる悪性細胞集塊。胆汁がつまっている。胆汁が認められることは肝細胞癌に特異的な所見ですが、認められる頻度はごくわずかです。
40倍
画像 24
肝FNA、肝細胞癌
肝細胞癌からの細胞。肝細胞癌の吸引組織にみる悪性細胞集塊。胆汁がつまっている。胆汁が認められることは肝細胞癌に特異的な所見ですが、認められる頻度はごくわずかです。
40倍
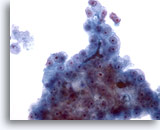
画像 25
肝FNA、肝細胞癌
肝細胞癌からの細胞。肝細胞癌の吸引組織に胆栓が認められる標本です。
40倍
画像 25
肝FNA、肝細胞癌
肝細胞癌からの細胞。肝細胞癌の吸引組織に胆栓が認められる標本です。
40倍
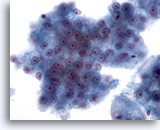
画像 26
肝FNA、肝細胞癌
肝細胞癌からの細胞。均一に異型性を呈する悪性肝細胞集塊。
40倍
画像 26
肝FNA、肝細胞癌
肝細胞癌からの細胞。均一に異型性を呈する悪性肝細胞集塊。
40倍
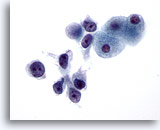
画像 27
肝FNA、肝細胞癌
肝細胞癌からの細胞。低分化型肝細胞癌。N/C比が著明に高く、悪性細胞が解離して認められます。
40倍
画像 27
肝FNA、肝細胞癌
肝細胞癌からの細胞。低分化型肝細胞癌。N/C比が著明に高く、悪性細胞が解離して認められます。
40倍
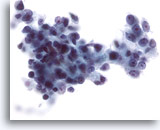
画像 28
肝FNA、肝細胞癌
細胞癌からの細胞。悪性細胞のN/C比が著明に高い低分化型肝細胞癌。核形不整が著明に認められます。
60倍
画像 28
肝FNA、肝細胞癌
細胞癌からの細胞。悪性細胞のN/C比が著明に高い低分化型肝細胞癌。核形不整が著明に認められます。
60倍
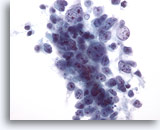
画像 29: 肝FNA、肝細胞癌
肝細胞癌からの細胞。肝細胞癌の吸引組織にみる腫瘍細胞が疎な凝集しています。肝細胞癌の分化度がきわめて低いため、凝集性はほとんど認められず、「肝細胞らしい」所見を幾分欠く標本です。このため、原発性肝細胞癌と転移性癌との鑑別診断は困難となります。
40倍
画像 29
肝FNA、肝細胞癌
肝細胞癌からの細胞。肝細胞癌の吸引組織にみる腫瘍細胞が疎な凝集しています。肝細胞癌の分化度がきわめて低いため、凝集性はほとんど認められず、「肝細胞らしい」所見を幾分欠く標本です。このため、原発性肝細胞癌と転移性癌との鑑別診断は困難となります。
40倍
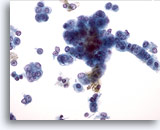
画像 30
肝FNA、肝細胞癌
肝細胞癌からの細胞。悪性肝細胞。N/C比が高く、核クロマチンが胞状を呈し核小体が明瞭に認められます。ほぼ円柱形の線状に配列する右側の腫瘍細胞には、肝細胞癌と胆管癌が混在しているものと考えられます。
40倍
画像 30
肝FNA、肝細胞癌
肝細胞癌からの細胞。悪性肝細胞。N/C比が高く、核クロマチンが胞状を呈し核小体が明瞭に認められます。ほぼ円柱形の線状に配列する右側の腫瘍細胞には、肝細胞癌と胆管癌が混在しているものと考えられます。
40倍
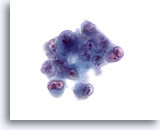
画像 31
肝FNA、肝細胞癌
肝細胞癌からの細胞。低分化型肝細胞癌。きわめて異型性の高い細胞で、N/C比は高く、二核のものから多核のものまで認められます。形状不整のクロマチンが集塊を形成し、同じく形状不整な核小体が明瞭に認められます。
60倍
画像 31
肝FNA、肝細胞癌
肝細胞癌からの細胞。低分化型肝細胞癌。きわめて異型性の高い細胞で、N/C比は高く、二核のものから多核のものまで認められます。形状不整のクロマチンが集塊を形成し、同じく形状不整な核小体が明瞭に認められます。
60倍
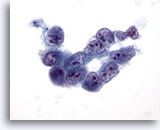
画像 32
肝FNA、肝細胞癌
肝細胞癌からの細胞。低分化型肝細胞癌の吸引組織にみる悪性細胞が疎な凝集を来しています。N/C比がきわめて高く、核形不整およびクロマチン分布の不均等が認められ、多数の核小体がみられます。
60倍
画像 32
肝FNA、肝細胞癌
肝細胞癌からの細胞。低分化型肝細胞癌の吸引組織にみる悪性細胞が疎な凝集を来しています。N/C比がきわめて高く、核形不整およびクロマチン分布の不均等が認められ、多数の核小体がみられます。
60倍
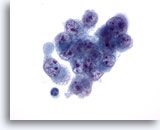
画像 33
肝FNA、肝細胞癌
肝細胞癌からの細胞。低分化型肝細胞癌の吸引組織にみる悪性細胞。細胞は大小不同、形状の不整を示し、核形不整を呈しています。クロマチン分布は不均等で、多数の核小体がみられます。
60倍
画像 33
肝FNA、肝細胞癌
肝細胞癌からの細胞。低分化型肝細胞癌の吸引組織にみる悪性細胞。細胞は大小不同、形状の不整を示し、核形不整を呈しています。クロマチン分布は不均等で、多数の核小体がみられます。
60倍
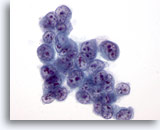
画像 34
肝FNA、肝細胞癌
肝細胞癌からの細胞。肝細胞癌の吸引組織にみる腫瘍細胞。 N/C比はきわめて高値を示します。
60倍
画像 34
肝FNA、肝細胞癌
肝細胞癌からの細胞。肝細胞癌の吸引組織にみる腫瘍細胞。 N/C比はきわめて高値を示します。
60倍
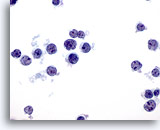
画像 35
肝FNA – リンパ腫
異型リンパ系細胞が解離して認められます。N/C比が高く、核形不整を示し、小さいものの明瞭な核小体が認められます。
60倍
画像 35
肝FNA – リンパ腫
異型リンパ系細胞が解離して認められます。N/C比が高く、核形不整を示し、小さいものの明瞭な核小体が認められます。
60倍
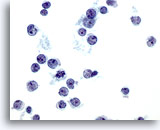
画像 36
肝FNA – リンパ腫.
非ホジキンリンパ腫の吸引組織にみる腫瘍細胞。孤立性に散在し、N/C比は高値を示します。核形不整、裂溝およびくちばし状の形状(snout)が認められます。一部の腫瘍細胞は小型ですが、核小体は明瞭にみられます。
60倍
画像 36
肝FNA – リンパ腫
非ホジキンリンパ腫の吸引組織にみる腫瘍細胞。孤立性に散在し、N/C比は高値を示します。核形不整、裂溝およびくちばし状の形状(snout)が認められます。一部の腫瘍細胞は小型ですが、核小体は明瞭にみられます。
60倍
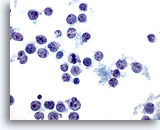
画像 37
肝FNA – リンパ腫
非ホジキンリンパ腫の吸引組織にみる悪性リンパ系細胞。孤立性に散在し、核形が卵円形のものもあれば不整を呈するものもみられます。裂溝およびくちばし状の形状が認められ、核膜が不整を呈しています。
60倍
画像 37
肝FNA – リンパ腫
非ホジキンリンパ腫の吸引組織にみる悪性リンパ系細胞。孤立性に散在し、核形が卵円形のものもあれば不整を呈するものもみられます。裂溝およびくちばし状の形状が認められ、核膜が不整を呈しています。
60倍
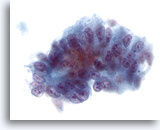
画像 38
肝FNA、転移性腺癌
肝に転移した腺癌。異型性を示す円柱状の細胞とともに、核の偽重層化がみられます。核は卵円形で、多数の核小体を有し、核形不整が認められます。
40倍
画像 38
肝FNA、転移性腺癌
肝に転移した腺癌。異型性を示す円柱状の細胞とともに、核の偽重層化がみられます。核は卵円形で、多数の核小体を有し、核形不整が認められます。
40倍
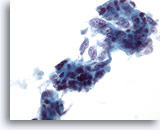
画像 39
肝FNA、転移性腺癌
疎な結合性を示す集塊を形成し、腫瘍細胞の多くが円柱状で、伸長した胞状の核および多数の明瞭な核小体がみられます。
40倍
画像 39
肝FNA、転移性腺癌
疎な結合性を示す集塊を形成し、腫瘍細胞の多くが円柱状で、伸長した胞状の核および多数の明瞭な核小体がみられます。
40倍
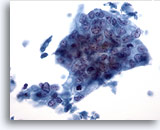
画像 40
肝FNA、転移性腺癌
低分化型腺癌。腫瘍細胞には合胞化が認められ、核は極性を欠いています。腫瘍細胞には、核の大小不同および核形不整が著明に認められます。
40倍
画像 40
肝FNA、転移性腺癌
低分化型腺癌。腫瘍細胞には合胞化が認められ、核は極性を欠いています。腫瘍細胞には、核の大小不同および核形不整が著明に認められます。
40倍
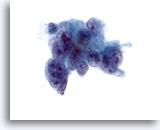
画像 41
肝FNA、転移性腺癌
転移性腺癌の吸引組織にみる低分化型悪性細胞。核の大小不同および核形不整が著明に認められます。多核を有し、不均等なクロマチン分布を呈し、明瞭な核小体が1つ以上認められます。きめ細かい細胞質がみられます。
60倍
画像 41
肝FNA、転移性腺癌
転移性腺癌の吸引組織にみる低分化型悪性細胞。核の大小不同および核形不整が著明に認められます。多核を有し、不均等なクロマチン分布を呈し、明瞭な核小体が1つ以上認められます。きめ細かい細胞質がみられます。
60倍
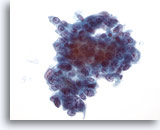
画像 42
肝FNA、転移性腺癌
腫瘍細胞には立方形からやや円柱状のものまでみられます。核の大小不同および核形不整が幾分認められ、クロマチン分布は胞状で、明瞭な核小体を有しています。
40倍
画像 42
肝FNA、転移性腺癌
腫瘍細胞には立方形からやや円柱状のものまでみられます。核の大小不同および核形不整が幾分認められ、クロマチン分布は胞状で、明瞭な核小体を有しています。
40倍
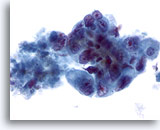
画像 43
肝FNA、転移性腺癌
低分化型悪性細胞。核の大小不同および核形不整が著明で、クロマチン分布の不均等、明瞭な核小体がみられます。
40倍
画像 43
肝FNA、転移性腺癌
低分化型悪性細胞。核の大小不同および核形不整が著明で、クロマチン分布の不均等、明瞭な核小体がみられます。
40倍
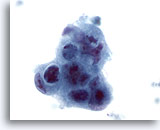
画像 44
肝FNA、転移性腺癌
低分化型悪性細胞。合胞化が認められ、極性を欠いています。著明な核形不整、クロマチン増量、核小体不整が認められます。
60倍
画像 44
肝FNA、転移性腺癌
低分化型悪性細胞。合胞化が認められ、極性を欠いています。著明な核形不整、クロマチン増量、核小体不整が認められます。
60倍
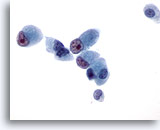
画像 45
肝FNA、転移性胆管癌
悪性細胞は立方体から円柱状の形状を呈し、明瞭かつ不整な核小体を有する核が偏在しています。
60倍
画像 45
肝FNA、転移性胆管癌
悪性細胞は立方体から円柱状の形状を呈し、明瞭かつ不整な核小体を有する核が偏在しています。
60倍
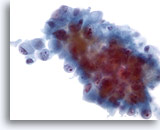
画像 46
肝FNA、転移性胆管癌
転移性胆管癌の吸引組織にみる腫瘍細胞は、卵円形から円柱状の形状を呈しています。核が偏在し、核形不整、不均等なクロマチン分布および明瞭な核小体が認められます。周辺に両染性のきめ細かい細胞質がみられます。
40倍
画像 46
肝FNA、転移性胆管癌
転移性胆管癌の吸引組織にみる腫瘍細胞は、卵円形から円柱状の形状を呈しています。核が偏在し、核形不整、不均等なクロマチン分布および明瞭な核小体が認められます。周辺に両染性のきめ細かい細胞質がみられます。
40倍
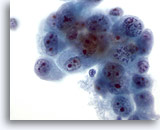
画像 47
肝FNA、転移性胆管癌
転移性胆管癌の吸引組織にみる悪性細胞の形状に、卵円形を呈するものから不整のものまでみられます。クロマチンが集塊を形成し、不均等に分布しています。多数の核小体を有し、周辺に両染性できめ細かい細胞質が認められます。
60倍
画像 47
肝FNA、転移性胆管癌
転移性胆管癌の吸引組織にみる悪性細胞の形状に、卵円形を呈するものから不整のものまでみられます。クロマチンが集塊を形成し、不均等に分布しています。多数の核小体を有し、周辺に両染性できめ細かい細胞質が認められます。
60倍
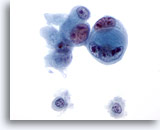
画像 48
肝FNA、転移性胆管癌
低分化型腺癌。細胞内に細胞が認められるものがあります。核の大小不同および核形不整が著明で、不整な核小体が多数みられます。
60倍
画像 48
肝FNA、転移性胆管癌
低分化型腺癌。細胞内に細胞が認められるものがあります。核の大小不同および核形不整が著明で、不整な核小体が多数みられます。
60倍
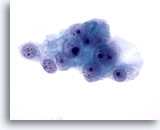
画像 49
肝FNA、転移性腎細胞癌
悪性細胞に多数の核小体を有する円形の核が認められます。周辺の細胞質は淡色できめ細かく、辺縁部が擦り切れた状態を呈しています。
60倍
画像 49
肝FNA、転移性腎細胞癌
悪性細胞に多数の核小体を有する円形の核が認められます。周辺の細胞質は淡色できめ細かく、辺縁部が擦り切れた状態を呈しています。
60倍
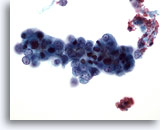
画像 50
肝FNA、転移性子宮内膜腺癌
転移性子宮内膜癌の吸引組織に認められる比較的小型の悪性細胞。N/C比がきわめて高値を示しています。
40倍
画像 50
肝FNA、転移性子宮内膜腺癌
転移性子宮内膜癌の吸引組織に認められる比較的小型の悪性細胞。N/C比がきわめて高値を示しています。
40倍
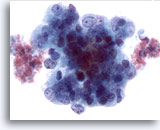
画像 51
肝FNA、転移性子宮内膜腺癌
肝に転移した子宮内膜腺癌。腫瘍細胞は核の大小不同および核形不整が著明に認められます。クロマチンの不規則性、明瞭な核小体が認められます。
60倍
画像 51
肝FNA、転移性子宮内膜腺癌
肝に転移した子宮内膜腺癌。腫瘍細胞は核の大小不同および核形不整が著明に認められます。クロマチンの不規則性、明瞭な核小体が認められます。
60倍
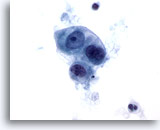
画像 52
転移性盲腸癌
盲腸の転移性腺癌にみる悪性細胞。形状は立方形のものもあれば卵円形のものもあり、疎な集塊を形成しています。核の大小不同および核形不整が認められます。
60倍
画像 52
転移性盲腸癌
盲腸の転移性腺癌にみる悪性細胞。形状は立方形のものもあれば卵円形のものもあり、疎な集塊を形成しています。核の大小不同および核形不整が認められます。
60倍
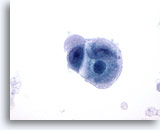
画像 53
転移性盲腸癌
盲腸に転移した低分化型癌の穿刺吸引組織にみる腫瘍細胞。核の大小不同および核形不整が認められます。周辺の細胞質は泡沫状で両染性を示しています。
60倍
画像 53
転移性盲腸癌
盲腸に転移した低分化型癌の穿刺吸引組織にみる腫瘍細胞。核の大小不同および核形不整が認められます。周辺の細胞質は泡沫状で両染性を示しています。
60倍
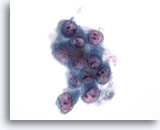
画像 54: 肝FNA、転移性肺癌 肝に転移した肺腺癌の穿刺吸引組織にみる悪性細胞。疎な集塊を形成し、著明な核形不整が認められます。N/C比は高く、個々の腫瘍細胞に核が偏在し、周辺には両染性の細胞質が認められます。
60倍
画像 54
肝FNA、転移性肺癌
肝に転移した肺腺癌の穿刺吸引組織にみる悪性細胞。疎な集塊を形成し、著明な核形不整が認められます。N/C比は高く、個々の腫瘍細胞に核が偏在し、周辺には両染性の細胞質が認められます。
60倍
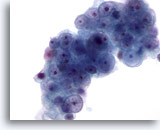
画像 55
肝FNA、肝に転移した腎細胞癌
腫瘍細胞は円形の核を有し、核形不整が認められます。核膜不整はほとんどみられません。核小体は小型のものもあれば、明瞭なものも認められます。周辺には淡色の細胞質が認められます。
60倍
画像 55
肝FNA、肝に転移した腎細胞癌
腫瘍細胞は円形の核を有し、核形不整が認められます。核膜不整はほとんどみられません。核小体は小型のものもあれば、明瞭なものも認められます。周辺には淡色の細胞質が認められます。
60倍
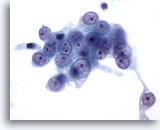
画像 56
肝FNA、肝に転移した腎細胞癌
転移性腎細胞癌の穿刺吸引組織にみる悪性細胞。円形の核を有し、クロマチンは胞状に認められ、明瞭な核小体が1つ以上認められます。周辺の細胞質は淡色を示し、細胞質の境界は擦り切れた状態を呈しています。
60倍
画像 56
肝FNA、肝に転移した腎細胞癌
転移性腎細胞癌の穿刺吸引組織にみる悪性細胞。円形の核を有し、クロマチンは胞状に認められ、明瞭な核小体が1つ以上認められます。周辺の細胞質は淡色を示し、細胞質の境界は擦り切れた状態を呈しています。
60倍
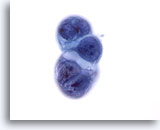
画像 57
肝FNA、転移性膵癌
肝に転移した膵管癌集塊。N/C比は高く、核形不整およびクロマチン集塊が認められます。細胞質の空胞化が認められます。
60倍
画像 57
肝FNA、転移性膵癌
肝に転移した膵管癌集塊。N/C比は高く、核形不整およびクロマチン集塊が認められます。細胞質の空胞化が認められます。
60倍
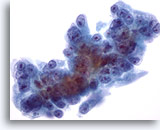
画像 58
肝FNA、転移性膵癌
肝に転移した膵癌の悪性細胞。核の大小不同および核形不整が著明に認められます。核小体が偏在し、周辺には両染性できめ細かい細胞質が認められます。
60倍
画像 58
肝FNA、転移性膵癌
肝に転移した膵癌の悪性細胞。核の大小不同および核形不整が著明に認められます。核小体が偏在し、周辺には両染性できめ細かい細胞質が認められます。
60倍
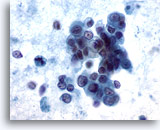
画像 59
肝FNA、転移性膵癌
悪性細胞が疎な結合を示す集塊を形成し、細胞質が淡色を呈するものや空胞化を来したものがみられ、核が偏在しています。核の大小不同および核形不整が著明に認められます。疎性の凝集を来した細胞群のほか、一部孤立した腫瘍細胞が認められます。重要な腫瘍性背景が認められます。
60倍
画像 59
肝FNA、転移性膵癌
悪性細胞が疎な結合を示す集塊を形成し、細胞質が淡色を呈するものや空胞化を来したものがみられ、核が偏在しています。核の大小不同および核形不整が著明に認められます。疎性の凝集を来した細胞群のほか、一部孤立した腫瘍細胞が認められます。重要な腫瘍性背景が認められます。
60倍
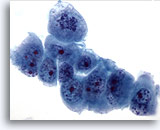
画像 60
肝FNA、転移性膵癌
低分化型悪性細胞。核の大小不同および核形不整が著明に認められます。クロマチン分布が不均等で、核小体が明瞭に認められます。
60倍
画像 60
肝FNA、転移性膵癌
低分化型悪性細胞。核の大小不同および核形不整が著明に認められます。クロマチン分布が不均等で、核小体が明瞭に認められます。
60倍
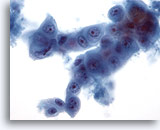
画像 61
肝FNA、転移性膵癌
転移性膵癌の吸引組織にみる細胞。形状は卵円形のものもあれば立方形のものもみられ、細胞内に細胞が認められるものがあります。核の大小不同および核形不整が著明に認められます。
40倍
画像 61
肝FNA、転移性膵癌
転移性膵癌の吸引組織にみる細胞。形状は卵円形のものもあれば立方形のものもみられ、細胞内に細胞が認められるものがあります。核の大小不同および核形不整が著明に認められます。
40倍
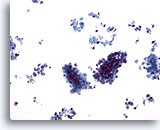
画像 62
肝FNA、転移性小細胞癌
悪性小細胞が集塊を形成しているものもあれば、孤立性に散在するものも認められます。悪性小細胞は小型であることを特徴とし、N/C比は高値を示します。
20倍
画像 62
肝FNA、転移性小細胞癌
悪性小細胞が集塊を形成しているものもあれば、孤立性に散在するものも認められます。悪性小細胞は小型であることを特徴とし、N/C比は高値を示します。
20倍
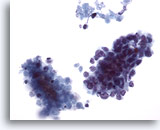
画像 63
肝FNA、転移性小細胞癌
肺に転移した小細胞癌にみる小型の悪性細胞。集塊を形成し、N/C比が高値を示します。明瞭な核小体は認められず、核クロマチン増量がみられます。悪性細胞集塊に隣接して壊死物質が認められます。
40倍
画像 63
肝FNA、転移性小細胞癌
肺に転移した小細胞癌にみる小型の悪性細胞。集塊を形成し、N/C比が高値を示します。明瞭な核小体は認められず、核クロマチン増量がみられます。悪性細胞集塊に隣接して壊死物質が認められます。
40倍
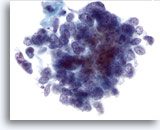
画像 64
肝FNA、転移性小細胞癌
クロマチン分布が均等で、明瞭な核小体を欠く所見は小細胞癌に典型的であり、N/C比は高値を示します。
60倍
画像 64
肝FNA、転移性小細胞癌
クロマチン分布が均等で、明瞭な核小体を欠く所見は小細胞癌に典型的であり、N/C比は高値を示します。
60倍
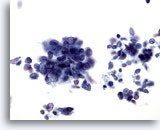
画像 65
肝FNA、転移性小細胞癌
肺の転移性小細胞癌の吸引組織にみる悪性細胞。小型で疎な結合を示す集塊を形成し、N/C比は高値を示します。大部分は核小体が明瞭ではなく、クロマチンが細かく分布しています。
40倍
画像 65
肝FNA、転移性小細胞癌
肺の転移性小細胞癌の吸引組織にみる悪性細胞。小型で疎な結合を示す集塊を形成し、N/C比は高値を示します。大部分は核小体が明瞭ではなく、クロマチンが細かく分布しています。
40倍
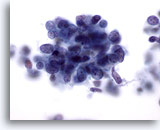
画像 66
肝FNA、転移性小細胞癌
肺の転移性小細胞癌を高倍率で観察したもの。悪性細胞のN/C比が高く、核クロマチンが微粒状で均等に分布し、明瞭な核小体を欠いていることがわかります。
60倍
画像 66
肝FNA、転移性小細胞癌
肺の転移性小細胞癌を高倍率で観察したもの。悪性細胞のN/C比が高く、核クロマチンが微粒状で均等に分布し、明瞭な核小体を欠いていることがわかります。
60倍
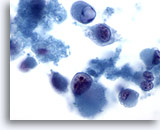
画像 67
肝FNA – 転移性黒色腫
染色部分が解離しており、「類横紋筋形質表現型(rhabdoid phenotype)」を呈する細胞が著明な異型を示しています。類横紋筋形質表現型は、細胞質内に大型の小球を有し、核小体が明瞭に認められることを特徴とします。
60倍
画像 67
肝FNA – 転移性黒色腫
染色部分が解離しており、「類横紋筋形質表現型(rhabdoid phenotype)」を呈する細胞が著明な異型を示しています。類横紋筋形質表現型は、細胞質内に大型の小球を有し、核小体が明瞭に認められることを特徴とします。
60倍
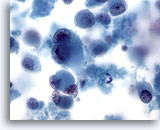
画像 68
肝FNA – 転移性黒色腫
肝に転移した黒色腫の吸引組織にみる悪性細胞。孤立性に散在し、明瞭な核小体を有しており、特徴的な二核化を示す細胞も認められます。転移性黒色腫には、細胞質の量が中程度のものもみられます。
60倍
画像 68
肝FNA – 転移性黒色腫
肝に転移した黒色腫の吸引組織にみる悪性細胞。孤立性に散在し、明瞭な核小体を有しており、特徴的な二核化を示す細胞も認められます。転移性黒色腫には、細胞質の量が中程度のものもみられます。
60倍
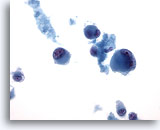
画像 69
肝FNA – 転移性黒色腫
肝に転移した悪性黒色腫の吸引細胞にみる奇異な腫瘍細胞。孤立性に散在し、二核化を示す細胞もみられます。
40倍
画像 69
肝FNA – 転移性黒色腫
肝に転移した悪性黒色腫の吸引細胞にみる奇異な腫瘍細胞。孤立性に散在し、二核化を示す細胞もみられます。
40倍
– 膵 –
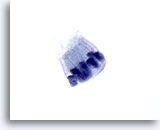
画像 70
膵FNA、良性膵管上皮細胞
円柱状の細胞が柵状に配列しています。N/C比は低値を示し、核は卵円形で、周辺に両染性かつ淡色の細胞質が認められます。
60倍
画像 70
膵FNA、良性膵管上皮細胞
円柱状の細胞が柵状に配列しています。N/C比は低値を示し、核は卵円形で、周辺に両染性かつ淡色の細胞質が認められます。
60倍
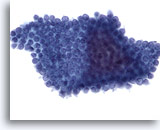
画像 71
膵FNA、良性膵管上皮細胞
吸引組織にみる良性膵管上皮細胞。蜂巣状に配列し、核が均等に分布しています。
40倍
画像 71
膵FNA、良性膵管上皮細胞
吸引組織にみる良性膵管上皮細胞。蜂巣状に配列し、核が均等に分布しています。
40倍
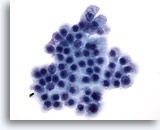
画像 72
膵FNA、良性膵管上皮細胞
この吸引組織にみる良性膵管上皮細胞は蜂巣状に配列しており、細胞が均一で、円形の核を有し細胞境界が明瞭です。
60倍
画像 72
膵FNA、良性膵管上皮細胞
この吸引組織にみる良性膵管上皮細胞は蜂巣状に配列しており、細胞が均一で、円形の核を有し細胞境界が明瞭です。
60倍

画像 73
膵FNA – 骨格筋
膵の経皮的吸引時に偶発的に採取された骨格筋の断片です。紡錐形の核を有する平均的な骨格筋です。
40倍
画像 73
膵FNA – 骨格筋
膵の経皮的吸引時に偶発的に採取された骨格筋の断片です。紡錐形の核を有する平均的な骨格筋です。
40倍
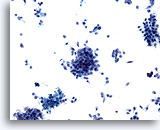
画像 74
膵FNA、膵腺癌
膵腺癌の吸引組織にみる悪性細胞。疎な結合を示す集塊を形成し、異型細胞が孤立性に散在しています。
20倍
画像 74
膵FNA、膵腺癌
膵腺癌の吸引組織にみる悪性細胞。疎な結合を示す集塊を形成し、異型細胞が孤立性に散在しています。
20倍
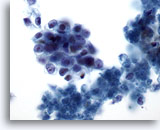
画像 75
膵FNA、膵腺癌
膵腺癌の吸引組織にみる悪性細胞。卵円形の細胞が疎性の集塊を形成しており、N/C比は高値を示しています。背景に壊死組織片が認められます。
60倍
画像 75
膵FNA、膵腺癌
膵腺癌の吸引組織にみる悪性細胞。卵円形の細胞が疎性の集塊を形成しており、N/C比は高値を示しています。背景に壊死組織片が認められます。
60倍
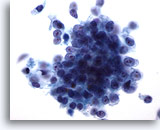
画像 76
膵FNA、膵腺癌膵管癌を高倍率で観察したもの。合胞化を来す悪性細胞による疎性の集塊のほか、孤立性に散在するものも認められます。形状は立方形のものもあれば円柱状のものもみられ、N/C比は高値を示します。
60倍
画像 76
膵FNA、膵腺癌
膵管癌を高倍率で観察したもの。合胞化を来す悪性細胞による疎性の集塊のほか、孤立性に散在するものも認められます。形状は立方形のものもあれば円柱状のものもみられ、N/C比は高値を示します。
60倍
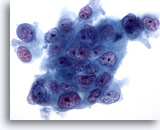
画像 77
膵FNA、膵腺癌膵管の中等度分化型腺癌を高倍率で観察したもの。腫瘍細胞の合胞体がみられ、細胞の大小不同および形状不整が著明に認められます。極性喪失の所見も認められます。核は不整な核小体を多数有し、クロマチン増量がみられます。
60倍
画像 77
膵FNA、膵腺癌
膵管の中等度分化型腺癌を高倍率で観察したもの。腫瘍細胞の合胞体がみられ、細胞の大小不同および形状不整が著明に認められます。極性喪失の所見も認められます。核は不整な核小体を多数有し、クロマチン増量がみられます。
60倍
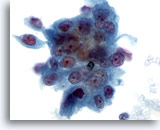
画像 78
膵FNA、膵腺癌
中等度分化型膵癌の吸引組織にみる悪性細胞。合胞化した細胞の集塊を形成し、核の大小不同および核形不整が著明に認められます。
60倍
画像 78
膵FNA、膵腺癌
中等度分化型膵癌の吸引組織にみる悪性細胞。合胞化した細胞の集塊を形成し、核の大小不同および核形不整が著明に認められます。
60倍
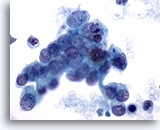
画像 79
膵FNA、膵腺癌 膵管癌の吸引組織にみる悪性細胞。疎な結合を示す細胞集塊と孤立性に散在するものが認められます。核の大小不同および核形不整が著明に認められます。この腫瘍細胞の多くはN/C比が高く、クロマチン不規則性がみられます。
60倍
画像 79
膵FNA、膵腺癌
膵管癌の吸引組織にみる悪性細胞。疎な結合を示す細胞集塊と孤立性に散在するものが認められます。核の大小不同および核形不整が著明に認められます。この腫瘍細胞の多くはN/C比が高く、クロマチン不規則性がみられます。
60倍
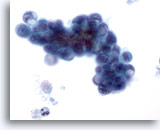
画像 80
膵FNA、膵腺癌
膵管癌の吸引組織にみる悪性細胞。卵円形の細胞とともに、印環細胞が認められます。細胞質の大きな空胞が核に取って代わっているものもあれば、これによって核が変形を来しているものもあります。
60倍
画像 80
膵FNA、膵腺癌
膵管癌の吸引組織にみる悪性細胞。卵円形の細胞とともに、印環細胞が認められます。細胞質の大きな空胞が核に取って代わっているものもあれば、これによって核が変形を来しているものもあります。
60倍
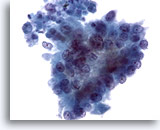
画像 81
膵FNA、膵腺癌
膵腺癌の吸引組織にみるほぼ円柱状の腫瘍細胞。核の大小不同および形状不整が著明にみられ、極性を欠いています。
40倍
画像 81
膵FNA、膵腺癌
膵腺癌の吸引組織にみるほぼ円柱状の腫瘍細胞。核の大小不同および形状不整が著明にみられ、極性を欠いています。
40倍
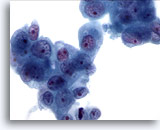
画像 82
膵FNA、膵腺癌
悪性細胞が疎性の集塊を形成しており、核の腫大およびクロマチン不規則性がみられ、核小体が明瞭に認められます。周辺の細胞質は両染性のものもあれば、わずかに空胞化を来したものもみられます。
60倍
画像 82
膵FNA、膵腺癌
悪性細胞が疎性の集塊を形成しており、核の腫大およびクロマチン不規則性がみられ、核小体が明瞭に認められます。周辺の細胞質は両染性のものもあれば、わずかに空胞化を来したものもみられます。
60倍
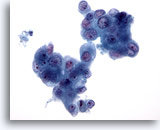
画像 83
膵FNA、膵腺癌
膵腺癌の吸引組織にみる悪性細胞集塊。核の大小不同が著明に認められます。二核化した細胞が一部認められます。
40倍
画像 83
膵FNA、膵腺癌
膵腺癌の吸引組織にみる悪性細胞集塊。核の大小不同が著明に認められます。二核化した細胞が一部認められます。
40倍
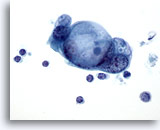
画像 84
膵FNA、膵腺癌
細胞質内に大きな空胞を有する悪性細胞集塊。 ムチン(targetoid mucin)が小滴状に認められます。
60倍
画像 84
膵FNA、膵腺癌
細胞質内に大きな空胞を有する悪性細胞集塊。 ムチン(targetoid mucin)が小滴状に認められます。
60倍
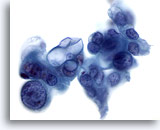
画像 85
膵FNA、膵腺癌
低分化型腺癌の吸引組織にみる奇異な腫瘍細胞。核の大小不同および核形不整が著明に認められるものもあります。また、一部の腫瘍細胞は細胞質内に大きな空胞を有しています。
60倍
画像 85
膵FNA、膵腺癌
低分化型腺癌の吸引組織にみる奇異な腫瘍細胞。核の大小不同および核形不整が著明に認められるものもあります。また、一部の腫瘍細胞は細胞質内に大きな空胞を有しています。
60倍
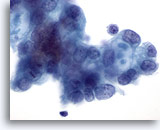
画像 86
膵FNA、膵腺癌
悪性細胞の一部に、ムチン性嚢胞(targetoid mucin)を有するものがみられます。
60倍
画像 86
膵FNA、膵腺癌
悪性細胞の一部に、ムチン性嚢胞(targetoid mucin)を有するものがみられます。
60倍
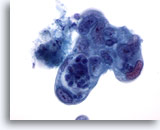
画像 87
膵FNA、膵腺癌
低分化型膵腺癌。細胞は多形性を示し、核の大小不同および核形不整が著明に認められ、N/C比は高値を示します。
60倍
画像 87
膵FNA、膵腺癌
低分化型膵腺癌。細胞は多形性を示し、核の大小不同および核形不整が著明に認められ、N/C比は高値を示します。
60倍
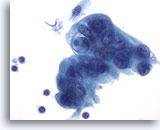
画像 88
膵FNA、膵腺癌
低分化型悪性細胞の一部に、合胞化した細胞が認められます。核クロマチンの増量が認められ、周辺の細胞質は両染性できめ細かく、境界が擦り切れた状態を呈しています。腫瘍細胞の1つに、ムチン性嚢胞(targetoid mucin)が認められます。
60倍
画像 88
膵FNA、膵腺癌
低分化型悪性細胞の一部に、合胞化した細胞が認められます。核クロマチンの増量が認められ、周辺の細胞質は両染性できめ細かく、境界が擦り切れた状態を呈しています。腫瘍細胞の1つに、ムチン性嚢胞(targetoid mucin)が認められます。
60倍
トップに戻る
目次へ戻る
























































































