Introduzione
Latha Pisharodi, medico
Il tratto gastrointestinale (GI) è composto da esofago, stomaco, intestino tenue e intestino crasso. Questi organi sono separati da sfinteri che controllano il passaggio delle sostanze da un componente del tratto gastrointestinale al successivo. Inoltre, ognuno di questi componenti è caratterizzato da una diversità della mucosa delle cellule che li rivestono. Il tratto gastroenterico rappresenta l’apparato digerente del corpo umano, una fonte di immunità e un organo endocrino.
Raccolta dei campioni
I campioni citologici ottenuti dal tratto gastrointestinale possono essere raccolti mediante brushing, lavaggi o biopsie per aspirazione con ago sottile (FNA) coguidate. Durante il brushing una spazzola ricoperta da una guaina trasparente viene inserita nell’endoscopio e viene messa a contatto con la lesione cinque-dieci volte. Si provvede quindi a estrarla e a collocare il campione direttamente sui vetrini o in un medium che ne garantisce la conservazione.
La FNA endoscopica prevede l’introduzione dell’ago in un endoscopio a fibre ottiche. Una volta localizzata l’area di interesse, viene creata una pressione negativa e l’ago viene spostato avanti e indietro nella lesione. L’equilibrio delle pressioni viene quindi ripristinato, l’ago viene rimosso e il campione raccolto in una soluzione di conservazione.
I campioni possono essere raccolti in una soluzione CytoLyt® ed elaborati con il processore ThinPrep® 2000 oppure possono essere collocati in altre soluzioni di conservazione ed elaborati con Cytospin o con il metodo dello striscio convenzionale.
Esofago
Normalmente l’esofago è rivestito da cellule epiteliali squamose non cheratinizzate. In alcuni rari casi, è possibile osservare cellule metaplastiche provenienti dalle ghiandole della sottomucosa. Le cellule ghiandolari colonnari possono provenire dallo stomaco o dall’esofago di Barrett.
Un’esofagite aspecifica è in genere caratterizzata da infiammazione acuta e/o cronica con alterazioni reattive. L’esofagite erpetica presenta i tradizionali effetti citopatici: multinucleazione, inclusioni virali eosinofile e nuclei a vetro smerigliato. L’esofagite da Candida viene diagnosticata quando si rilevano spore micotiche e pseudoife settate. In casi sporadici sono visibili altri organismi come ad esempio l’Aspergillus.
La valutazione citologica dell’esofago rappresenta uno strumento fondamentale per la formulazione della diagnosi di carcinoma esofageo, soprattutto nei paesi con un’elevata incidenza di cancro all’esofago come la Cina e il Giappone, dove questo esame viene utilizzato nei programmi di screening. Vari autori hanno dimostrato che l’approccio combinato di citologia-biopsia è il più utilizzato per la diagnosi delle neoplasie del tratto gastrointestinale superiore 1, 2. La displasia ghiandolare che si sviluppa nel contesto dell’esofago di Barrett è in genere caratterizzata da cellule atipiche sparse con alcune delle caratteristiche proprie dell’adenocarcinoma. Le cellule squamose atipiche con forme bizzarre, ipercromasia e pleomorfismo sono caratteristiche dei carcinomi a cellule squamose ben differenziati. I carcinomi a cellule squamose scarsamente differenziati presentano invece cellule altamente pleomorfe con un rapporto N/C elevato, nucleoli e citoplasma denso. Gli adenocarcinomi mostrano solitamente gruppi e aggregati di cellule epiteliali neoplastiche.
Stomaco
L’epitelio che riveste lo stomaco è costituito da cellule ghiandolari colonnari spesso disposte in foglietti a nido d’ape. È possibile rilevare la presenza di vacuoli contenenti mucina. Nei brushing gastrici è raro individuare cellule parietali e principali. Se si esegue la colorazione del Pap test, le cellule parietali presentano un citoplasma acidofilo. Per osservare le cellule principali è meglio eseguire una colorazione Romanowsky 3.Gli Helicobacter pylori sono batteri spiraliformi e gram-negativi facilmente identificabili con la colorazione Papanicolaou, Romanowsky, Warthin-Starry e ematossilina-eosina. L’individuazione di alterazioni reattive e riparative aspecifiche, cellule infiammatorie, attività mitotica e nucleoli prominenti indicano la presenza di ulcera peptica e gastrite. Gli adenocarcinomi gastrici sono caratterizzati da cellule epiteliali maligne con marcata atipia. È possibile rilevare anche cellule ad “anello con castone”. Le cellule squamose maligne, se presenti, suggeriscono la presenza di un carcinoma adenosquamoso o del raro carcinoma squamoso puro dello stomaco o la diffusione di un carcinoma esofageo a cellule squamose nello stomaco. In rare occasioni, l’esame citologico del brushing gastrico consente di rilevare anche altre forme tumorali, ad esempio i carcinoidi e tumori stromali. Tuttavia, la sensibilità diagnostica della citologia per l’individuazione di questi tumori risulta molto più elevata se si utilizza la procedura FNA endoscopica al posto del brushing.
Dotto biliare
I brushing del tratto biliare vengono in genere eseguiti mediante una colangiopancreatografia retrograda endoscopica (ERCP). I campioni possono essere ottenuti anche dagli stent biliari. La principale indicazione per la citologia biliare è il sospetto di una patologia maligna in un paziente affetto da stenosi biliare. In presenza di malattie infettive e angiocolite sclerosante primitiva (PSC), vengono rilevate di frequente alterazioni reattive e riparative. Nel tratto biliare è possibile osservare tracce di displasia. Le caratteristiche citologiche comprendono sovrapposizione e affollamento, rapporto nucleo/citoplasmatico aumentato e distribuzione anormale della cromatina. Tuttavia, l’atipia è meno marcata rispetto a quella dell’adenocarcinoma. Da un punto di vista citologico, l’adenocarcinoma del tratto biliare (colangiocarcinoma) è simile a quelli osservati nel tratto gastrointestinale. La variante mucinosa, in particolare, può essere estremamente difficile da diagnosticare a causa delle caratteristiche citologiche regolari. Queste cellule contengono abbondante mucina e possono talvolta essere confuse con degli istiociti.
Colon
Le cellule possono essere prelevate mediante brushing endoscopico, lavaggio o FNA. La mucosa colica normale è formata da grandi cellule colonnari disposte in lembi o singole. È possibile osservare cellule caliciformi. Alcuni autori hanno pubblicato risultati citologici relativi all’adenoma che dimostrano come l’adenoma tubulare sia costituito da cellule piatte e smussate, mentre quello villoso presenti cellule allungate e affusolate 4. L’adenocarcinoma del colon presenta gruppi coesi ed estremamente atipici di cellule ghiandolari con nucleoli prominenti e sfondo necrotico. La sensibilità del brushing colico nella diagnosi del carcinoma del colon è compresa tra il 70 e l’85% 5. Se si associa all’esame citologico la biopsia, l’accuratezza è certamente maggiore 6.
Brushing anale
Come avviene per la giunzione squamo-colonnare della cervice, la giunzione del canale anale è soggetta allo sviluppo di neoplasie 7. L’aspetto citologico dei due tipi di campione è molto simile. In effetti i reperti possono essere classificati in base ai criteri definiti dal Bethesda System 8.
Il materiale citologico per la valutazione viene facilmente raccolto raschiando direttamente l’area ed effettuando uno striscio direttamente sui vetrini o risospendendo le cellule in una soluzione fissativa. Inoltre, gli strisci anali vengono impiegati sempre più spesso come strumento di screening per valutare alterazioni displastiche, soprattutto tra la popolazione sieropositiva 9.I carcinomi a cellule squamose della regione anale sono caratterizzati dalle tipiche cellule squamose neoplastiche con vari livelli di differenziazione.
Bibliografia di riferimento
- C P Shroff, S A Nanivadekar: Endoscopic brushing cytology and biopsy in the diagnosis of upper gastrointestinal tract lesions. A study of 350 cases. Acta Cytol 1988: 32 (4}: 455-60.
- O Donoghue, P G Horgan, M K Donohoe et al: Adjunctive endoscopic brush cytology in the detection of upper gastrointestinal malignancy. Acta Cytol 1995: 39(1}: 28-33.
- M Drake: Gastric cytology: normal and abnormal. In Gastroesophageal Cytology. Basel: Karger, 1985, page 120.
- V Kannan, CB Masters: Cytodiagnosis of colonic adenoma: morphology and clinical importance. Diag Cytopathol 1991 7(4}: 13-16
- RG Bardawil, FG Ambrosio, SI Hajdu: Colonic cytology. A retrospective study with histologic correlation. Acta Cytol 1990; 34 (5}: 10-12
- M Halpern, R Gal, L Rath-Wolfson, R Koren et al. Brush cytology and biopsy in the diagnosis of colorectal cancer. A comparison. Acta Cytol 1997; 41 (3}: 628-32.
- Goldstone et al. High Prevalence of Anal Squamous Intraepithelial Lesions and Squamous Cell Carcinoma in Men Who Have Sex with Men as Seen in a Surgical Practice. Dis Colon Rectum 2001;44:690-698.
- Darragh et al. Comparison of Conventional Cytologic Smears and ThinPrep Preparations from the Anal Canal. Acta Cytol 1997;41:1167-70.
- MA Friedlander, E Stier, O Lin. Anorectal cytology as a screening tool for anal squamous lesions: cytologic, anoscopic, and histologic correlation. Cancer 2004: 102(1}:19-26.
Citologia Esofagea

Ricorda: Puoi cliccare su qualsiasi immagine per ingrandire l’immagine.
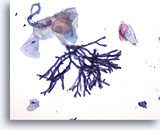
Figura 1
Brushing esofageo – Aspergillus
Il brushing esofageo rivela la presenza di Aspergillus con ife settate e di diramazioni con angoli di 45 gradi. In alcuni rari casi, è possibile osservare atipia delle cellule squamose.
20x
Figura 1
Brushing esofageo – Aspergillus
Il brushing esofageo rivela la presenza di Aspergillus con ife settate e di diramazioni con angoli di 45 gradi. In alcuni rari casi, è possibile osservare atipia delle cellule squamose.
20x
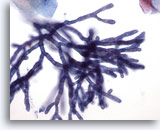
Figura 2
Brushing esofageo – Aspergillus
Le ife settate e le diramazioni con angoli di 45 gradi sono ben visibili a un ingrandimento superiore.
40x
Figura 2
Brushing esofageo – Aspergillus
Le ife settate e le diramazioni con angoli di 45 gradi sono ben visibili a un ingrandimento superiore.
40x
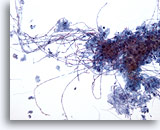
Figura 3
Brushing esofageo – Candida
L’esofagite da Candida è caratterizzata dalla presenza di forme pseudoifali allungate e di miceti ovoidali.
20x
Figura 3
Brushing esofageo – Candida
L’esofagite da Candida è caratterizzata dalla presenza di forme pseudoifali allungate e di miceti ovoidali.
20x
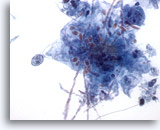
Figura 4
Brushing esofageo – Candida
È possibile osservare chiaramente alcuni miceti in fase vegetativa.
60x
Figura 4
Brushing esofageo – Candida
È possibile osservare chiaramente alcuni miceti in fase vegetativa.
60x
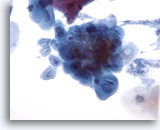
Figura 5
Brushing esofageo – Herpes
L’infezione da Herpes è confermata dall’osservazione degli aspetti citologici classici: multinucleazione, ripiegamento dei nuclei e cromatina a vetro smerigliato.
40x
Figura 5
Brushing esofageo – Herpes
L’infezione da Herpes è confermata dall’osservazione degli aspetti citologici classici: multinucleazione, ripiegamento dei nuclei e cromatina a vetro smerigliato.
40x

Figura 6
Brushing esofageo – Herpes
Nell’infezione da Herpes è possibile osservare inclusioni intranucleari eosinofile.
40x
Figura 6
Brushing esofageo – Herpes
Nell’infezione da Herpes è possibile osservare inclusioni intranucleari eosinofile.
40x
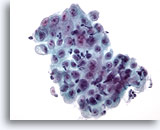
Figura 7
Brushing esofageo – Ulcera
Foglietto di cellule epiteliali ricoperto di cellule infiammatorie e con alterazioni reattive.
40x
Figura 7
Brushing esofageo – Ulcera
Foglietto di cellule epiteliali ricoperto di cellule infiammatorie e con alterazioni reattive.
40x
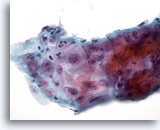
Figura 8
Brushing esofageo – Ulcera
Riparazione atipica in un’ulcera esofagea, che mostra un infiltrato infiammatorio, atipia reattiva con nucleoli prominenti, membrane nucleari regolari e cromatina a grana fine.
60x
Figura 8
Brushing esofageo – Ulcera
Riparazione atipica in un’ulcera esofagea, che mostra un infiltrato infiammatorio, atipia reattiva con nucleoli prominenti, membrane nucleari regolari e cromatina a grana fine.
60x
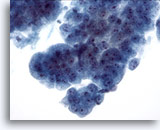
Figura 9
Brushing esofageo, displasia di alto grado nell’epitelio di Barrett.
Gruppi compatti di cellule ghiandolari atipiche con alcune caratteristiche dell’adenocarcinoma.
40x
Figura 9
Brushing esofageo, displasia di alto grado nell’epitelio di Barrett.
Gruppi compatti di cellule ghiandolari atipiche con alcune caratteristiche dell’adenocarcinoma.
40x
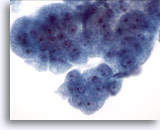
Figura 10
Brushing esofageo, displasia di alto grado nell’epitelio di Barrett.
Un gruppo di cellule compatte con nuclei di dimensioni variabili, rapporto nucleare/citoplasmatico elevato, sovrapposizione e affollamento. Le caratteristiche citologiche non si adattano a una diagnosi definitiva di adenocarcinoma.
60x
Figura 10
Brushing esofageo, displasia di alto grado nell’epitelio di Barrett.
Un gruppo di cellule compatte con nuclei di dimensioni variabili, rapporto nucleare/citoplasmatico elevato, sovrapposizione e affollamento. Le caratteristiche citologiche non si adattano a una diagnosi definitiva di adenocarcinoma.
60x
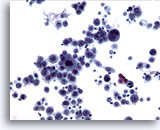
Figura 11
Brushing esofageo, carcinoma a cellule squamose.
Le cellule epiteliali estremamente atipiche consentono di formulare una diagnosi di carcinoma scarsamente differenziato.
20x
Figura 11
Brushing esofageo, carcinoma a cellule squamose.
Le cellule epiteliali estremamente atipiche consentono di formulare una diagnosi di carcinoma scarsamente differenziato.
20x
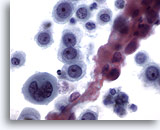
Figura 12
Brushing esofageo, carcinoma a cellule squamose scarsamente differenziato.
Cellule epiteliali atipiche con cromatina anormale. La differenziazione squamosa non è immediatamente determinabile.
60x
Figura 12
Brushing esofageo, carcinoma a cellule squamose scarsamente differenziato.
Cellule epiteliali atipiche con cromatina anormale. La differenziazione squamosa non è immediatamente determinabile.
60x
Citologia Gastrica
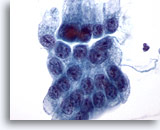
Figura 13
Brushing gastrico, displasia gastrica.
Foglietto piatto di cellule epiteliali gastriche atipiche con nuclei più grandi del normale, affollamento e sovrapposizione focale delle cellule.
60x
Figura 13
Brushing gastrico, displasia gastrica.
Foglietto piatto di cellule epiteliali gastriche atipiche con nuclei più grandi del normale, affollamento e sovrapposizione focale delle cellule.
60x
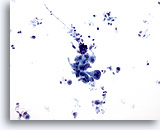
Figura 14
Brushing gastrico, adenocarcinoma gastrico.
Gruppo coeso di cellule atipiche. È possibile osservare lo sfondo “sporco”.
20x
Figura 14
Brushing gastrico, adenocarcinoma gastrico.
Gruppo coeso di cellule atipiche. È possibile osservare lo sfondo “sporco”.
20x
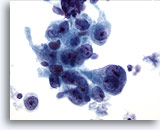
Figura 15
Brushing gastrico, adenocarcinoma gastrico.
Cellule epiteliali neoplastiche che presentano pleomorfismo e nucleoli prominenti.
60x
Figura 15
Brushing gastrico, adenocarcinoma gastrico.
Cellule epiteliali neoplastiche che presentano pleomorfismo e nucleoli prominenti.
60x
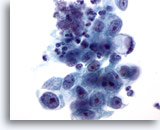
Figura 16
Brushing gastrico, adenocarcinoma gastrico.
Adenocarcinoma con una cellula ad “anello con castone” situata a un’estremità. Questo tipo di cellule è caratterizzato da vacuoli giganti contenenti mucina che comprimono il nucleo contro la membrana nucleare fino a formare una mezzaluna.
60x
Figura 16
Brushing gastrico, adenocarcinoma gastrico.
Adenocarcinoma con una cellula ad “anello con castone” situata a un’estremità. Questo tipo di cellule è caratterizzato da vacuoli giganti contenenti mucina che comprimono il nucleo contro la membrana nucleare fino a formare una mezzaluna.
60x
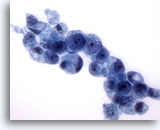
Figura 17
Brushing gastrico, adenocarcinoma gastrico.
Altre cellule ad “anello con castone” con la tipica morfologia.
60x
Figura 17
Brushing gastrico, adenocarcinoma gastrico.
Altre cellule ad “anello con castone” con la tipica morfologia.
60x
Citologia Colica
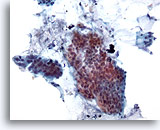
Figura 18
Brushing colico, adenocarcinoma colico.
Il brushing colico consente di individuare cellule epiteliali atipiche a piccolo imgrandimento.
20x
Figura 18
Brushing colico, adenocarcinoma colico.
Il brushing colico consente di individuare cellule epiteliali atipiche a piccolo imgrandimento.
20x
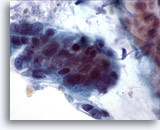
Figura 19
Brushing colico, adenocarcinoma colico.
A forte ingrandimento è possibile osservare pleomorfismo, affollamento e sovrapposizione delle cellule.
60x
Figura 19
Brushing colico, adenocarcinoma colico.
A forte ingrandimento è possibile osservare pleomorfismo, affollamento e sovrapposizione delle cellule.
60x
Citologia Pancreatica
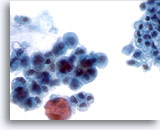
Figura 20
Brushing del dotto pancreatico, adenocarcinoma pancreatico.
Brushing pancreatico che presenta le caratteristiche citologiche dell’adenocarcinoma. È possibile eseguire un confronto con l’epitelio non neoplastico adiacente.
40x
Figura 20
Brushing del dotto pancreatico, adenocarcinoma pancreatico.
Brushing pancreatico che presenta le caratteristiche citologiche dell’adenocarcinoma. È possibile eseguire un confronto con l’epitelio non neoplastico adiacente.
40x
Citologia Del Dotto Biliare
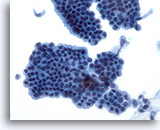
Figura 21
Brushing del dotto biliare, epitelio del dotto biliare normale.
Foglietto a nido d’ape di cellule epiteliali senza atipia.
40x
Figura 21
Brushing del dotto biliare, epitelio del dotto biliare normale.
Foglietto a nido d’ape di cellule epiteliali senza atipia.
40x

Figura 22
Brushing del dotto biliare, colangiocarcinoma.
Cellule epiteliali maligne accanto a un epitelio del dotto biliare normale.
20x
Figura 22
Brushing del dotto biliare, colangiocarcinoma.
Cellule epiteliali maligne accanto a un epitelio del dotto biliare normale.
20x
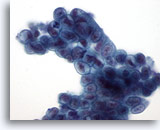
Figura 23
Brushing del dotto biliare, adenocarcinoma mucinoso ben differenziato.
Gruppo sinciziale di epitelio mucinoso con ipercromasia nucleare e membrane nucleari irregolari.
60x
Figura 23
Brushing del dotto biliare, adenocarcinoma mucinoso ben differenziato.
Gruppo sinciziale di epitelio mucinoso con ipercromasia nucleare e membrane nucleari irregolari.
60x
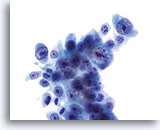
Figura 24
Brushing del dotto biliare, colangiocarcinoma.
Adenocarcinoma scarsamente differenziato con marcata atipia nucleare e nucleoli prominenti.
60x
Figura 24
Brushing del dotto biliare, colangiocarcinoma.
Adenocarcinoma scarsamente differenziato con marcata atipia nucleare e nucleoli prominenti.
60x
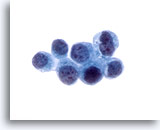
Figura 25
Brushing del dotto biliare, carcinoma metastatico del seno.
Adenocarcinoma metastatico del seno. La diagnosi è stata confermata grazie all’utilizzo di hjncolorazioni immunoistochimiche.
60x
Figura 25
Brushing del dotto biliare, carcinoma metastatico del seno.
Adenocarcinoma metastatico del seno. La diagnosi è stata confermata grazie all’utilizzo di hjncolorazioni immunoistochimiche.
60x
Citologia Anale
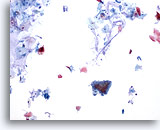
Figura 26
Brushing anale, epitelio ghiandolare normale.
In genere i brushing anali contengono mucina nello sfondo e epitelio squamoso normale e ghiandolare normale. È di solito presente una forte ipercheratosi.
10x
Figura 26
Brushing anale, epitelio ghiandolare normale.
In genere i brushing anali contengono mucina nello sfondo e epitelio squamoso normale e ghiandolare normale. È di solito presente una forte ipercheratosi.
10x
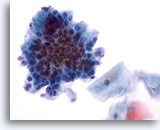
Figura 27
Brushing anale, epitelio ghiandolare normale.
A forte ingrandimento è visibile l’aspetto a palizzata e ad acciottolato.
40x
Figura 27
Brushing anale, epitelio ghiandolare normale.
A forte ingrandimento è visibile l’aspetto a palizzata e ad acciottolato.
40x

Figura 28
Brushing anale, cellule squamose atipiche (ASC).
Le alterazioni riconducibili all’HPV ma non sufficienti per formulare una diagnosi di LSIL vengono inserite nella categoria ASC.
40x
Figura 28
Brushing anale, cellule squamose atipiche (ASC).
Le alterazioni riconducibili all’HPV ma non sufficienti per formulare una diagnosi di LSIL vengono inserite nella categoria ASC.
40x
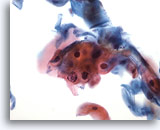
Figura 29
Brushing anale, cellule squamose atipiche (ASC).
La paracheratosi atipica, che non consente la diagnosi di LSIL, viene inserita nella categoria ASC.
40x
Figura 29
Brushing anale, cellule squamose atipiche (ASC).
La paracheratosi atipica, che non consente la diagnosi di LSIL, viene inserita nella categoria ASC.
40x
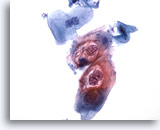
Figura 30
Brushing anale, lesione anale intraepiteliale, basso grado.
Queste cellule mostrano binucleazione e cavitazioni citoplasmatiche associate a infezione da HPV e inducono a formulare una diagnosi di lesione anale intraepiteliale di basso grado.
40x
Figura 30
Brushing anale, lesione anale intraepiteliale, basso grado.
Queste cellule mostrano binucleazione e cavitazioni citoplasmatiche associate a infezione da HPV e inducono a formulare una diagnosi di lesione anale intraepiteliale di basso grado.
40x

Figura 31
Brushing anale, lesione anale intraepiteliale, basso grado.
Cellule metaplastiche squamose con nuclei ingranditi tipiche delle lesioni anali intraepiteliali di basso grado.
40x
Figura 31
Brushing anale, lesione anale intraepiteliale, basso grado.
Cellule metaplastiche squamose con nuclei ingranditi tipiche delle lesioni anali intraepiteliali di basso grado.
40x
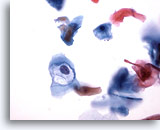
Figura 32
Brushing anale, lesione anale intraepiteliale, basso grado.
La cavitazione provocata dall’HPV consente la diagnosi di lesioni anali intraepiteliali di basso grado.
40x
Figura 32
Brushing anale, lesione anale intraepiteliale, basso grado.
La cavitazione provocata dall’HPV consente la diagnosi di lesioni anali intraepiteliali di basso grado.
40x
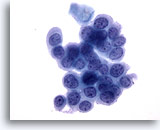
Figura 33
Brushing anale, lesione anale intraepiteliale, alto grado.
Le cellule tondeggianti con rapporti N/C elevati e cromatina uniformemente distribuita presentano le caratteristiche citologiche di una lesione anale intraepiteliale di alto grado.
40x
Figura 33
Brushing anale, lesione anale intraepiteliale, alto grado.
Le cellule tondeggianti con rapporti N/C elevati e cromatina uniformemente distribuita presentano le caratteristiche citologiche di una lesione anale intraepiteliale di alto grado.
40x
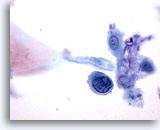
Figura 34
Brushing anale, lesione anale intraepiteliale, alto grado.
Le cellule singole con rapporti N/C elevati e nuclei ipercromici consentono la diagnosi di lesioni anali intraepiteliali di alto grado.
60x
Figura 34
Brushing anale, lesione anale intraepiteliale, alto grado.
Le cellule singole con rapporti N/C elevati e nuclei ipercromici consentono la diagnosi di lesioni anali intraepiteliali di alto grado.
60x
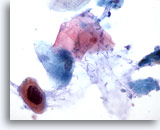
Figura 35
Brushing anale, lesione anale intraepiteliale, alto grado.
Cellule cheratinizzate atipiche con nuclei ipercromici più grandi del normale che possono essere talvolta presenti nelle lesioni anali intraepiteliali di alto grado.
60x
Figura 35
Brushing anale, lesione anale intraepiteliale, alto grado.
Cellule cheratinizzate atipiche con nuclei ipercromici più grandi del normale che possono essere talvolta presenti nelle lesioni anali intraepiteliali di alto grado.
60x
Torna a inizio pagina
Ritorna alla Indice dei contenuti



































