Citología de aspiración con aguja fina - CABEZA, CUELLO Y NÓDULOS LINFÁTICOS
CABEZA, CUELLO Y NÓDULOS LINFÁTICOS
Stan A. Lightfoot, MD
La aspiración con aguja fina (PAAF) de la cabeza y del cuello puede organizarse de numerosas maneras, pero se divide preferiblemente en dos grupos: bultos y protuberancias y lesiones de la glándula salival.
Bultos y protuberancias
El historial y la edad del paciente son muy importantes. En los niños, la mayor parte de estas lesiones son benignas e inflamatorias. En los adultos, la mayoría de las lesiones son malignas, siendo la causa más común el carcinoma escamoso metastásico. El historial es esencial en este caso. La mayor parte de los carcinomas escamosos metastásicos del cuello provienen de la orofaringe, aunque a veces pueden provenir del pulmón y, aún menos a menudo, de un carcinoma escamoso de la cabeza o la cara. En este último caso, ya se ha diagnosticado un cáncer de piel y se trata de un cáncer que ha invadido profundamente la dermis o que es de amplia duración.
El carcinoma pulmonar no suele producir metástasis en los nódulos del cuello, por lo que deja a la orofaringe como el sitio de la lesión primaria. De nuevo, el historial es importante, ya que al 80% de los pacientes ya se les ha diagnosticado previamente un cáncer orofaríngeo, por lo que se debe realizar una PAAF para conocer el estadío o para evaluar la recurrencia. En nuestra institución, en el 20% de los casos la presentación primaria del paciente es un carcinoma escamoso metastásico en un nódulo linfático del cuello. Si la célula escamosa del nódulo se encuentra en contacto íntimo con linfocitos maduros, este hecho sugiere fuertemente un tumor primario nasofaríngeo. En caso contrario, las características morfológicas son poco útiles para la localización de la fuente primaria. Cuando se procesa este 20%, se observa que un cierto número de ellos no presenta síntomas o signos que ayuden a determinar la lesión primaria. En dichos casos, se deben realizar biopsias a ciegas de la nasofaringe, la amígdala y las cuerdas vocales. En nuestra institución, si no se encuentra un tumor, el paciente recibe irradiación en toda la cabeza y la región del cuello. Esto permite obtener unas tasas de supervivencia de 5 años en el 70% de los casos.
Los bultos y protuberancias también pueden ser melanomas metastásicos malignos, especialmente en la población rural del sur que sufre una elevada exposición al sol. El cuello es el sitio favorito para esta lesión y debe tenerse en cuenta, ya que puede confundirse con un linfoma, una enfermedad de Hodgkin o un carcinoma. Volveremos sobre este tema cuando hablemos posteriormente de las lesiones de la glándula salival.
Si la PAAF muestra una proliferación linfoide atípica, deberá realizarse un examen de citometría de flujo sobre la muestra. El examen de este caso se simplifica con la preparación de al menos un portaobjetos teñido de Wright, además de varios portaobjetos ThinPrep® teñidos con técnica de Papanicolaou de todas las lesiones linfoides. Existen varias ayudas en lo que respecta a las lesiones linfoides y a la PAAF. ¿Los linfocitos presentan morfología homogénea o heterogénea? ¿Existen hendiduras y cortes en la membrana nuclear? ¿Se observa la presencia de nucleolos? La utilidad de estas características se discute en las ilustraciones adjuntas.
Los bultos y protuberancias también pueden deberse a quistes benignos. En el cuello, los dos quistes benignos más comunes son el quiste de la hendidura branquial y el quiste del conducto tirogloso. Ambos contienen numerosos macrófagos y una amplia variedad de otras células. Los quistes pueden contener células escamosas atípicas que pueden generar un falso positivo en el diagnóstico de la enfermedad metastásica. Si el quiste es tenso, y frecuentemente lo es, puede mostrarse muy firme al tacto. Por ello, tenga en cuenta que, en presencia de macrófagos, no se trata de un quiste benigno aunque existan células escamosas atípicas ocasionales.
He dejado la PAAF de la glándula salival para el final de esta discusión, ya que se trata del tema más complejo y que requiere mayor experiencia. La PAAF de la glándula salival puede resultar muy fácil, como en un tumor de Warthin, o difícil, como en un carcinoma adenoide quístico. No obstante, para ser competente en esta área se necesita mucha experiencia, y ésta no puede adquirirse leyendo un libro. Existen varios puntos claves en la citología de estas glándulas. La parótida es el sitio favorito para la enfermedad metastásica, notablemente el carcinoma escamoso. Así, si la PAAF muestra únicamente un carcinoma escamoso bien diferenciado, casi siempre es metastásico en la parótida. Al igual que sucedía en el cuello, los carcinomas pulmonares no suelen pasarse a la parótida, por lo que un carcinoma de células pequeñas en la parótida puede, de hecho, ser una lesión primaria. El pulmón debe descartarse pero, según nuestra experiencia, el carcinoma de células pequeñas en la parótida suele ser primario. Y el melanoma maligno, conforme a su designación de gran imitador, puede complicar el diagnóstico de las lesiones de la parótida. Como ejemplo diremos que hemos tenido casos recientes de carcinoma parotídeo y de carcinoma mucoepidermoide presumiblemente primarios que eran, en realidad, melanomas metastásicos malignos.
Querría dar las gracias a Susan Townsend, CT(ASCP), y Vala Williams, Técnico preparatorio, por su ayuda en este proyecto.
Bibliografía
- Al-Khafaji BM, Afify AM: Salivary gland fine needle aspiration using the ThinPrep technique. Acta Cytol 2001; 45:567-74.
- Ford L, Rasgon BM, Hilsinger RL, Cruz RM, Axelsson K, Rumore GJ, Schmidtknecht TM, Puligandla B, Sawicki J, Pshea W: Comparison of ThinPrep versus conventional smear cytopreparatory techniques for fine-needle aspiration specimens of head and neck masses. Otolaryngol Head Neck Surg 2002; 126(5):554-61.
- Leon ME, Deschler D, Wu SS, Galindo LM: Fine needle aspiration diagnosis of lipoblastoma of the parotid region. Acta Cytol 2002; 46(2): 395-404.
- Chen VS M, Qizilbash A , and Young JE : Guides to Clinical Aspiration Biopsy, Head and Neck, 2nd edition. Igaku-shoin Ltd; Tokyo, 1996.
¿Qué papel juega la tecnología ThinPrep® en el diagnóstico de PAAF de este área? La mejor forma de contestar a esta pregunta es echar un vistazo a los ejemplos:
Atlas para ver la imagen aumentada
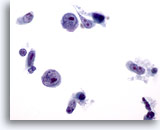
PAAF de cuello, quiste benigno.
Presencia de una mezcla de células que contiene células escamosas benignas y pequeñas células inflamatorias. También se observa abundante queratina. 20x
PAAF de cuello, quiste benigno.
Presencia de una mezcla de células que contiene células escamosas benignas y pequeñas células inflamatorias. También se observa abundante queratina.
20x
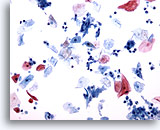
PAAF de cuello, quiste benigno.
En este aspirado de observan células escamosas benignas, células inflamatorias y queratina. Observe la presencia de células metaplásicas escamosas benignas. Esto aparece frecuentemente en la aspiración de quistes. 40x
PAAF de cuello, quiste benigno.
En este aspirado de observan células escamosas benignas, células inflamatorias y queratina. Observe la presencia de células metaplásicas escamosas benignas. Esto aparece frecuentemente en la aspiración de quistes.
40x
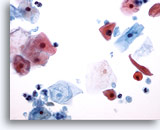
PAAF de cuello, quiste de la hendidura branquial.
La presencia de células escamosas maduras, restos de queratina y células escamosas anucleadas es indicativa de un proceso quístico benigno. 10x
PAAF de cuello, quiste de la hendidura branquial.
La presencia de células escamosas maduras, restos de queratina y células escamosas anucleadas es indicativa de un proceso quístico benigno.
10x
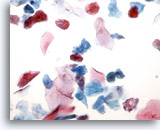
PAAF de cuello, quiste de la hendidura branquial.
También conocidos como quistes linfoepiteliales, suelen aparecer en las zonas laterales del cuello. 40x
PAAF de cuello, quiste de la hendidura branquial.
También conocidos como quistes linfoepiteliales, suelen aparecer en las zonas laterales del cuello.
40x
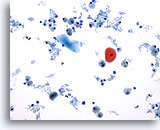
PAAF de cuello, quiste del conducto tirogloso.
Restos quísticos, histiocitos y células escamosas benignas indicativos de un proceso quístico benigno.20x
PAAF de cuello, quiste del conducto tirogloso
Restos quísticos, histiocitos y células escamosas benignas indicativos de un proceso quístico benigno.
20x
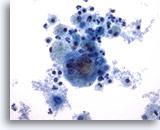
PAAF de cuello, quiste del conducto tirogloso.
Situado en la línea central del cuello, estos quistes están recubiertos con epitelio columnar o escamoso que puede o no observarse en la aspiración. 40x
PAAF de cuello, quiste del conducto tirogloso
Situado en la línea central del cuello, estos quistes están recubiertos con epitelio columnar o escamoso que puede o no observarse en la aspiración.
40x
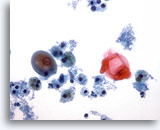
PAAF de cuello, quiste del conducto tirogloso.
Este quiste contiene epitelio escamoso maduro. Algunos PAAF pueden no ser diagnósticos. 40x
PAAF de cuello, quiste del conducto tirogloso
Este quiste contiene epitelio escamoso maduro. Algunos PAAF pueden no ser diagnósticos.
40x
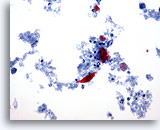
PAAF de cuello, sospecha de carcinoma escamoso.
En el centro de la foto aparece una célula escamosa con un núcleo atípico ligeramente aumentado. Está rodeado de células inflamatorias, queratina y material necrótico. 20x
PAAF de cuello, sospecha de carcinoma escamoso.
En el centro de la foto aparece una célula escamosa con un núcleo atípico ligeramente aumentado. Está rodeado de células inflamatorias, queratina y material necrótico.
20x
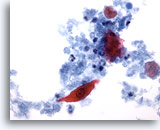
PAAF de cuello, sospecha de carcinoma escamoso.
La célula atípica se distingue más claramente. El núcleo está aumentado, pero presenta una membrana nuclear totalmente homogénea y es perfectamente oval. Está rodeado nuevamente de queratina, células inflamatorias y restos necróticos. 40x
PAAF de cuello, sospecha de carcinoma escamoso.
La célula atípica se distingue más claramente. El núcleo está aumentado, pero presenta una membrana nuclear totalmente homogénea y es perfectamente oval. Está rodeado nuevamente de queratina, células inflamatorias y restos necróticos.
40x
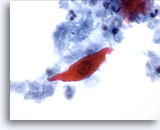
PAAF de cuello, sospecha de carcinoma escamoso.
Células con una morfología similar se pueden producir en un quiste benigno. Por ello, este hallazgo no puede servir como único factor para realizar un diagnóstico inequívoco de malignidad. 60x
PAAF de cuello, sospecha de carcinoma escamoso.
Células con una morfología similar se pueden producir en un quiste benigno. Por ello, este hallazgo no puede servir como único factor para realizar un diagnóstico inequívoco de malignidad.
60x
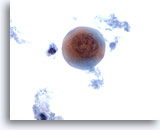
PAAF de cuello, sospecha de carcinoma escamoso.
Aparece una célula metaplásica escamosa altamente atípica. La célula es redondeada y el citoplasma contiene queratina. La membrana nuclear es irregular y la cromatina está separada en pequeños haces discretos. Este tipo de célula puede suponer un dato de peso para dictaminar que la lesión ha sido eliminada. 60x
PAAF de cuello, sospecha de carcinoma escamoso.
Aparece una célula metaplásica escamosa altamente atípica. La célula es redondeada y el citoplasma contiene queratina. La membrana nuclear es irregular y la cromatina está separada en pequeños haces discretos. Este tipo de célula puede suponer un dato de peso para dictaminar que la lesión ha sido eliminada.
60x
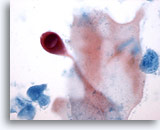
PAAF de cuello, sospecha de carcinoma escamoso.
La célula central es una pequeña célula metaplásica escamosa con un núcleo ovalado aumentado y una membrana nuclear homogénea. 60x
PAAF de cuello, sospecha de carcinoma escamoso.
La célula central es una pequeña célula metaplásica escamosa con un núcleo ovalado aumentado y una membrana nuclear homogénea.
60x
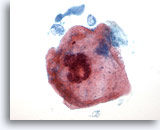
PAAF de cuello, sospecha de carcinoma escamoso.
Una gran célula escamosa con un gran núcleo degenerado. Los filamentos de queratina se encuentran cerca de la periferia de la célula. 60x
PAAF de cuello, sospecha de carcinoma escamoso.
Una gran célula escamosa con un gran núcleo degenerado. Los filamentos de queratina se encuentran cerca de la periferia de la célula.
60x
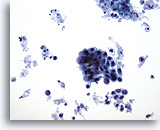
PAAF de cuello, carcinoma poco diferenciado
Se observan dos grupos de células. El grupo grande e irregular presenta contornos irregulares y núcleos pleomórficos. Las células del grupo más pequeño exhiben pérdida de cohesión y presentan una relación núcleo/citoplasma aumentada en esta ampliación. El fondo contiene restos necróticos. 20x
PAAF de cuello, carcinoma poco diferenciado
Se observan dos grupos de células. El grupo grande e irregular presenta contornos irregulares y núcleos pleomórficos. Las células del grupo más pequeño exhiben pérdida de cohesión y presentan una relación núcleo/citoplasma aumentada en esta ampliación. El fondo contiene restos necróticos.
20x
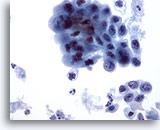
PAAF de cuello, carcinoma poco diferenciado.
El pleomorfismo y la hipercromasia del grupo más grande de células es más claro que a 20x. Ni la diferenciación citoplásmica ni la nuclear proporcionan evidencias de sitio primario. 40x
PAAF de cuello, carcinoma poco diferenciado
El pleomorfismo y la hipercromasia del grupo más grande de células es más claro que a 20x. Ni la diferenciación citoplásmica ni la nuclear proporcionan evidencias de sitio primario.
40x
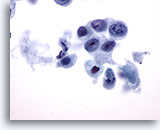
PAAF de cuello, carcinoma poco diferenciado.
Este carcinoma exhibe una clara pérdida de cohesión. Los núcleos son irregulares y presentan agrupamiento de cromatina. Existe un gran aumento en la relación núcleo/citoplasma. Los nucleolos son prominentes y difieren en número de una célula a otra. 60x
PAAF de cuello, carcinoma poco diferenciado
Este carcinoma exhibe una clara pérdida de cohesión. Los núcleos son irregulares y presentan agrupamiento de cromatina. Existe un gran aumento en la relación núcleo/citoplasma. Los nucleolos son prominentes y difieren en número de una célula a otra.
60x
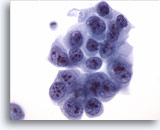
PAAF de cuello, carcinoma poco diferenciado.
Este gran grupo presenta todas las características primarias de malignidad. Las membranas nucleares irregulares y los hendiduras pueden verse claramente, así como el agrupamiento de cromatina y el aclaramiento de paracromatina. 60x
PAAF de cuello, carcinoma poco diferenciado
Este gran grupo presenta todas las características primarias de malignidad. Las membranas nucleares irregulares y los hendiduras pueden verse claramente, así como el agrupamiento de cromatina y el aclaramiento de paracromatina.
60x
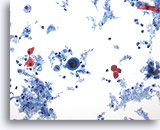
PAAF de cuello, carcinoma escamoso.
Una gran célula maligna que está rodeada de pequeñas células escamosas benignas, restos celulares, inflamación y queratina. 20x
PAAF de cuello, carcinoma escamoso
Una gran célula maligna que está rodeada de pequeñas células escamosas benignas, restos celulares, inflamación y queratina.
20x
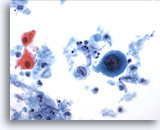
PAAF de cuello, carcinoma escamoso.
Esta célula maligna con un núcleo grande colocado en el centro presenta citoplasma cianófilo denso, indicativo de queratinización y característico de una célula escamosa. 40x
PAAF de cuello, carcinoma escamoso.
Esta célula maligna con un núcleo grande colocado en el centro presenta citoplasma cianófilo denso, indicativo de queratinización y característico de una célula escamosa.
40x
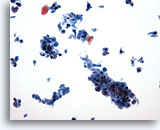
Ésta es una malignidad poco diferenciada y que facilita la clasificación gracias al hecho de que la queratina está presente en el fondo de las células malignas. (No es habitual observar células escamosas bien diferenciadas y poco diferenciadas a la vez en una PAAF del cuello. Las células bien diferenciadas establecen la identidad). Existen dos grandes grupos de células y un fondo necrótico. 20x
PAAF de cuello, carcinoma escamoso.
Ésta es una malignidad poco diferenciada y que facilita la clasificación gracias al hecho de que la queratina está presente en el fondo de las células malignas. (No es habitual observar células escamosas bien diferenciadas y poco diferenciadas a la vez en una PAAF del cuello. Las células bien diferenciadas establecen la identidad). Existen dos grandes grupos de células y un fondo necrótico.
20x
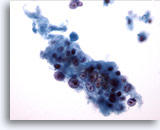
PAAF de cuello, carcinoma escamoso.
Observe el gran nucleolo irregular en el área inferior central del grupo de células malignas. Las membranas nucleares están definidas por el agrupamiento de cromatina. 40x
PAAF de cuello, carcinoma escamoso.
Observe el gran nucleolo irregular en el área inferior central del grupo de células malignas. Las membranas nucleares están definidas por el agrupamiento de cromatina.
40x
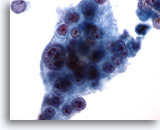
PAAF de cuello, carcinoma escamoso.
Observe la excelente conservación de la células malignas. El detalle nuclear es exquisito. 60x
PAAF de cuello, carcinoma escamoso.
Observe la excelente conservación de la células malignas. El detalle nuclear es exquisito.
60x
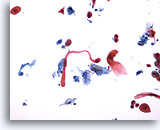
PAAF de cuello, carcinoma escamoso.
El diagnóstico es fácil por la presencia de una célula escamosa con forma de renacuajo con un núcleo citológicamente maligno. Justo encima y a la derecha se observan dos células metaplásicas escamosas malignas. En la parte inferior derecha hay otra célula metaplásica escamosa maligna. La necrosis tumoral está presente en el fondo. 20x
PAAF de cuello, carcinoma escamoso.
El diagnóstico es fácil por la presencia de una célula escamosa con forma de renacuajo con un núcleo citológicamente maligno. Justo encima y a la derecha se observan dos células metaplásicas escamosas malignas. En la parte inferior derecha hay otra célula metaplásica escamosa maligna. La necrosis tumoral está presente en el fondo.
20x
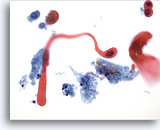
PAAF de cuello, carcinoma escamoso.
La célula escamosa queratinizante maligna con forma de renacuajo y las dos células metaplásicas escamosas malignas se observan claramente. La queratina está presente y la necrosis tumoral rodea las células. 40x
PAAF de cuello, carcinoma escamoso.
La célula escamosa queratinizante maligna con forma de renacuajo y las dos células metaplásicas escamosas malignas se observan claramente. La queratina está presente y la necrosis tumoral rodea las células.
40x
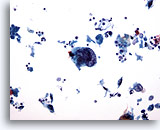
En esta foto se observa una célula maligna extremadamente grande. Observe que, justo encima de esta célula, hay tres linfocitos que permiten hacer una comparación precisa del tamaño de esta inmensa célula. Además, también se puede observar una dispersión de otras células malignas junto con algunos restos celulares. La diferenciación escamosa es evidente en las células más pequeñas que se encuentran en el campo, y en la adherencia a la superficie de esta célula maligna. 20x
PAAF de cuello, carcinoma escamoso.
En esta foto se observa una célula maligna extremadamente grande. Observe que, justo encima de esta célula, hay tres linfocitos que permiten hacer una comparación precisa del tamaño de esta inmensa célula. Además, también se puede observar una dispersión de otras células malignas junto con algunos restos celulares. La diferenciación escamosa es evidente en las células más pequeñas que se encuentran en el campo, y en la adherencia a la superficie de esta célula maligna.
20x
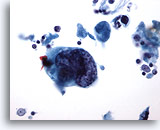
PAAF de cuello, carcinoma escamoso.
En la foto, la gran célula contrasta con los pequeños linfocitos. La pequeña célula escamosa maligna puede distinguirse más claramente. Arriba y a la derecha hay una célula escamosa maligna bien formada con un núcleo intensamente hipercromático y un citoplasma grueso bien definido. 40x
PAAF de cuello, carcinoma escamoso.
En la foto, la gran célula contrasta con los pequeños linfocitos. La pequeña célula escamosa maligna puede distinguirse más claramente. Arriba y a la derecha hay una célula escamosa maligna bien formada con un núcleo intensamente hipercromático y un citoplasma grueso bien definido.
40x
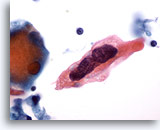
PAAF de cuello, carcinoma escamoso.
Se distingue claramente una inmensa célula escamosa maligna. Observe nuevamente los dos linfocitos de la foto. La cromatina nuclear aparece removida en esta foto. Se observa de una visión prácticamente tridimensional de esta célula. 60x
PAAF de cuello, carcinoma escamoso
Se distingue claramente una inmensa célula escamosa maligna. Observe nuevamente los dos linfocitos de la foto. La cromatina nuclear aparece removida en esta foto. Se observa de una visión prácticamente tridimensional de esta célula.
60x
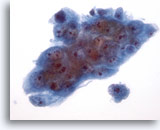
PAAF de parótida, carcinoma mucoepidermoide de alto grado.
Los criterios citológicos permiten diagnosticar un carcinoma poco diferenciado. 40x
PAAF de parótida, carcinoma mucoepidermoide de alto grado
Los criterios citológicos permiten diagnosticar un carcinoma poco diferenciado.
40x
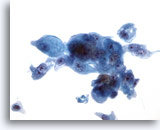
PAAF de parótida, carcinoma mucoepidermoide de alto grado.
Se demostró la presencia de mucina intracelular mediante una tinción de mucicarmín. 40x
PAAF de parótida, carcinoma mucoepidermoide de alto grado
Se demostró la presencia de mucina intracelular mediante una tinción de mucicarmín.
40x
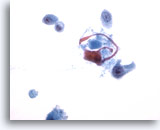
PAAF de parótida, carcinoma mucoepidermoide de alto grado.
Presencia de una población maligna de células escamosas. 40x
PAAF de parótida, carcinoma mucoepidermoide de alto grado
Presencia de una población maligna de células escamosas.
40x
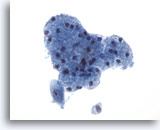
PAAF de parótida, carcinoma mucoepidermoide de alto grado.
Una célula maligna adyacente al tejido salivar benigno evidencia la posición del tumor. 40x
PAAF de parótida, carcinoma mucoepidermoide de alto grado
Una célula maligna adyacente al tejido salivar benigno evidencia la posición del tumor.
40x
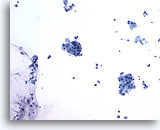
PAAF de parótida, sospecha de carcinoma mucoepidermoide de bajo grado.
En la imagen a bajo aumento resultan evidentes el tejido de la glándula salivar aparentemente benigno, restos celulares y mucina. 20x
PAAF de parótida, sospecha de carcinoma mucoepidermoide de bajo grado.
En la imagen a bajo aumento resultan evidentes el tejido de la glándula salivar aparentemente benigno, restos celulares y mucina.
20x
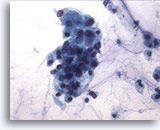
PAAF de parótida, sospecha de carcinoma mucoepidermoide de bajo grado.
Presencia de pequeños nucleolos en los núcleos blandos de los grupos celulares. 40x
PAAF de parótida, sospecha de carcinoma mucoepidermoide de bajo grado.
Presencia de pequeños nucleolos en los núcleos blandos de los grupos celulares.
40x
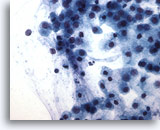
PAAF de parótida, sospecha de carcinoma mucoepidermoide de bajo grado.
Numerosas células pequeñas están flotando en un fondo mucinoso. El diagnóstico diferencial incluye un mucocele. 40x
PAAF de parótida, sospecha de carcinoma mucoepidermoide de bajo grado.
Numerosas células pequeñas están flotando en un fondo mucinoso. El diagnóstico diferencial incluye un mucocele.
40x
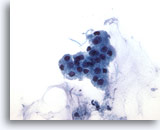
PAAF de parótida, sospecha de carcinoma mucoepidermoide de bajo grado.
Si en la mucina no se ha realizado un diagnóstico benigno, puede considerarse como un falso negativo. 40x
PAAF de parótida, sospecha de carcinoma mucoepidermoide de bajo grado.
Si en la mucina no se ha realizado un diagnóstico benigno, puede considerarse como un falso negativo.
40x
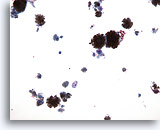
PAAF de cuello, melanoma maligno.
En este foto aparecen numerosas células aisladas y grupos de células que contienen pigmentos. En el centro hay una célula aislada plasmacitoide maligna, además de núcleos desnudos. 20x
PAAF de cuello, melanoma maligno.
En este foto aparecen numerosas células aisladas y grupos de células que contienen pigmentos. En el centro hay una célula aislada plasmacitoide maligna, además de núcleos desnudos.
20x
PAAF de cuello, melanoma maligno.
Los dos grupos celulares observados a 20x contienen melanina marrón que permite determinar que se trata de un melanoma. La célula inferior es claramente plasmocitoide con un núcleo oval y nucleolo aislado. 60x
PAAF de cuello, melanoma maligno.
Los dos grupos celulares observados a 20x contienen melanina marrón que permite determinar que se trata de un melanoma. La célula inferior es claramente plasmocitoide con un núcleo oval y nucleolo aislado.
60x
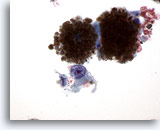
PAAF de cuello, melanoma maligno.
El melanoma es un gran mimético de otras malignidades. En esta foto se observa un grupo de células poco cohesionadas que son malignas, pero cuya identidad no podría determinarse si no fuera porque existe abundante melanina citoplásmica. Observe la excelente conservación de las células y de los gránulos de melanina. 60x
PAAF de cuello, melanoma maligno.
El melanoma es un gran mimético de otras malignidades. En esta foto se observa un grupo de células poco cohesionadas que son malignas, pero cuya identidad no podría determinarse si no fuera porque existe abundante melanina citoplásmica. Observe la excelente conservación de las células y de los gránulos de melanina.
60x
En esta foto aparece un agregado pleomórfico de células aisladas. El pigmento parduzco puede distinguirse claramente incluso a este aumento, especialmente en el centro de la foto. Justo debajo de la célula binucleada de la derecha aparece una célula plasmocitoide con un inmenso nucleolo. Incluso a este aumento, el melanoma se diagnostica fácilmente. 20x
PAAF de nódulo linfático axilar, melanoma maligno.
En esta foto aparece un agregado pleomórfico de células aisladas. El pigmento parduzco puede distinguirse claramente incluso a este aumento, especialmente en el centro de la foto. Justo debajo de la célula binucleada de la derecha aparece una célula plasmocitoide con un inmenso nucleolo. Incluso a este aumento, el melanoma se diagnostica fácilmente.
20x
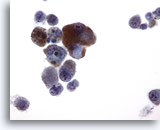
PAAF de nódulo linfático axilar, melanoma maligno.
La fina granularidad de la melanina y su coloración son fácilmente apreciables a este aumento. Los núcleos son excéntricos con nucleolos prominentes. Las células están aisladas. 40x
PAAF de nódulo linfático axilar, melanoma maligno.
La fina granularidad de la melanina y su coloración son fácilmente apreciables a este aumento. Los núcleos son excéntricos con nucleolos prominentes. Las células están aisladas.
40x
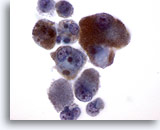
PAAF de nódulo linfático axilar, melanoma maligno.
El mismo grupo celular a un aumento mayor. Observe las características de la melanina. En estas células malignas queda representada de forma ideal. 60x
PAAF de nódulo linfático axilar, melanoma maligno.
El mismo grupo celular a un aumento mayor. Observe las características de la melanina. En estas células malignas queda representada de forma ideal.
60x

PAAF de nódulo linfático axilar, melanoma maligno.
Se observa la presencia de una célula gigante multinucleada de melanoma. 60x
PAAF de nódulo linfático axilar, melanoma maligno.
Se observa la presencia de una célula gigante multinucleada de melanoma.
60x
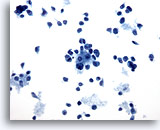
PAAF de nódulo linfático, melanoma maligno.
A este aumento se observan tres pequeños grupos de células. Entremezcladas existen numerosas células aisladas sin citoplasma o con citoplasma mínimo. El pleomorfismo y la hipercromasia sugieren fuertemente una malignidad, pero no se aprecia el tipo. 20x
PAAF de nódulo linfático, melanoma maligno.
A este aumento se observan tres pequeños grupos de células. Entremezcladas existen numerosas células aisladas sin citoplasma o con citoplasma mínimo. El pleomorfismo y la hipercromasia sugieren fuertemente una malignidad, pero no se aprecia el tipo.
20x
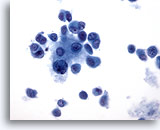
PAAF de nódulo linfático, melanoma maligno.
Tres células tiene un citoplasma bien definido, mientras que el resto parecen presentar un citoplasma casi sincitial. Los núcleos no muestran evidencia del lugar de origen. Las tres células con el citoplasma bien definido podrían considerarse plasmocitoides y dan una idea de la fuente de tumor primario. 40x
PAAF de nódulo linfático, melanoma maligno.
Tres células tiene un citoplasma bien definido, mientras que el resto parecen presentar un citoplasma casi sincitial. Los núcleos no muestran evidencia del lugar de origen. Las tres células con el citoplasma bien definido podrían considerarse plasmocitoides y dan una idea de la fuente de tumor primario.
40x
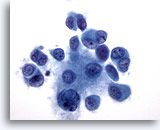
PAAF de nódulo linfático, melanoma maligno.
PAAF de nódulo linfático, melanoma maligno.
Una imagen a mayor aumento que refleja las mismas características que en la foto anterior. 60x
PAAF de nódulo linfático, melanoma maligno.
PAAF de nódulo linfático, melanoma maligno.
Una imagen a mayor aumento que refleja las mismas características que en la foto anterior.
60x
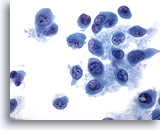
PAAF de nódulo linfático, melanoma maligno.
Las células en la esquina inferior muestran una inclusión citoplásmica intranuclear que es característica, aunque no diagnóstica, del melanoma maligno. 60x
PAAF de nódulo linfático, melanoma maligno.
Las células en la esquina inferior muestran una inclusión citoplásmica intranuclear que es característica, aunque no diagnóstica, del melanoma maligno
60x
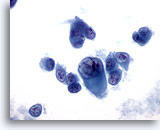
PAAF de nódulo linfático, melanoma maligno.
La gran célula maligna plasmocitoide muestra una inclusión intranuclear, y aparece un inmenso nucleolo en una segunda célula maligna. Ambas son características del melanoma. 60x
PAAF de nódulo linfático, melanoma maligno.
La gran célula maligna plasmocitoide muestra una inclusión intranuclear, y aparece un inmenso nucleolo en una segunda célula maligna. Ambas son características del melanoma.
60x
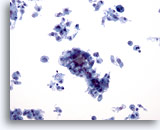
El grupo celular del centro de la diapositiva es suficiente para diagnosticar el carcinoma, pero la identificaciñón del tumor primario depende de una evaluación clínica adicional. Alrededor del grupo grande hay células con citoplasma excéntrico (plasmocitoides). El grupo cohesionado acoplado a estas células es compatible con el carcinoma pulmonar. 20x
PAAF de nódulo linfático cervical, carcinoma metastásico compatible con tumor primario pulmonar.
El grupo celular del centro de la diapositiva es suficiente para diagnosticar el carcinoma, pero la identificaciñón del tumor primario depende de una evaluación clínica adicional. Alrededor del grupo grande hay células con citoplasma excéntrico (plasmocitoides). El grupo cohesionado acoplado a estas células es compatible con el carcinoma pulmonar.
20x
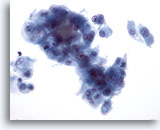
PAAF de nódulo linfático cervical, carcinoma pulmonar metastásico.
El grupo cohesionado presenta una configuración tridimensional compatible con el adenocarcinoma, de tumor pulmonar primario.
40x
PAAF de nódulo linfático cervical, carcinoma pulmonar metastásico.
El grupo cohesionado presenta una configuración tridimensional compatible con el adenocarcinoma, de tumor pulmonar primario.
40x
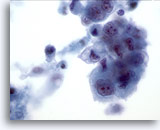
PAAF de nódulo linfático cervical, carcinoma pulmonar metastásico.
Tenga en cuenta la célula en el centro con una vacuola citoplásmica y una mancha aislada de mucina en su centro. Estas características son compatibles con un adenocarcinoma pulmonar primario. 60x
PAAF de nódulo linfático cervical, carcinoma pulmonar metastásico.
Tenga en cuenta la célula en el centro con una vacuola citoplásmica y una mancha aislada de mucina en su centro. Estas características son compatibles con un adenocarcinoma pulmonar primario.
60x

PAAF de nódulo linfático supraclavicular, carcinoma no diferenciado de células pequeñas.
Imagen de una muestra muy celular con algunos grupos. Las células son ligeramente más grandes que un linfocito y son hipercromáticas. No se observa el citoplasma. Este patrón es compatible con el carcinoma de células pequeñas. 20x
PAAF de nódulo linfático supraclavicular, carcinoma no diferenciado de células pequeñas.
Imagen de una muestra muy celular con algunos grupos. Las células son ligeramente más grandes que un linfocito y son hipercromáticas. No se observa el citoplasma. Este patrón es compatible con el carcinoma de células pequeñas.
20x
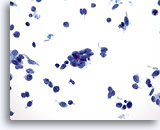
PAAF de nódulo linfático supraclavicular, carcinoma no diferenciado de células pequeñas.
El grupo en el centro exhibe amoldamiento nuclear. El leve pleomorfismo, el marcado aumento de la relación núcleo/citoplasma y la ausencia de nucleolos apuntan al carcinoma de células pequeñas. 60x
PAAF de nódulo linfático supraclavicular, carcinoma no diferenciado de células pequeñas.
El grupo en el centro exhibe amoldamiento nuclear. El leve pleomorfismo, el marcado aumento de la relación núcleo/citoplasma y la ausencia de nucleolos apuntan al carcinoma de células pequeñas.
60x
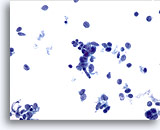
PAAF de nódulo linfático supraclavicular, carcinoma no diferenciado de células pequeñas.
Observe la ausencia de artefacto de aplastamiento. Las células están bien conservadas y presentan, nuevamente, todas las características de un carcinoma de células pequeñas. 60x
PAAF de nódulo linfático supraclavicular, carcinoma no diferenciado de células pequeñas.
Observe la ausencia de artefacto de aplastamiento. Las células están bien conservadas y presentan, nuevamente, todas las características de un carcinoma de células pequeñas.
60x
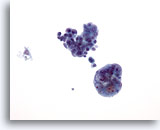
PAAF de nódulo linfático, adenocarcinoma endometrial metastásico.
Ésta sería una PAAF de estadificación. No se utilizaría normalmente para el tratamiento de un tumor no sospechoso. Se muestran dos grandes grupos de células cohesionadas comprimidas que no pertenecen a un nódulo linfático, por lo que se determina que se trata de un carcinoma metastásico. 20x
PAAF de nódulo linfático, adenocarcinoma endometrial metastásico.
Ésta sería una PAAF de estadificación. No se utilizaría normalmente para el tratamiento de un tumor no sospechoso. Se muestran dos grandes grupos de células cohesionadas comprimidas que no pertenecen a un nódulo linfático, por lo que se determina que se trata de un carcinoma metastásico.
20x
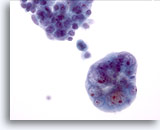
PAAF de nódulo linfático, adenocarcinoma endometrial metastásico.
El grupo celular que aparece en la mitad inferior de la foto presenta núcleos pleomórficos con nucleolos prominentes y material nuclear aplastado contra la membrana nuclear. La relación núcleo/citoplasma es elevada. 40x
PAAF de nódulo linfático, adenocarcinoma endometrial metastásico.
El grupo celular que aparece en la mitad inferior de la foto presenta núcleos pleomórficos con nucleolos prominentes y material nuclear aplastado contra la membrana nuclear. La relación núcleo/citoplasma es elevada.
40x
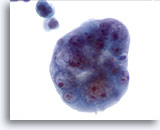
PAAF de nódulo linfático, adenocarcinoma endometrial metastásico.
El grupo presenta una forma tipo bola y la claridad de las células es impresionante. Observe el aclaramiento del material nuclear, ya que parece que se encuentra todo localizado en la membrana nuclear. 60x
PAAF de nódulo linfático, adenocarcinoma endometrial metastásico.
El grupo presenta una forma tipo bola y la claridad de las células es impresionante. Observe el aclaramiento del material nuclear, ya que parece que se encuentra todo localizado en la membrana nuclear.
60x
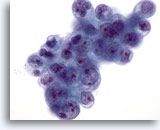
PAAF de nódulo linfático, adenocarcinoma endometrial metastásico.
Esta placa de células malignas muestra nuevamente las mismas características nucleares y presenta también vacuolización citoplásmica. Observe la irregularidad de las membranas nucleares y los prominentes nucleolos que pueden observarse en esta foto. 60x
PAAF de nódulo linfático, adenocarcinoma endometrial metastásico.
Esta placa de células malignas muestra nuevamente las mismas características nucleares y presenta también vacuolización citoplásmica. Observe la irregularidad de las membranas nucleares y los prominentes nucleolos que pueden observarse en esta foto.
60x
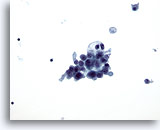
PAAF de nódulo linfático cervical, carcinoma papilar metastásico de tiroides.
Un grupo cohesionado e irregular de células dentro del nódulo linfático determina el diagnóstico de carcinoma. 20x
PAAF de nódulo linfático cervical, carcinoma papilar metastásico de tiroides
Un grupo cohesionado e irregular de células dentro del nódulo linfático determina el diagnóstico de carcinoma.
20x
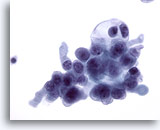
PAAF de nódulo linfático cervical, carcinoma papilar metastásico de tiroides.
Estas células malignas no proporcionan ningún indicio sobre el tumor primario, a pesar que mostrar hipercromasia, nucleolos, aumento de la relación núcleo/citoplasma y agrupamiento de la cromatina. 40x
PAAF de nódulo linfático cervical, carcinoma papilar metastásico de tiroides
Estas células malignas no proporcionan ningún indicio sobre el tumor primario, a pesar que mostrar hipercromasia, nucleolos, aumento de la relación núcleo/citoplasma y agrupamiento de la cromatina.
40x
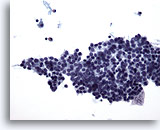
PAAF de nódulo linfático cervical, carcinoma papilar metastásico de tiroides.
Se observa la presencia de un gran grupo cohesionado de células. Las células son ligeramente hipercromáticas y presentan algo de citoplasma. El pleomorfismo es mínimo. El diagnóstico de carcinoma se consigue gracias a que el grupo de células cohesionadas se encuentra dentro de un nódulo linfático. 20x
PAAF de nódulo linfático cervical, carcinoma papilar metastásico de tiroides.
Se observa la presencia de un gran grupo cohesionado de células. Las células son ligeramente hipercromáticas y presentan algo de citoplasma. El pleomorfismo es mínimo. El diagnóstico de carcinoma se consigue gracias a que el grupo de células cohesionadas se encuentra dentro de un nódulo linfático.
20x
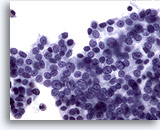
PAAF de nódulo linfático cervical, carcinoma papilar metastásico de tiroides.
Observe la suavidad de la cromatina nuclear, que es característica del carcinoma papilar del tiroides. Se observa una inclusión intracitoplasmática dentro de un núcleo. En esta magnificación existe más pleomorfismo que en la imagen a menor aumento. 40x
PAAF de nódulo linfático cervical, carcinoma papilar metastásico de tiroides.
Observe la suavidad de la cromatina nuclear, que es característica del carcinoma papilar del tiroides. Se observa una inclusión intracitoplasmática dentro de un núcleo. En esta magnificación existe más pleomorfismo que en la imagen a menor aumento.
40x
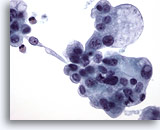
PAAF de nódulo linfático cervical, carcinoma papilar metastásico de tiroides.
El núcleo con una inclusión intranuclear, la suavidad de los núcleos y los pequeños nucleolos son compatibles con una metástasis de carcinoma papilar. 40x
PAAF de nódulo linfático cervical, carcinoma papilar metastásico de tiroides.
El núcleo con una inclusión intranuclear, la suavidad de los núcleos y los pequeños nucleolos son compatibles con una metástasis de carcinoma papilar.
40x
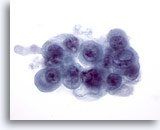
PAAF de nódulo linfático cervical, carcinoma papilar metastásico de tiroides.
Se observa la presencia de una gran inclusión intranuclear. 60x
PAAF de nódulo linfático cervical, carcinoma papilar metastásico de tiroides
Se observa la presencia de una gran inclusión intranuclear.
60x
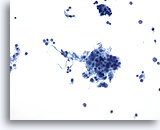
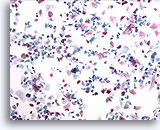
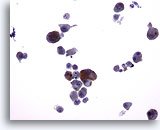
PAAF de nódulo linfático, hiperplasia linfoide reactiva.
Una PAAF de un nódulo linfático puede presentar pequeños grupos irregulares de macrófagos y linfocitos. Éstos no deben considerarse erróneamente como un neoplasma epitelial. Aquí existen dos de estos grupos, junto con muchas otras pequeñas células redondas de tamaño variable. 20x
PAAF de nódulo linfático, hiperplasia linfoide reactiva.
Una PAAF de un nódulo linfático puede presentar pequeños grupos irregulares de macrófagos y linfocitos. Éstos no deben considerarse erróneamente como un neoplasma epitelial. Aquí existen dos de estos grupos, junto con muchas otras pequeñas células redondas de tamaño variable.
20x
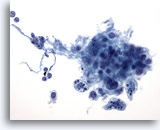
PAAF de nódulo linfático, reactivo.
Un grupo que contiene macrófagos con pigmento intracitoplasmático, denominados macrófagos de cuerpo tingible. 40x
PAAF de nódulo linfático, reactivo.
Un grupo que contiene macrófagos con pigmento intracitoplasmático, denominados macrófagos de cuerpo tingible.
40x
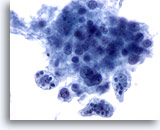
PAAF de nódulo linfático, reactivo.
A mayor aumento se muestran los tres macrófagos de cuerpo tingible. 60x
PAAF de nódulo linfático, reactivo.
A mayor aumento se muestran los tres macrófagos de cuerpo tingible.
60x
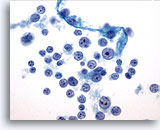
PAAF de nódulo linfático, reactivo.
En los linfocitos observados existe un rango de maduración. Se observan pequeños linfocitos maduros, linfocitos ligeramente más grandes y muy grandes. Se puede apreciar un núcleo mitótico. La presencia de macrófagos de cuerpo tingible y de un rango de maduración permite diagnosticar una hiperplasia reactiva. 60x
PAAF de nódulo linfático, reactivo.
En los linfocitos observados existe un rango de maduración. Se observan pequeños linfocitos maduros, linfocitos ligeramente más grandes y muy grandes. Se puede apreciar un núcleo mitótico. La presencia de macrófagos de cuerpo tingible y de un rango de maduración permite diagnosticar una hiperplasia reactiva.
60x

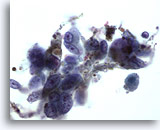
PAAF de nódulo linfático, proliferación linfoide atípica.
La muestra es celular y cuando se selecciona un linfocito se observa que la mayoría de las células son ligeramente más grandes de dicha célula. La monotonía de la muestra es preocupante. 20x
PAAF de nódulo linfático, proliferación linfoide atípica.
La muestra es celular y cuando se selecciona un linfocito se observa que la mayoría de las células son ligeramente más grandes de dicha célula. La monotonía de la muestra es preocupante.
20x
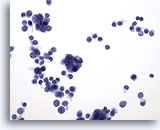
PAAF de nódulo linfático, proliferación linfoide atípica.
De nuevo, cuando se selecciona un linfocito, se observa que la mayoría de las células son más grandes. No existe un rango de maduración en esta muestra. 40x
PAAF de nódulo linfático, proliferación linfoide atípica.
De nuevo, cuando se selecciona un linfocito, se observa que la mayoría de las células son más grandes. No existe un rango de maduración en esta muestra.
40x
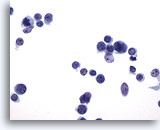
PAAF de nódulo linfático, proliferación linfoide atípica.
Una bonita preparación. Los núcleos son todos ovales sin muescas ni cortes. Los nucleolos son pequeños y no son hipercromáticos. 60x
PAAF de nódulo linfático, proliferación linfoide atípica.
Una bonita preparación. Los núcleos son todos ovales sin muescas ni cortes. Los nucleolos son pequeños y no son hipercromáticos.
60x
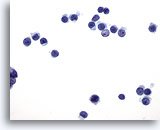
PAAF de nódulo linfático, proliferación linfoide atípica.
La monotonía (linfocitos de tamaño similar) y la ausencia de macrófagos de cuerpo tingible son las características de esta proliferación linfoide atípica. 60x
PAAF de nódulo linfático, proliferación linfoide atípica.
La monotonía (linfocitos de tamaño similar) y la ausencia de macrófagos de cuerpo tingible son las características de esta proliferación linfoide atípica.
60x

PAAF de nódulo linfático, linfoma maligno.
Esta muestra es celular con todas las células dispersas por la foto. Compare un pequeño linfocito maduro con la inmensa mayoría de las otras células, que presentan un tamaño ligeramente mayor. 20x
PAAF de nódulo linfático, linfoma maligno.
Esta muestra es celular con todas las células dispersas por la foto. Compare un pequeño linfocito maduro con la inmensa mayoría de las otras células, que presentan un tamaño ligeramente mayor.
20x
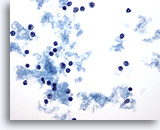
PAAF de nódulo linfático, linfoma maligno.
En esta ampliación se pueden observar irregularidades en los núcleos y la presencia de grandes nucleolos rojos en la mayoría de las células. Todas estas células tienen aproximadamente el mismo tamaño y son más grandes que el linfocito madura que aparece en la esquina inferior derecha. 40x
PAAF de nódulo linfático, linfoma maligno.
En esta ampliación se pueden observar irregularidades en los núcleos y la presencia de grandes nucleolos rojos en la mayoría de las células. Todas estas células tienen aproximadamente el mismo tamaño y son más grandes que el linfocito madura que aparece en la esquina inferior derecha.
40x
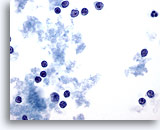
PAAF de nódulo linfático, linfoma maligno.
Una imagen a mayor aumento exhibe las mismas características, pero con mayor claridad.
60x
PAAF de nódulo linfático, linfoma maligno.
Una imagen a mayor aumento exhibe las mismas características, pero con mayor claridad.
60x
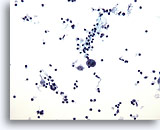
PAAF de nódulo linfático, enfermedad de Hodgkin.
Se presenta una muestra celular en la que la inmensa mayoría de las células son linfocitos pequeños y redondos, pero con dos grandes células abigarradas que, a este aumento, son compatibles con las células de Reed-Sternberg. 20x
PAAF de nódulo linfático, enfermedad de Hodgkin.
Se presenta una muestra celular en la que la inmensa mayoría de las células son linfocitos pequeños y redondos, pero con dos grandes células abigarradas que, a este aumento, son compatibles con las células de Reed-Sternberg.
20x
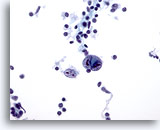
PAAF de nódulo linfático, enfermedad de Hodgkin.
Las células de Reed-Sternberg clásicas son diagnósticas de la enfermedad de Hodgkin con el fondo asociado característico de células inflamatorias. 40x
PAAF de nódulo linfático, enfermedad de Hodgkin.
Las células de Reed-Sternberg clásicas son diagnósticas de la enfermedad de Hodgkin con el fondo asociado característico de células inflamatorias.
40x
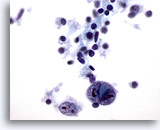
PAAF de nódulo linfático, enfermedad de Hodgkin.
Los pequeños linfocitos presentes no tienen características atípicas como cabría esperar. Las dos grandes células abigarradas presentan las características de “imagen especular” de las células de Reed-Sternberg. 60x
PAAF de nódulo linfático, enfermedad de Hodgkin.
Los pequeños linfocitos presentes no tienen características atípicas como cabría esperar. Las dos grandes células abigarradas presentan las características de “imagen especular” de las células de Reed-Sternberg.
60x
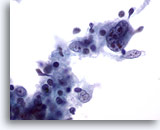
PAAF de nódulo linfático, enfermedad de Hodgkin.
Se observa una célula multinucleada, irregular y altamente atípica. 60x
PAAF de nódulo linfático, enfermedad de Hodgkin.
Se observa una célula multinucleada, irregular y altamente atípica.
60x
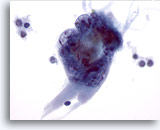
PAAF de nódulo linfático, enfermedad de Hodgkin.
Se observan dos grandes células altamente atípicas. No son diagnósticas de la enfermedad de Hodgkin, pero sugieren fuertemente que la muestra debe examinarse detenidamente para determinar si se trata de células de Reed-Sternberg características. 60x
PAAF de nódulo linfático, enfermedad de Hodgkin.
Se observan dos grandes células altamente atípicas. No son diagnósticas de la enfermedad de Hodgkin, pero sugieren fuertemente que la muestra debe examinarse detenidamente para determinar si se trata de células de Reed-Sternberg características.
60x
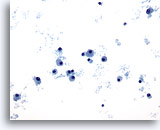
PAAF de cuello, plasmocitoma.
Se observa la presencia de células aisladas con abundante citoplasma y un núcleo excéntrico. 20x
PAAF de cuello, plasmocitoma.
Se observa la presencia de células aisladas con abundante citoplasma y un núcleo excéntrico.
20x
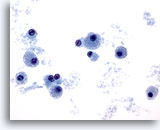
PAAF de cuello, plasmocitoma.
Los núcleos son relativamente pequeños con membranas nucleares homogéneas y cromatina uniformemente dispersa. Presencia de pequeños nucleolos en varias de las células. 40x
PAAF de cuello, plasmocitoma.
Los núcleos son relativamente pequeños con membranas nucleares homogéneas y cromatina uniformemente dispersa. Presencia de pequeños nucleolos en varias de las células.
40x
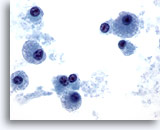
PAAF de cuello, plasmocitoma.
Aquí se muestra una imagen a mayor aumento en la que se refleja el diagnóstico de células plasmáticas malignas. 60x
PAAF de cuello, plasmocitoma.
Aquí se muestra una imagen a mayor aumento en la que se refleja el diagnóstico de células plasmáticas malignas.
60x
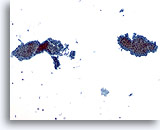
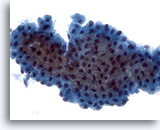
PAAF de parótida, tumor de Warthin (adenolinfoma).
En la magnificación de cribado se observan los componentes epitelial y linfoide de este neoplasma benigno. 10x
PAAF de parótida, tumor de Warthin (adenolinfoma).
En la magnificación de cribado se observan los componentes epitelial y linfoide de este neoplasma benigno.
10x
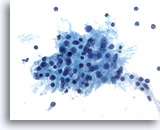
PAAF de parótida, tumor de Warthin (adenolinfoma).
Se observa la presencia de capas de células oxifílicas con abundante citoplasma granular. 40x
PAAF de parótida, tumor de Warthin (adenolinfoma).
Se observa la presencia de capas de células oxifílicas con abundante citoplasma granular.
40x
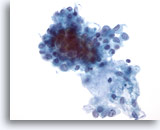
PAAF de parótida, tumor de Warthin (adenolinfoma).
Los linfocitos están mezclados con células oxifílicas en un fondo de restos amorfos. El 95% de los tumores de Warthin se producen en la glándula parótida. 40x
PAAF de parótida, tumor de Warthin (adenolinfoma).
Los linfocitos están mezclados con células oxifílicas en un fondo de restos amorfos. El 95% de los tumores de Warthin se producen en la glándula parótida.
40x
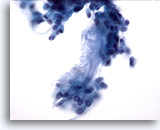
PAFF de glándula salival, adenoma pleomórfico.
En la parte superior central de la foto aparece un agrupamiento irregular de células epiteliales con núcleos ovales blandos. Algunos presentan diminutos nucleolos. Inmediatamente debajo hay un estroma y unas pocas células estromales aisladas. El adenoma pleomórfico es el tumor más común de la glándula salival. 40x
PAFF de glándula salival, adenoma pleomórfico.
En la parte superior central de la foto aparece un agrupamiento irregular de células epiteliales con núcleos ovales blandos. Algunos presentan diminutos nucleolos. Inmediatamente debajo hay un estroma y unas pocas células estromales aisladas. El adenoma pleomórfico es el tumor más común de la glándula salival.
40x
PAFF de glándula salival, adenoma pleomórfico.
La naturaleza fibrilar del estroma se observa claramente. Existe una mezcla de epitelio con células estromales en la parte inferior del estroma. 40x
PAFF de glándula salival, adenoma pleomórfico.
La naturaleza fibrilar del estroma se observa claramente. Existe una mezcla de epitelio con células estromales en la parte inferior del estroma.
40x
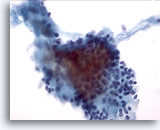
PAFF de glándula salival, adenoma pleomórfico.
Los estromas se pueden observar fuera de las células (lado derecho de la foto) y en asociación íntima con las células. Los núcleos epiteliales aparecen organizados y blandos.
40x
PAFF de glándula salival, adenoma pleomórfico.
Los estromas se pueden observar fuera de las células (lado derecho de la foto) y en asociación íntima con las células. Los núcleos epiteliales aparecen organizados y blandos.
40x
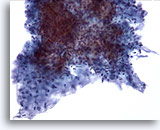
PAFF de parótida, adenoma pleomórfico.
En el centro aparece un gran grupo de células epiteliales aglomeradas, difíciles de ver. Las que se ven son blandas. Alrededor de las células epiteliales existe estroma con las células estromales aisladas incrustadas. La naturaleza fibrilar del estroma se observa claramente. 20x
PAFF de parótida, adenoma pleomórfico.
En el centro aparece un gran grupo de células epiteliales aglomeradas, difíciles de ver. Las que se ven son blandas. Alrededor de las células epiteliales existe estroma con las células estromales aisladas incrustadas. La naturaleza fibrilar del estroma se observa claramente.
20x
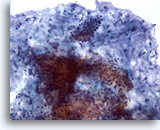
PAFF de parótida, adenoma pleomórfico.
El estroma fibrilar con células epiteliales es característico del adenoma pleomórfico. Aquí se muestra la asociación de células epiteliales y el estroma fibrilar. 20x
PAFF de parótida, adenoma pleomórfico.
El estroma fibrilar con células epiteliales es característico del adenoma pleomórfico. Aquí se muestra la asociación de células epiteliales y el estroma fibrilar.
20x
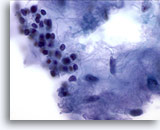
PAFF de parótida, adenoma pleomórfico.
Una bonita foto de la asociación íntima de las células epiteliales, las células estromales y el estroma fibrilar. Los adenomas pleomórficos son tumores de crecimiento lento que pueden recurrir si no se eliminan completamente. 60x
PAFF de parótida, adenoma pleomórfico.
Una bonita foto de la asociación íntima de las células epiteliales, las células estromales y el estroma fibrilar. Los adenomas pleomórficos son tumores de crecimiento lento que pueden recurrir si no se eliminan completamente.
60x

Cuando se selecciona un linfocito, se observa que el grupo de células situado en el centro y el pequeño grupo situado junto a la derecha de él contienen células que son más grandes que el linfocito. Se observa claramente una hipercromasia en ambos grupos. El fondo es necrótico. 20x
PAAF de parótida, carcinoma de célula pequeña.
Cuando se selecciona un linfocito, se observa que el grupo de células situado en el centro y el pequeño grupo situado junto a la derecha de él contienen células que son más grandes que el linfocito. Se observa claramente una hipercromasia en ambos grupos. El fondo es necrótico.
20x

PAAF de parótida, carcinoma de célula pequeña.
El grupo grande es un grupo desordenado de células altamente cohesionadas. Los núcleos están borrosos y son hipercromáticos. No se observa citoplasma. 40x
PAAF de parótida, carcinoma de célula pequeña.
El grupo grande es un grupo desordenado de células altamente cohesionadas. Los núcleos están borrosos y son hipercromáticos. No se observa citoplasma.
40x
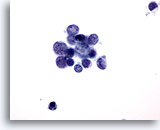
PAAF de parótida, carcinoma de célula pequeña.
Aquí se observa el pleomorfismo del carcinoma de células pequeñas, y la característica cromatina en “sal y pimienta”. No aparecen nucleolos. 60x
PAAF de parótida, carcinoma de célula pequeña.
Aquí se observa el pleomorfismo del carcinoma de células pequeñas, y la característica cromatina en “sal y pimienta”. No aparecen nucleolos.
60x
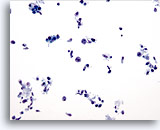
PAAF de parótida, linfoma.
La muestra es celular con un fondo sucio. En la foto destacan las grandes células aisladas y dispersas. Las células son ovales con una cantidad mínima o inexistente de citoplasma y con nucleolos prominentes. 20x
PAAF de parótida, linfoma.
La muestra es celular con un fondo sucio. En la foto destacan las grandes células aisladas y dispersas. Las células son ovales con una cantidad mínima o inexistente de citoplasma y con nucleolos prominentes.
20x
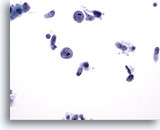
PAAF de parótida, linfoma.
Estas grandes células presentan una cantidad mínima de citoplasma. Un núcleo presenta un “mordisco” en el exterior. Los nucleolos son grandes y no ovales. 40x
PAAF de parótida, linfoma.
Estas grandes células presentan una cantidad mínima de citoplasma. Un núcleo presenta un “mordisco” en el exterior. Los nucleolos son grandes y no ovales.
40x
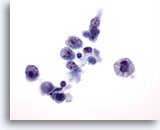
PAAF de parótida, linfoma.
Se observa la presencia de células aisladas con grandes núcleos y grandes nucleolos irregulares. Las membranas nucleares son irregulares. El citoplasma es mínimo. Aparece una figura mitótica. 60x
PAAF de parótida, linfoma.
Se observa la presencia de células aisladas con grandes núcleos y grandes nucleolos irregulares. Las membranas nucleares son irregulares. El citoplasma es mínimo. Aparece una figura mitótica.
60x
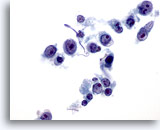
PAAF de parótida, linfoma.
Las grandes células pleomórficas están dispuestas aisladamente. Los núcleos presentan entradas o salientes. 60x
PAAF de parótida, linfoma.
Las grandes células pleomórficas están dispuestas aisladamente. Los núcleos presentan entradas o salientes.
60x
PAAF de parótida, linfoma.
Aquí se muestran células malignas aisladas.
60x
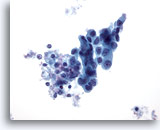
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
Un grupo comprimido de células epiteliales en el nódulo linfático permite establecer que se trata de una enfermedad metastásica. Las células son grandes, con núcleos hipercromáticos irregulares y nucleolos prominentes. El pleomorfismo es marcado. La membrana nuclear presenta irregularidades. 40x
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
Un grupo comprimido de células epiteliales en el nódulo linfático permite establecer que se trata de una enfermedad metastásica. Las células son grandes, con núcleos hipercromáticos irregulares y nucleolos prominentes. El pleomorfismo es marcado. La membrana nuclear presenta irregularidades.
40x
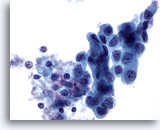
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
Observe el citoplasma denso con un aspecto columnar en la esquina superior derecha. 60x
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
Observe el citoplasma denso con un aspecto columnar en la esquina superior derecha.
60x
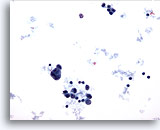
Aparecen numerosas células que no son normales en un nódulo linfático. Observe el linfocito para poder realizar una comparación de tamaños. La célula más grande es inmensa y claramente maligna. A este aumento parece tratarse de una célula tumoral gigante. En la parte superior se observa un grupo de células aislado, que sugiere la naturaleza epitelial de esta lesión. En la parte inferior de la foto aparecen varias células aisladas con grandes núcleos y mínimo citoplasma. 20x
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
Aparecen numerosas células que no son normales en un nódulo linfático. Observe el linfocito para poder realizar una comparación de tamaños. La célula más grande es inmensa y claramente maligna. A este aumento parece tratarse de una célula tumoral gigante. En la parte superior se observa un grupo de células aislado, que sugiere la naturaleza epitelial de esta lesión. En la parte inferior de la foto aparecen varias células aisladas con grandes núcleos y mínimo citoplasma.
20x
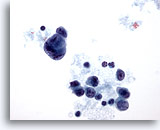
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
La célula tumoral gigante y las células malignas aisladas se visualizan más claramente a este aumento. 40x
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
La célula tumoral gigante y las células malignas aisladas se visualizan más claramente a este aumento.
40x
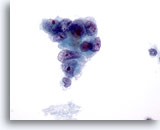
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
La naturaleza epitelial de la malignidad queda revelada por el agrupamiento de células malignas. Observe el pleomorfismo, la marcada irregularidad de los núcleos y los prominentes nucleolos. 60x
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
La naturaleza epitelial de la malignidad queda revelada por el agrupamiento de células malignas. Observe el pleomorfismo, la marcada irregularidad de los núcleos y los prominentes nucleolos.
60x
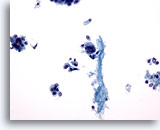
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
A la izquierda se muestra un grupo de células epiteliales que permite establecer el diagnóstico de carcinoma metastásico. En el centro aparece una célula tumoral gigante. Se observa una dispersión de otras células malignas aisladas y el fondo es necrótico. 20x
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
A la izquierda se muestra un grupo de células epiteliales que permite establecer el diagnóstico de carcinoma metastásico. En el centro aparece una célula tumoral gigante. Se observa una dispersión de otras células malignas aisladas y el fondo es necrótico.
20x
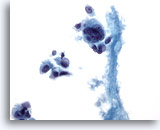
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
Una visión a mayor aumento de la célula gigante y de la célula maligna aislada. 40x
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
Una visión a mayor aumento de la célula gigante y de la célula maligna aislada.
40x
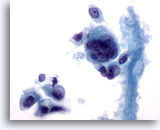
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
La célula tumoral gigante presenta grandes núcleos irregulares. En algunas de las células aisladas aparece una ligera sugerencia plasmocitoide. 60x
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
La célula tumoral gigante presenta grandes núcleos irregulares. En algunas de las células aisladas aparece una ligera sugerencia plasmocitoide.
60x
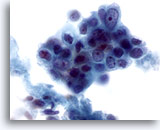
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
Se observa la presencia de un grupo de células malignas con las características de pleomorfismo, irregularidad en la membrana nuclear y suave hipercromasia. Observe la presencia de nucleolos prominentes. 60x
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
Se observa la presencia de un grupo de células malignas con las características de pleomorfismo, irregularidad en la membrana nuclear y suave hipercromasia. Observe la presencia de nucleolos prominentes.
60x
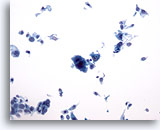
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
A excepción del grupo aislado de la parte inferior izquierda, el resto de las células observadas están dispuestas de forma aislada. Lo más impresionante de la foto es la inmensa célula gigante maligna que aparece en el centro. No obstante, observe la presencia de una bonita célula plasmocitoide a la derecha de ésta. 20x
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
A excepción del grupo aislado de la parte inferior izquierda, el resto de las células observadas están dispuestas de forma aislada. Lo más impresionante de la foto es la inmensa célula gigante maligna que aparece en el centro. No obstante, observe la presencia de una bonita célula plasmocitoide a la derecha de ésta.
20x
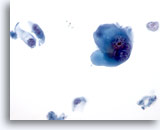
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
Se observa más claramente una célula gigante y las células plasmocitoides. 40x
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
Se observa más claramente una célula gigante y las células plasmocitoides.
40x
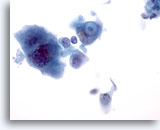
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
La célula más importante es el que está en el centro. En esta célula maligna aparece una gota de mucina en una vacuola. 60x
PAAF de nódulo linfático axilar, carcinoma metastásico de mama.
La célula más importante es el que está en el centro. En esta célula maligna aparece una gota de mucina en una vacuola.
60x
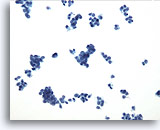
PAAF de timo, tumor carcinoide atípico.
A un aumento de screening, el aspirado aparece abundantemente celular. 20x
PAAF de timo, tumor carcinoide atípico.
A un aumento de screening, el aspirado aparece abundantemente celular.
20x
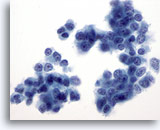
PAAF de timo, tumor carcinoide atípico.
Los núcleos exhiben frecuentemente pequeños nucleolos y cromatina salpicada. 60x
PAAF de timo, tumor carcinoide atípico.
Los núcleos exhiben frecuentemente pequeños nucleolos y cromatina salpicada.
60x
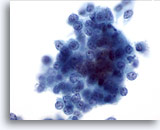
PAAF de timo, tumor carcinoide atípico.
La células están dispuestas en pequeños grupos o aparecen aisladas. 60x
PAAF de timo, tumor carcinoide atípico.
La células están dispuestas en pequeños grupos o aparecen aisladas.
60x
PAAF de timo, tumor carcinoide atípico.
El citoplasma es escaso a moderadamente abundante. 60x
PAAF de timo, tumor carcinoide atípico.
El citoplasma es escaso a moderadamente abundante.
60x