TIROIDE
Helen H. Wang, medico
Introduzione
I noduli della tiroide rappresentano un problema clinico diffuso, il cui tasso stimato di incidenza annua raggiunge il 4-8%. [1] E così, tra10 e 20 milioni di americani scoprono di avere noduli tiroidei clinicamente rilevabili. [1] L’aspirazione con ago sottile della tiroide costituisce il test iniziale per la maggior parte dei pazienti a cui viene diagnosticato un nodulo tiroideo perché si tratta di una procedura sicura e poco costosa che consente meglio di qualsiasi altro test di individuare in modo adeguato i pazienti da sottoporre a intervento chirurgico. [2] Di conseguenza, in un laboratorio di citologia la FNA della tiroide rappresenta in genere il tipo più comune di FNA. Nonostante sia una tecnica largamente accettata e utilizzata sin dagli anni ’70, l’elaborazione e la valutazione della FNA della tiroide suscitano ancora pareri controversi.
Raccolta e processazione dei campioni
La FNA della tiroide è ottenuta per mezzo della palpazione o della guida ecografia, in base alla dimensione della lesione. Entrambe le tecniche richiedono le medesime modalità: eseguire il tradizionale striscio diretto dell’aspirato o risciacquare l’aspirato in una soluzione di conservazione per il preparato in fase liquida. Due studi hanno confrontato la precisione delle preparazioni ThinPrep®: e degli strisci tradizionali per quanto riguarda la FNA della tiroide e sono giunti alla conclusione che questi due metodi hanno un grado di accuratezza equivalente nell’individuazione delle neoplasie della tiroide, [3, 4] mentre uno di questi ha mostrato che le preparazioni ThinPrep sono caratterizzate da una minore correlazione complessiva con la diagnosi istologica rispetto agli strisci diretti, specialmente per quanto riguarda le tiroiditi linfocitiche croniche (62% del ThinPrep contro 92% degli strisci diretti). [4] Inoltre, alcuni autori hanno affermato che le preparati ThinPrep non sono in grado di rilevare colloidi acquose o diffuse. [3, 5] Nello studio di Tulecke et al. Si afferma campione tipo ” carta velina” del ThinPrep è associato nell’esame istologico ad abbondante colloide che probabilmente è colloide acquosa. [6] Nel complesso, la colloide sembra essere presente in quantità inferiore nei campioni ThinPrep rispetto agli strisci convenzionali. Tuttavia, il campione ThinPrep consente di osservare meglio le caratteristiche nucleari determinanti per la diagnosi di carcinoma papillare rispetto agli strisci convenzionali, siano essi fissati in alcool o lasciati essiccare all’aria. D’altra parte il metodo ThinPrep sembra provocare la rottura dei follicoli e in questi preparati sono più facilmente presenti cellule follicolari singole, in lembi o in gruppi che nei campioni convenzionali.
Referti
Nella letteratura medica, sono stati proposti e utilizzati numerosi schemi di valutazione per i referti. A nostro parere, uno schema basato sulla probabilità di riscontrare un carcinoma all’istologia rappresenta un utile strumento sia per i patologi che per i medici.
Positivo per malignità
I campioni appartenenti a questa categoria sono quelli in cui all’istologia viene individuata una patologia maligna nel 100% dei casi. Il carcinoma papillare costituisce il tumore maligno della tiroide più diffuso e presenta caratteristiche nucleari specifiche facilmente identificabili nei campioni citologici. Altre patologie maligne diagnosticabili con un elevato grado di accuratezza grazie alla citologia sono: carcinomi midollari, linfomi e carcinomi metastatici. Nei campioni ThinPrep il carcinoma papillare è è caratterizzato da lembi e aggregati papillari di cellule affollate con nuclei ingranditi e a stampo, cromatina “polverosa”, membrane nucleari irregolari messe in evidenza da solchi nucleari e inclusioni citoplasmatiche intranucleari e nucleoli piccoli ma prominenti e spesso eosinofili. [7] Al contrario, il carcinoma midollare è caratterizzato da cellule plasmocitoidi monomorfe isolate con un rapporto N/C elevato, nuclei eccentrici e cromatina vistosamente granulare con o senza nucleoli prominenti. Il citoplasma è granulare con granuli piccoli e appena visibili. In alcuni casi, le cellule appaiono affusolate, ma presentano le stesse caratteristiche nucleari. I linfomi e i carcinomi metastatici della tiroide sono molto meno diffusi. Le caratteristiche citologiche dipendono, nell’ordine, dall’istotipo e dal sito di origine.
Sospetto per malignità
Quando il campione non è ipercellulato o sono presenti la maggior parte (ma non tutte) delle caratteristiche sopra descritte per il carcinoma papillare o midollare o per altre patologie maligne, il referto indica che vi è il sospetto di una malignità. La letteratura medica dice che il valore predittivo positivo (in istologia, tasso di malignità) di un “sospetto carcinoma papillare” è compreso tra il 54 e l’84%, associato o meno nello schema di refertazione ad un’altra categoria non definitiva, come “indeterminato”. [7, 8, 9, 10] Quando viene aggiunta la categoria “indeterminato” a quella di “sospetto”, il valore predittivo positivo relativo alla categoria “sospetto” è pari o superiore al 64%. [7, 9, 10] I valori predittivi positivi di una diagnosi di “sospetto” per quanto riguarda altri tipi di carcinomi della tiroide molto meno diffusi non sono stati riportati.
Indeterminato per malignità
Nel nostro laboratorio, questa categoria include i campioni caratterizzati da un valore predittivo positivo di malignità in istologia inferiore al 50% (spesso anche al 30%) e superiore al 10%. [6, 7] Questa categoria raccoglie i campioni che mostrano alcune delle caratteristiche del carcinoma papillare, e che non consentono la formulazione di una diagnosi di “sospetto”. [7] In questo caso, la letteratura sostiene che il valore predittivo positivo è compreso tra il 20 e il 54%. [7, 9, 10, 11] Queste lesioni spesso rappresentano una variante follicolare del carcinoma papillare. La categoria diagnostica include anche neoplasie follicolari e a cellule di Hürthle, caratterizzati da scarsa colloide e cellule follicolari in microfollicoli e da cellule di Hürthle singole o in gruppi affollati. Nella letteratura, il valore predittivo positivo di queste lesioni variava dal 2 al 91%, [6, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27] probabilmente a causa di differenti definizioni e dalla variabilità dei criteri classificativi come per le diagnosi istologiche, ma si mantiene al di sotto del 30% in quasi tutti i referti. [10, 15, 22, 24, 27]
Molto probabilmente benigno
Questa categoria comprende le lesioni follicolari che presentano un pattern macrofollicolare o una combinazione di pattern micro e macrofollicolare con abbondante colloide nello sfondo. Nei campioni ThinPrep i macrofollicoli appaiono sotto forma di foglietti di decine di cellule follicolari distribuite in modo uniforme e con nuclei adeguatamente distanziati. Il significato delle cellule follicolari singole nel ThinPrep è incerto e tuttavia sono considerate come appartenenti a un pattern micro o macrofollicolare. La probabilità che a un esame istologico queste lesioni si rivelino come maligne (variante follicolare del carcinoma papillare o carcinoma follicolare) è molto bassa, ma non pari a zero. In letteratura, è compresa tra lo 0 e il 43% nella maggior parte dei casi [6, 9, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 24, 25, 26, 27] non supera il 6%, tranne in tre occasioni [14, 16, 27]. Di conseguenza, la categoria viene definita come molto probabilmente benigna e non inequivocabilmente benigna.
Negativo per cellule maligne compatibile con tiroidite di Hashimoto
Abbiamo appurato che la tecnologia ThinPrep non è la soluzione ottimale per la diagnosi delle tiroiditi. [6] La tiroidite di Hashimoto è caratterizzata da lembi o gruppi di cellule follicolari con alterazioni a carico delle cellule di Hürthle su un fondo costituito da un numero variabile di linfociti e plasmacellule con occasionali aggregati linfoidi e centro follicolari. Poiché la tiroidite linfocitica/di Hashimoto è un disturbo tiroideo piuttosto diffuso, lo studio dei campioni è essenziale per escludere la coesistenza di lesioni più significative.
Cellularità sub-ottimale con caratteristiche riconducibili a…
Poiché la FNA della tiroide ha essenzialmente lo scopo di determinare l’urgenza del trattamento e individuare i pazienti da sottoporre a intervento chirurgico o a visite di controllo, è auspicabile che la cellularità dei campioni sia più che adeguata per consentire la formulazione di una diagnosi definitiva. Se la cellularità è sub-ottimale (ma sufficiente a suggerire una diagnosi), il referto riporterà questo come primo elemento quindi proseguirà con l’indicazione di una delle categorie diagnostiche sopra elencate. Questa categoria include i campioni derivati da formazioni cistiche (macrofagi) con rare cellule follicolari. Non è stata fissata una soglia quantitativa per questa categoria. Per arrivare a una decisione, ci si basa su una combinazione di caratteristiche, come la quantità di colloide, la disposizione delle cellule e le proprietà citologiche.
Non diagnostico
Questa categoria è in genere riservata ai campioni che contengono poche cellule follicolari, o non ne contengono affatto.
Bibliografia di riferimento
- Cramer H. Fine-needle aspiration cytology of the thyroid: an appraisal. Cancer 2000; 90(6):325-9.
- Mazzaferri EL. Management of a solitary thyroid nodule [see comments]. N Engl J Med 1993; 328(8):553-9.
- Biscotti CV, Hollow JA, Toddy SM, Easley KA. ThinPrep versus conventional smear cytologic preparations in the analysis of thyroid fine-needle aspiration specimens. Am J Clin Pathol 1995; 104(2):150-3.
- Frost AR, Sidawy MK, Ferfelli M, et al. Utility of thin-layer preparations in thyroid fine-needle aspiration: diagnostic accuracy, cytomorphology, and optimal sample preparation. Cancer 1998; 84(1):17-25.
- Afify AM, Liu J, Al-Khafaji BM. Cytologic artifacts and pitfalls of thyroid fine-needle aspiration using ThinPrep: a comparative retrospective review. Cancer 2001; 93(3):179-86.
- Tulecke MA, Wang HH. ThinPrep for cytologic evaluation of follicular thyroid lesions: correlation with histologic findings. Diagn Cytopathol 2004; 30(1):7-13.
- Zhang Y, Fraser JL, Wang HH. Morphologic predictors of papillary carcinoma on fine-needle aspiration of thyroid with ThinPrep preparations. Diagn Cytopathol 2001; 24(6):378-83.
- Chen H, Zeiger MA, Clark DP, Westra WH, Udelsman R. Papillary carcinoma of the thyroid: can operative management be based solely on fine-needle aspiration? J Am Coll Surg 1997; 184(6):605-10.
- Renshaw AA. Accuracy of thyroid fine-needle aspiration using receiver operator characteristic curves. Am J Clin Pathol 2001; 116(4):477-82.
- Goldstein RE, Netterville JL, Burkey B, Johnson JE. Implications of follicular neoplasms, atypia, and lesions suspicious for malignancy diagnosed by fine-needle aspiration of thyroid nodules. Ann Surg 2002; 235(5):656-62; discussion 662-4.
- Renshaw AA. Focal features of papillary carcinoma of the thyroid in fine-needle aspiration material are strongly associated with papillary carcinoma at resection. Am J Clin Pathol 2002; 118(2):208-10.
- Al-Rikabi AC, Al-Omran M, Cheema M, El-Khwsky F, Al-Nuaim A. Pattern of thyroid lesions and role of fine needle aspiration cytology (FNA) in the management of thyroid enlargement: a retrospective study from a teaching hospital in Riyadh. Apmis 1998; 106(11):1069-74.
- Baloch ZW, Tam D, Langer J, Mandel S, LiVolsi VA, Gupta PK. Ultrasound-guided fine-needle aspiration biopsy of the thyroid: role of on-site assessment and multiple cytologic preparations. Diagn Cytopathol 2000; 23(6):425-9.
- Boyd LA, Earnhardt RC, Dunn JT, Frierson HF, Hanks JB. Preoperative evaluation and predictive value of fine-needle aspiration and frozen section of thyroid nodules. J Am Coll Surg 1998; 187(5):494-502.
- Hawkins F, Bellido D, Bernal C, et al. Fine needle aspiration biopsy in the diagnosis of thyroid cancer and thyroid disease. Cancer 1987; 59(6):1206-9.
- Ko HM, Jhu IK, Yang SH, et al. Clinicopathologic analysis of fine needle aspiration cytology of the thyroid. A review of 1,613 cases and correlation with histopathologic diagnoses. Acta Cytol 2003; 47(5):727-32.
- Mandreker SR, Nadkarni NS, Pinto RG, Menezes S. Role of fine needle aspiration cytology as the initial modality in the investigation of thyroid lesions. Acta Cytol 1995; 39(5):898-904.
- Miller JM, Kini SR, Hamburger JI. The diagnosis of malignant follicular neoplasms of the thyroid by needle biopsy. Cancer 1985; 55(12):2812-7.
- Morgan JL, Serpell JW, Cheng MS. Fine-needle aspiration cytology of thyroid nodules: how useful is it? ANZ J Surg 2003; 73(7):480-3.
- Prinz RA, O’Morchoe PJ, Barbato AL, et al. Fine needle aspiration biopsy of thyroid nodules. Ann Surg 1983; 198(1):70-3.
- Ravetto C, Colombo L, Dottorini ME. Usefulness of fine-needle aspiration in the diagnosis of thyroid carcinoma: a retrospective study in 37,895 patients. Cancer 2000; 90(6):357-63.
- Nam-Goong IS, Kim HY, Gong G, et al. Ultrasonography-guided fine-needle aspiration of thyroid incidentaloma: correlation with pathological findings. Clin Endocrinol (Oxf) 2004; 60(1):21-8.
- Silverman JF, West RL, Larkin EW, et al. The role of fine-needle aspiration biopsy in the rapid diagnosis and management of thyroid neoplasm. Cancer 1986; 57(6):1164-70.
- La Rosa GL, Belfiore A, Giuffrida D, et al. Evaluation of the fine needle aspiration biopsy in the preoperative selection of cold thyroid nodules. Cancer 1991; 67(8):2137-41.
- DeMay RM. Follicular lesions of the thyroid. W(h)ither follicular carcinoma? Am J Clin Pathol 2000; 114(5):681-3.
- Mateša N, Tabain I, Dabelic N, Petric V, Kusic Z. Diagnostic relevance of fine needle aspiration cytology for follicular lesions of the thyroid: retrospective study. Croat Med J 2002; 43(5):606-9.
- Blansfield JA, Sack MJ, Kukora JS. Recent experience with preoperative fine-needle aspiration biopsy of thyroid nodules in a community hospital. Arch Surg 2002; 137(7):818-21.

Positivo per carcinoma papillare
Ricorda: Puoi cliccare su qualsiasi immagine per ingrandire l’immagine.
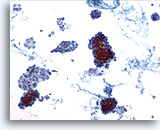
Figura 1
Carcinoma papillare.
Il primo criterio per la formulazione di una diagnosi di carcinoma papillare è l’osservazione a basso ingrandimento di ipercellularità con vari lembi coesi e aggregati di cellule follicolari, come in questa figura.10x
Figura 1
Carcinoma papillare.
Il primo criterio per la formulazione di una diagnosi di carcinoma papillare è l’osservazione a basso ingrandimento di ipercellularità con vari lembi coesi e aggregati di cellule follicolari, come in questa figura.10x
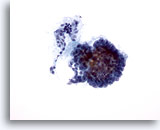
Figura 2
Carcinoma papillare.
Per formulare una diagnosi definitiva di carcinoma papillare, non è necessario osservare un’architettura papillare come quella presente in questa figura.20X
Figura 2
Carcinoma papillare.
Per formulare una diagnosi definitiva di carcinoma papillare, non è necessario osservare un’architettura papillare come quella presente in questa figura.20X
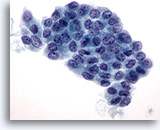
Figura 3
Carcinoma papillare.
Nei preparati ThinPrep i carcinomi papillari si presentano spesso sotto forma di lembi di cellule follicolari ingrandite con membrane nucleari irregolari e nucleoli piccoli ma prominenti e spesso eosinofili.60X
Figura 3
Carcinoma papillare.
Nei preparati ThinPrep i carcinomi papillari si presentano spesso sotto forma di lembi di cellule follicolari ingrandite con membrane nucleari irregolari e nucleoli piccoli ma prominenti e spesso eosinofili.60X
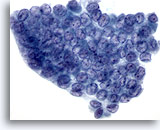
Figura 4
Carcinoma papillare.
In questa figura sono visibili molding nucleare, affollamento e sovrapposizione nucleare come conseguenza del significativo aumento dimensionale dei nuclei. Sono inoltre presenti cromatina dall’aspetto “polveroso”, solchi nucleari e inclusioni citoplasmatiche intranucleari.60X
Figura 4
Carcinoma papillare.
In questa figura sono visibili molding nucleare, affollamento e sovrapposizione nucleare come conseguenza del significativo aumento dimensionale dei nuclei. Sono inoltre presenti cromatina dall’aspetto “polveroso”, solchi nucleari e inclusioni citoplasmatiche intranucleari.60X
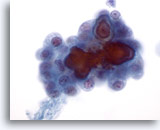
Figura 5
Carcinoma papillare.
Sebbene le caratteristiche rilevate nelle figure 1-4 siano sufficienti per formulare una diagnosi definitiva di carcinoma papillare, la presenza in questa foto di corpi psammomatosi è un’ulteriore conferma di questa teoria. I corpi psammomatosi sono raramente visibili e non sono necessari per formulare una diagnosi definitiva di carcinoma papillare. 60x
Figura 5
Carcinoma papillare.
Sebbene le caratteristiche rilevate nelle figure 1-4 siano sufficienti per formulare una diagnosi definitiva di carcinoma papillare, la presenza in questa foto di corpi psammomatosi è un’ulteriore conferma di questa teoria. I corpi psammomatosi sono raramente visibili e non sono necessari per formulare una diagnosi definitiva di carcinoma papillare.60x
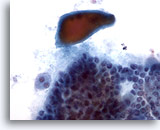
Figura 6
Carcinoma papillare.
Anche se non si tratta di una caratteristica specifica del carcinoma papillare, a volte è presente una colloide densa come in questa figura.40x
Figura 6
Carcinoma papillare.
Anche se non si tratta di una caratteristica specifica del carcinoma papillare, a volte è presente una colloide densa come in questa figura.40x
Sospetto per carcinoma papillare
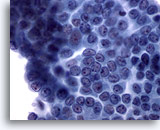
Figura 7: Carcinoma papillare.
In questo lembo di cellule sono presenti molte delle caratteristiche del carcinoma papillare, come la cromatina dall’aspetto “polveroso”, i solchi nei nuclei e i piccoli nucleoli prominenti. Non sono rilevabili inclusioni citoplasmatiche intranucleari. Inoltre, i nuclei sono più grandi del normale, ma non tanto da presentarsi a stampo e affollati. L’esame istologico consente di confermare nel 65-90% di questi casi la presenza di carcinoma papillare. Il rimanente 10-35% di casi rappresenta un sospetto di carcinoma papillare.60x
Figura 7
Carcinoma papillare.
In questo lembo di cellule sono presenti molte delle caratteristiche del carcinoma papillare, come la cromatina dall’aspetto “polveroso”, i solchi nei nuclei e i piccoli nucleoli prominenti. Non sono rilevabili inclusioni citoplasmatiche intranucleari. Inoltre, i nuclei sono più grandi del normale, ma non tanto da presentarsi a stampo e affollati. L’esame istologico consente di confermare nel 65-90% di questi casi la presenza di carcinoma papillare. Il rimanente 10-35% di casi rappresenta un sospetto di carcinoma papillare.60x
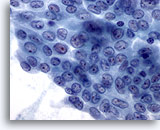
Figura 8
Carcinoma papillare.
Come nella figura 7, questo foglietto di cellule presenta buona parte delle caratteristiche di un carcinoma papillare. L’analisi del campione potrebbe indurre a formulare una diagnosi di carcinoma papillare o di sospetto carcinoma papillare. Entrambe le ipotesi sono corrette. Lo studio delle cellule presenti nel resto del campione può certamente contribuire alla decisione definitiva. 60X
Figura 8
Carcinoma papillare.
Come nella figura 7, questo foglietto di cellule presenta buona parte delle caratteristiche di un carcinoma papillare. L’analisi del campione potrebbe indurre a formulare una diagnosi di carcinoma papillare o di sospetto carcinoma papillare. Entrambe le ipotesi sono corrette. Lo studio delle cellule presenti nel resto del campione può certamente contribuire alla decisione definitiva.60X
Indeterminato per carcinoma papillare – Carcinoma papillare con alterazione cistica
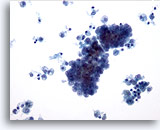
Figura 9
Carcinoma papillare.
L’aspetto cistico caratterizzato dalla presenza di macrofagi nello sfondo come in figura è tipico del carcinoma papillare.20x
Figura 9
Carcinoma papillare.
L’aspetto cistico caratterizzato dalla presenza di macrofagi nello sfondo come in figura è tipico del carcinoma papillare.20x
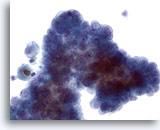
Figura 10
Carcinoma papillare.
Quando il carcinoma papillare assume un aspetto cistico, le caratteristiche del nucleo diventano per qualche motivo meno evidenti. In questo gruppo affollato di cellule sono presenti nucleoli piccoli ma prominenti con cromatina dall’aspetto “polveroso”. Tuttavia, l’ingrandimento dei nuclei e l’irregolarità delle membrane non sono evidenti. 40x
Figura 10
Carcinoma papillare.
Quando il carcinoma papillare assume un aspetto cistico, le caratteristiche del nucleo diventano per qualche motivo meno evidenti. In questo gruppo affollato di cellule sono presenti nucleoli piccoli ma prominenti con cromatina dall’aspetto “polveroso”. Tuttavia, l’ingrandimento dei nuclei e l’irregolarità delle membrane non sono evidenti.40x
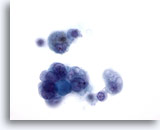
Figura 11: Carcinoma papillare.
Questa immagine proviene dallo stesso campione della figura 10. Le caratteristiche nucleari di questo carcinoma papillare confermato dall’esame istologico qui sono ancora meno evidenti. Poiché non tutte le lesioni che presentano alcune caratteristiche del carcinoma papillare, con o senza aspetti cistici, sono in realtà carcinomi papillari, è opportuno classificare questo tipo di campioni come “indeterminato” per carcinoma papillare. In base alla letteratura medica, l’esame istologico consente di confermare nel 20-54% dei casi la presenza di un carcinoma papillare.60x
Figura 11
Carcinoma papillare.
Questa immagine proviene dallo stesso campione della figura 10. Le caratteristiche nucleari di questo carcinoma papillare confermato dall’esame istologico qui sono ancora meno evidenti. Poiché non tutte le lesioni che presentano alcune caratteristiche del carcinoma papillare, con o senza aspetti cistici, sono in realtà carcinomi papillari, è opportuno classificare questo tipo di campioni come “indeterminato” per carcinoma papillare. In base alla letteratura medica, l’esame istologico consente di confermare nel 20-54% dei casi la presenza di un carcinoma papillare.60x
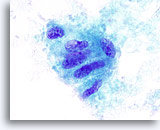
Figura 12
Indeterminato per carcinoma papillare, adenoma trabecolare ialinizzante.
Questo gruppo di cellule follicolari mostra irregolarità nucleari, piccoli nucleoli prominenti e una probabile inclusione. Il campione ottenuto tramite aspirazione con ago sottile è stato classificato come “indeterminato per carcinoma papillare”. Alla tiroidectomia si è rivelata la presenza di un adenoma trabecolare ialinizzante.100x
Figura 12
Indeterminato per carcinoma papillare, adenoma trabecolare ialinizzante.
Questo gruppo di cellule follicolari mostra irregolarità nucleari, piccoli nucleoli prominenti e una probabile inclusione. Il campione ottenuto tramite aspirazione con ago sottile è stato classificato come “indeterminato per carcinoma papillare”. Alla tiroidectomia si è rivelata la presenza di un adenoma trabecolare ialinizzante.100x
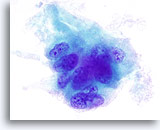
Figura 13
Indeterminato per carcinoma papillare, adenoma trabecolare ialinizzante.
Come nella figura 12, è possibile notare solchi nei nuclei e piccoli nucleoli prominenti. L’esame istologico della lesione ha permesso di determinare che il materiale amorfo verde che circonda questo gruppo di cellule è in realtà collageno.100x
Figura 13
Indeterminato per carcinoma papillare, adenoma trabecolare ialinizzante.
Come nella figura 12, è possibile notare solchi nei nuclei e piccoli nucleoli prominenti. L’esame istologico della lesione ha permesso di determinare che il materiale amorfo verde che circonda questo gruppo di cellule è in realtà collageno.100x
Positivo per carcinoma midollare

Figura 14
Carcinoma midollare.
L’aspirazione con ago sottile di un carcinoma midollare mostra di solito cellule plasmocitoidi monomorfe singole o in raggruppamenti lassi. In questo campo visivo è presente un corpo amiloide.20x
Figura 14
Carcinoma midollare.
L’aspirazione con ago sottile di un carcinoma midollare mostra di solito cellule plasmocitoidi monomorfe singole o in raggruppamenti lassi. In questo campo visivo è presente un corpo amiloide.20x
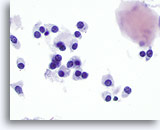
Figura 15
Carcinoma midollare.
A un maggiore ingrandimento, le cellule appaiono tonde, ovali, poligonali o fusiformi con nuclei dalla forma simile. Nell’angolo in alto a destra della figura è presente un corpo amiloide.60x
Figura 15
Carcinoma midollare.
A un maggiore ingrandimento, le cellule appaiono tonde, ovali, poligonali o fusiformi con nuclei dalla forma simile. Nell’angolo in alto a destra della figura è presente un corpo amiloide.60x
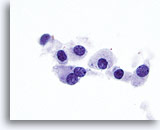
Figura 16
Carcinoma midollare.
A un livello di ingrandimento ancora maggiore, è possibile osservare il citoplasma leggermente granulare e la cromatina vistosamente granulare. Sono presenti sporadici nucleoli prominenti e qualche caso di binucleazione, una caratteristica tipica del carcinoma midollare.100x
Figura 16
Carcinoma midollare.
A un livello di ingrandimento ancora maggiore, è possibile osservare il citoplasma leggermente granulare e la cromatina vistosamente granulare. Sono presenti sporadici nucleoli prominenti e qualche caso di binucleazione, una caratteristica tipica del carcinoma midollare.100x
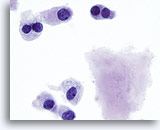
Figura 17
Carcinoma midollare.
Sono visibili altre cellule binucleate con amiloide.100x
Figura 17
Carcinoma midollare.
Sono visibili altre cellule binucleate con amiloide.100x
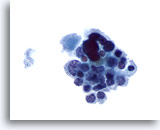
Figura 18
Carcinoma midollare.
In questa figura è presente un raggruppamento lasso di cellule prevalentemente piccole e uniformi con rari casi di cellule grandi e atipiche. Le cellule piccole hanno nuclei eccentrici e citoplasma leggermente granulare. Questa figura e le seguenti costituiscono una presentazione insolita di FNA di carcinoma midollare. 60x
Figura 18
Carcinoma midollare.
In questa figura è presente un raggruppamento lasso di cellule prevalentemente piccole e uniformi con rari casi di cellule grandi e atipiche. Le cellule piccole hanno nuclei eccentrici e citoplasma leggermente granulare. Questa figura e le seguenti costituiscono una presentazione insolita di FNA di carcinoma midollare.60x
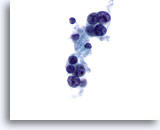
Figura 19
Carcinoma midollare.
In alcune occasioni, il carcinoma midollare è caratterizzato da nucleoli prominenti come quelli presenti in figura. La maggior parte delle cellule del campione hanno perduto il citoplasma.60x
Figura 19
Carcinoma midollare.
In alcune occasioni, il carcinoma midollare è caratterizzato da nucleoli prominenti come quelli presenti in figura. La maggior parte delle cellule del campione hanno perduto il citoplasma.60x
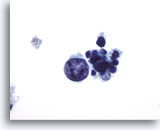
Figura 20
Carcinoma midollare.
In questa immagine sono presenti una cellula tumorale molto grande, atipica, ma deteriorata e varie cellule tumorali piccole, uniformi e deteriorate.60x
Figura 20
Carcinoma midollare.
In questa immagine sono presenti una cellula tumorale molto grande, atipica, ma deteriorata e varie cellule tumorali piccole, uniformi e deteriorate.60x
Positivo per carcinoma anaplastico della tiroide
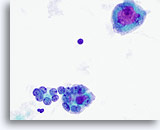
Figura 21
Carcinoma anaplastico.
Nella parte inferiore della figura sono visibili due microfollicoli. Sono costituiti da cellule follicolari atipiche di dimensioni variabili, alcune delle quali presentano nucleoli prominenti. Nella parte superiore si nota una cellula gigante simile a un osteoclasto con nucleoli grandi e prominenti.60x
Figura 21
Carcinoma anaplastico.
Nella parte inferiore della figura sono visibili due microfollicoli. Sono costituiti da cellule follicolari atipiche di dimensioni variabili, alcune delle quali presentano nucleoli prominenti. Nella parte superiore si nota una cellula gigante simile a un osteoclasto con nucleoli grandi e prominenti.60x
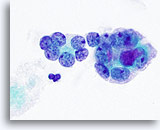
Figura 22
Carcinoma anaplastico.
Ingrandimento maggiore dei microfollicoli della figura 21.100x
Figura 22
Carcinoma anaplastico.
Ingrandimento maggiore dei microfollicoli della figura 21.100x
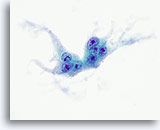
Figura 23
Carcinoma anaplastico.
Un’altra cellula gigante simile a un osteoclasto.60x
Figura 23
Carcinoma anaplastico.
Un’altra cellula gigante simile a un osteoclasto.60x
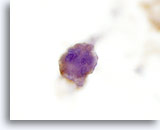
Figura 24
Carcinoma anaplastico.
All’ immunocitochimica le cellule tumorali risultavano positive alla tireoglobulina a conferma dell’origine tiroidea.60x
Figura 24
Carcinoma anaplastico.
All’ immunocitochimica le cellule tumorali risultavano positive alla tireoglobulina a conferma dell’origine tiroidea.60x
Indeterminato per malignità – Neoplasma a cellule di Hürthle
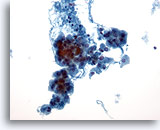
Figura 25
Neoplasia a cellule di Hürthle.
In citologia, la neoplasia a cellule di Hürthle è caratterizzata dalla presenza di cellule di Hürthle singole o in aggregati lassi visibili a piccolo ingrandimento.20x
Figura 25
Neoplasia a cellule di Hürthle.
In citologia, la neoplasia a cellule di Hürthle è caratterizzata dalla presenza di cellule di Hürthle singole o in aggregati lassi visibili a piccolo ingrandimento.20x
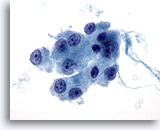
Figura 26
Neoplasia a cellule di Hürthle.
A un ingrandimento maggiore si osserva il citoplasma granulare moderato o abbondante e i nucleoli centrali prominenti che caratterizzano le cellule di Hürthle.60x
Figura 26
Neoplasia a cellule di Hürthle.
A un ingrandimento maggiore si osserva il citoplasma granulare moderato o abbondante e i nucleoli centrali prominenti che caratterizzano le cellule di Hürthle.60x
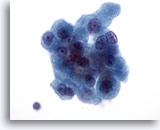
Figura 27
Neoplasia a cellule di Hürthle.
Anche la binucleazione, presente nell’angolo superiore destro e inferiore sinistro di questo aggregato cellulare, è una caratteristica tipica delle cellule di Hürthle.60x
Figura 27
Neoplasia a cellule di Hürthle.
Anche la binucleazione, presente nell’angolo superiore destro e inferiore sinistro di questo aggregato cellulare, è una caratteristica tipica delle cellule di Hürthle.60x
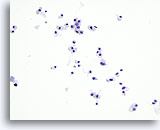
Figura 28
Neoplasia a cellule di Hürthle.
Come avviene per il carcinoma midollare, l’aspirato della neoplasia a cellule di Hürthle presenta diverse cellule tumorali isolate e raggruppamenti isolati di tali cellule. In questo tipo di neoplasia, il citoplasma è più abbondante rispetto al carcinoma midollare.20x
Figura 28
Neoplasia a cellule di Hürthle.
Come avviene per il carcinoma midollare, l’aspirato della neoplasia a cellule di Hürthle presenta diverse cellule tumorali isolate e raggruppamenti isolati di tali cellule. In questo tipo di neoplasia, il citoplasma è più abbondante rispetto al carcinoma midollare.20x
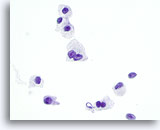
Figura 29
Neoplasia a cellule di Hürthle.
La frequente binucleazione, come quella mostrata in figura, è un’altra caratteristica della neoplasia a cellule di Hürthle, così come del carcinoma midollare.60x
Figura 29
Neoplasia a cellule di Hürthle.
La frequente binucleazione, come quella mostrata in figura, è un’altra caratteristica della neoplasia a cellule di Hürthle, così come del carcinoma midollare.60x
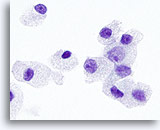
Figura 30
Neoplasia a cellule di Hürthle.
A forte ingrandimento si notano i granuli citoplasmatici e i nucleoli, che sono più grandi e prominenti nelle neoplasie a cellule di Hürthle rispetto ai carcinomi midollari.100x
Figura 30
Neoplasia a cellule di Hürthle.
A forte ingrandimento si notano i granuli citoplasmatici e i nucleoli, che sono più grandi e prominenti nelle neoplasie a cellule di Hürthle rispetto ai carcinomi midollari.100x
Indeterminato per malignità – Neoplasma microfollicolare con caratteristiche cellulari di Hürthle
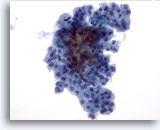
Figura 31
Neoplasia microfollicolare, con aspetti a cellule di Hürthle.
In questo campione sono visibili gruppi assembrati di cellule follicolari senza colloide nello sfondo.40x
Figura 31
Neoplasia microfollicolare, con aspetti a cellule di Hürthle.
In questo campione sono visibili gruppi assembrati di cellule follicolari senza colloide nello sfondo.40x
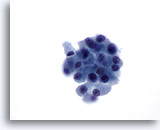
Figura 32
Neoplasia microfollicolare, con aspetti a cellule di Hürthle.
Se osservate a ingrandimento maggiore, le cellule follicolari appaiono non coese con una quantità regolare di citoplasma granulare. Non tutte le cellule hanno nucleoli grandi e prominenti.60x
Figura 32
Neoplasia microfollicolare, con aspetti a cellule di Hürthle.
Se osservate a ingrandimento maggiore, le cellule follicolari appaiono non coese con una quantità regolare di citoplasma granulare. Non tutte le cellule hanno nucleoli grandi e prominenti.60x
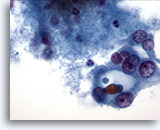
Figura 33
Neoplasia microfollicolare, con aspetti a cellule di Hürthle.
Le cellule di Hürthle presenti nella parte destra di questa figura sembrano formare un microfollicolo.60x
Figura 33
Neoplasia microfollicolare, con aspetti a cellule di Hürthle.
Le cellule di Hürthle presenti nella parte destra di questa figura sembrano formare un microfollicolo.60x
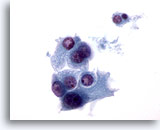
Figura 34
Neoplasia microfollicolare, con aspetti a cellule di Hürthle.
In un’altra parte dello stesso campione della figura 33, è più evidente l’aspetto non coeso di queste cellule di Hürthle.60x
Figura 34
Neoplasia microfollicolare, con aspetti a cellule di Hürthle.
In un’altra parte dello stesso campione della figura 33, è più evidente l’aspetto non coeso di queste cellule di Hürthle.60x
Indeterminato per malignità – Neoplasia microfollicolare
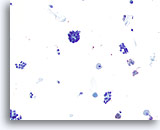
Figura 35
Neoplasia microfollicolare.
CA basso ingrandimento è possibile notare gruppi /microfollicoli sparsi con alcuni macrofagi sul fondo.20x
Figura 35
Neoplasia microfollicolare.
CA basso ingrandimento è possibile notare gruppi /microfollicoli sparsi con alcuni macrofagi sul fondo.20x
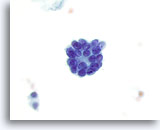
Figura 36
Neoplasia microfollicolare.
Un microfollicolo. Ad ingrandimento maggiore.60x
Figura 36
Neoplasia microfollicolare.
Un microfollicolo. Ad ingrandimento maggiore.60x
Molto probabilmente benigno – Compatibile con una lesione micro e macrofollicolare
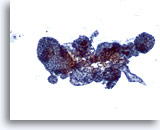
Figura 37
Lesione macrofollicolare.
Sono presenti vari follicoli di dimensioni variabili.10x
Figura 37
Lesione macrofollicolare.
Sono presenti vari follicoli di dimensioni variabili.10x
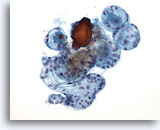
Figura 38
Lesione macrofollicolare.
Un ingrandimento maggiore rispetto a quello della figura 37 mostra altri follicoli intatti di dimensioni variabili.20x
Figura 38
Lesione macrofollicolare.
Un ingrandimento maggiore rispetto a quello della figura 37 mostra altri follicoli intatti di dimensioni variabili.20x
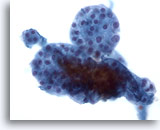
Figura 39
Lesione macrofollicolare.
Un ingrandimento ancora maggiore mostra un gruppo di piccoli follicoli.40x
Figura 39
Lesione macrofollicolare.
Un ingrandimento ancora maggiore mostra un gruppo di piccoli follicoli.40x
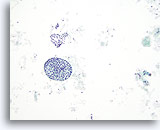
Figura 40
Lesione macrofollicolare.
In questa immagine sono visibili un macrofollicolo e un lembo di cellule follicolari. Che siano costituiti da follicoli o da lembi, i macrofollicoli sono caratterizzati da cellule follicolari molto distanziate tra loro.10x
Figura 40
Lesione macrofollicolare.
In questa immagine sono visibili un macrofollicolo e un lembo di cellule follicolari. Che siano costituiti da follicoli o da lembi, i macrofollicoli sono caratterizzati da cellule follicolari molto distanziate tra loro.10x
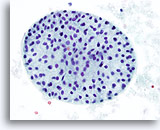
Figura 41
Lesione macrofollicolare.
Ingrandimento maggiore del macrofollicolo della figura 40.40x
Figura 41
Lesione macrofollicolare.
Ingrandimento maggiore del macrofollicolo della figura 40.40x

Figura 42
Lesione macrofollicolare.
Molto spesso i macrofollicoli si presentano sotto forma di lembi di cellule follicolari, come in questa immagine.20x
Figura 42
Lesione macrofollicolare.
Molto spesso i macrofollicoli si presentano sotto forma di lembi di cellule follicolari, come in questa immagine.20x
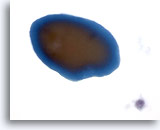
Figura 43
Lesione macrofollicolare.
In genere, nei vetrini ThinPrep la colloide appare come un frammento di materiale amorfo omogeneo con bordi netti e due tonalità di colore.60x
Figura 43
Lesione macrofollicolare.
In genere, nei vetrini ThinPrep la colloide appare come un frammento di materiale amorfo omogeneo con bordi netti e due tonalità di colore.60x
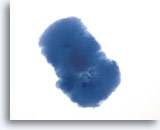
Figura 44
Lesione macrofollicolare.
Nei campioni ThinPrep la colloide può anche avere una struttura leggermente irregolare.60x
Figura 44
Lesione macrofollicolare.
Nei campioni ThinPrep la colloide può anche avere una struttura leggermente irregolare.60x
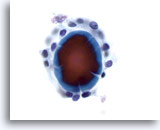
Figura 45
Lesione macrofollicolare.
Il frammento di colloide al centro di un follicolo presenta artefatti da rottura.60x
Figura 45
Lesione macrofollicolare.
Il frammento di colloide al centro di un follicolo presenta artefatti da rottura.60x
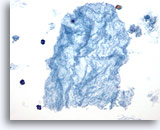
Figura 46
Lesione macrofollicolare.
Il materiale simile a carta velina è strettamente associato alla quantità di colloide presente nel campione della tiroidectomia e molto probabilmente rappresenta una colloide acquosa.40x
Figura 46
Lesione macrofollicolare.
Il materiale simile a carta velina è strettamente associato alla quantità di colloide presente nel campione della tiroidectomia e molto probabilmente rappresenta una colloide acquosa.40x
Negativo per cellule maligne – Compatibile con tiroidite di Hashimoto

Figura 47
Tiroidite di Hashimoto.
In questa figura sono visibili un follicolo linfoide e molte cellule mononucleari con citoplasma scarso.20x
Figura 47
Tiroidite di Hashimoto.
In questa figura sono visibili un follicolo linfoide e molte cellule mononucleari con citoplasma scarso.20x
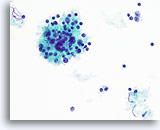
Figura 48
Tiroidite di Hashimoto.
Un ingrandimento maggiore mostra le cellule mononucleari e il follicolo linfoide con cellule linfoidi in varie fasi di maturazione.40x
Figura 48
Tiroidite di Hashimoto.
Un ingrandimento maggiore mostra le cellule mononucleari e il follicolo linfoide con cellule linfoidi in varie fasi di maturazione.40x
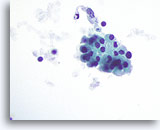
Figura 49
Tiroidite di Hashimoto.
In un’altra parte del campione è visibile un gruppo coeso di cellule di Hürthle con citoplasma granulare.60x
Figura 49
Tiroidite di Hashimoto.
In un’altra parte del campione è visibile un gruppo coeso di cellule di Hürthle con citoplasma granulare.60x
Torna a inizio pagina
Ritorna alla Indice dei contenuti

















































