Thyroïde
Helen H. Wang, MD, DrPH
Introduction
Les nodules thyroïdiens font partie des découvertes cliniques courantes, avec un taux annuel d’incidence estimé à 4-8 %. [1] On estime qu’entre 10 et 20 millions d’Américains souffrent de nodules thyroïdiens cliniquement détectables. [1] Comme il s’agit d’une technique sûre, économique et permettant une sélection optimale des patients qui doivent subir une intervention, la cytoponction thyroïdienne à l’aiguille fine représente le test initial de prise en charge de la plupart des patients présentant un nodule thyroïdien. [2] Il n’est donc pas étonnant que le type d’échantillons le plus couramment trouvé dans un laboratoire soit prélevé par cytoponction thyroïdienne. Pourtant, malgré une large adoption depuis les années 1970, le traitement et les résultats de cet examen sont toujours controversés.
Recueil et traitement des échantillons
La cytoponction thyroïdienne à l’aiguille fine est réalisée par palpation ou sous guidage échographique, selon la taille de la lésion. Le traitement est identique dans les deux cas, c’est-à-dire que le prélèvement est directement étalé sur des lames (méthode conventionnelle) ou rincé dans une solution de conservation pour une préparation en milieu liquide. Deux études comparant les préparations ThinPrep® aux frottis conventionnels accordent aux deux méthodes une précision comparable dans la détection des néoplasmes thyroïdiens. [3, 4] Une de ces études a pourtant montré que les préparations ThinPrep présentent une corrélation globale inférieure avec le diagnostic histologique par rapport aux frottis directs, en particulier dans la détection de la thyroïdite lymphoïde chronique (62 % pour ThinPrep contre 92 % pour les frottis directs). [4] En outre, certains auteurs ont suggéré que les préparations ThinPrep ne permettent pas de détecter les colloïdes séreux ou diffus. [3, 5] Dans une étude conduite par Tulecke, et al., le “matériel à l’aspect de papier” observé sur les lames ThinPrep s’est avéré associé à une quantité abondante de colloïde lors de l’examen histologique et représente probablement un colloïde séreux. [6] Dans l’ensemble, les préparations ThinPrep semblent contenir une quantité inférieure de colloïdes que les frottis conventionnels. En revanche, la méthode ThinPrep permet une meilleure visualisation des caractéristiques nucléaires essentielles au diagnostic de carcinome papillaire. Elle semble en outre briser les follicules et présenter plus facilement des cellules folliculaires dans des amas, groupes ou même sous forme isolée.
Classification
De nombreuses classifications ont été proposées et employées dans la littérature. Nous en avons trouvé une qui sera aussi utile aux pathologistes qu’aux cliniciens, car elle est basée sur la probabilité de détecter un carcinome à l’aide des résultats histologiques.
Tumeur maligne
Les échantillons classés dans cette catégorie représentent les cas dans lesquels la résection permet quasiment toujours d’établir un diagnostic de tumeur maligne. Le carcinome papillaire (tumeur maligne la plus courante pour la thyroïde) possède des caractéristiques nucléaires spécifiques facilement identifiables sur les échantillons cytologiques. Parmi les autres tumeurs malignes pouvant être précisément diagnostiquées grâce à la cytologie, citons les carcinomes médullaires, lymphomes et carcinomes métastatiques. Sur les lames ThinPrep, le carcinome papillaire est caractérisé par des amas et groupes papillaires de cellules encombrées avec hypertrophie et moulage nucléaires, chromatine poudreuse, membranes nucléaires irrégulières (marquées par des fentes nucléaires et des inclusions cytoplasmiques intranucléaires) et des nucléoles petits mais proéminents et souvent éosinophiles. [7] À l’inverse, le carcinome médullaire est caractérisé par des cellules plasmacytoïdes monomorphes isolées présentant un rapport nucléo/cytoplasmique élevé, des noyaux excentrés et une chromatine grossièrement granulaire avec ou sans nucléole proéminent. De petits granules discrets remplissent le cytoplasme. Les cellules paraissent occasionnellement fuselées ; en revanche toutes présentent les mêmes caractéristiques nucléaires. Les lymphomes et carcinomes métastatiques de la thyroïde sont beaucoup moins courants. Leurs caractéristiques cytologiques dépendent respectivement de leur type et du site d’origine.
Suspicion de tumeur maligne
Quand l’échantillon n’est pas hypercellulaire et présente la majorité (mais pas toutes) des caractéristiques du carcinome papillaire et médullaire ou d’une autre tumeur maligne (voir ci-dessus), on le classe dans la catégorie “Suspicion de tumeur maligne”. Dans la littérature, la valeur prédictive positive (taux de tumeurs malignes diagnostiquées à partir des résultats histologiques) de la catégorie “Suspicion de carcinome papillaire” oscille entre 54 et 84 %, selon que le modèle de classification contient ou pas une autre catégorie de diagnostic non définitif (par exemple, “Résultat indéterminé”). [7, 8, 9, 10] Ainsi, quand la classification comporte une catégorie “Résultat indéterminé” et “Suspicion de”, la VPP de cette seconde catégorie est de 64 % ou plus. [7, 9, 10] Comme les autres types de carcinome de la thyroïde sont beaucoup moins courants, nous ne connaissons pas leur VPP en relation avec un diagnostic de suspicion.
Résultat indéterminé de tumeur maligne
Dans notre laboratoire, cette catégorie inclut les échantillons dont les résultats histologiques permettent d’établir une valeur prédictive de tumeur maligne inférieure à 50 % (dans la plupart des cas inférieure à 30 %) et supérieure à 10 %. [6, 7] On y trouve donc les échantillons qui affichent quelques caractéristiques du carcinoma papillaire, mais pas suffisamment pour les classer dans la catégorie “Suspicion de”. [7] Dans la littérature, sa valeur prédictive positive se situe entre 20 et 54 %. [7, 9, 10, 11] Ces lésions représentent souvent la variante folliculaire du carcinome papillaire. Cette catégorie diagnostique inclut également les néoplasmes folliculaires et à cellules de Hürthle, caractérisés par des colloïdes et cellules folliculaires rares siégeant dans des microfollicules, des groupes encombrés ou sous forme de cellules de Hürthle isolées. Dans la littérature, la valeur prédictive positive d’un carcinome pour ces lésions varie de 2 à 91 %, [6, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27] l’écart étant probablement dû à des définitions différentes de ces termes et à des critères variables de classification/diagnostic histologique. Cette valeur est, à quelques exceptions près, en majorité inférieure à 30 %. [10, 15, 22, 24, 27]
Lésion très probablement bénigne
Cette catégorie inclut les lésions folliculaires affichant une morphologie macrofolliculaire ou mixte (micro et macrofolliculaire) avec quantité abondante de colloïdes dans le fond. Sur les lames ThinPrep, les macrofollicules apparaissent dans des amas de douzaines de cellules régulièrement espacées avec une bonne distance entre les noyaux. Sur ces lames, la signification des cellules folliculaires isolées est incertaine car elles sont observées dans une morphologie par ailleurs micro ou macrofolliculaire. Comme la probabilité que les résultats histologiques de ces lésions permettent de les classer comme tumeur maligne (variante folliculaire du carcinome papillaire ou carcinome folliculaire) est faible mais pas nulle (de 0 à 43 % dans la littérature) [6, 9, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 24, 25, 26, 27] avec seulement trois cas [14, 16, 27] supérieurs à 6 %, nous les classons dans la catégorie “Lésion très probablement bénigne” plutôt que “Diagnostic sans équivoque de lésion bénigne”.
Absence de cellules malignes concordant avec une thyroïdite de Hashimoto
Nous nous sommes rendus compte que la méthode ThinPrep ne permet pas d’établir un diagnostic optimal de thyroïdite. [6] La thyroïdite de Hashimoto est caractérisée par des amas ou groupes de cellules folliculaires présentant divers degrés d’apparition de cellules de Hürthle dans un fond contenant un nombre variable de lymphocytes et de cellules plasmatiques avec des agrégats lymphoïdes et folliculaires centraux occasionnels. Comme la thyroïdite lymphoïde/de Hashimoto est une pathologie courante de la thyroïde, la qualité de l’échantillon est cruciale pour pouvoir écarter d’autres lésions coexistantes plus significatives.
Cellularité non optimale mais caractéristiques suggérant
Dans la mesure où la cytoponction thyroïdienne à l’aiguille fine sert essentiellement à orienter les patients vers une intervention chirurgicale ou un suivi, nous objectif consiste à obtenir une cellularité plus qu’adéquate permettant d’établir un diagnostic définitif. Si la cellularité n’est pas optimale (mais suffisante pour suggérer un diagnostic), nous commençons par classer l’échantillon dans cette catégorie, puis nous le classons ensuite dans l’une des catégories ci-dessus. Cette catégorie inclut les échantillons avec contenu kystique (macrophages) et très peu de cellules folliculaires. Nous ne disposons d’aucun seuil quantitatif pour cette catégorie, mais nous nous appuyons sur une combinaison de caractéristiques (dont la quantité de colloïdes et la disposition cellulaire) et de caractéristiques cytologiques pour prendre cette décision.
Éléments non diagnostiques
Cette catégorie est généralement réservée aux échantillons qui ne contiennent quasiment aucune cellule folliculaire (ou très peu).
Références
- Cramer H. Fine-needle aspiration cytology of the thyroid: an appraisal. Cancer 2000; 90(6):325-9.
- Mazzaferri EL. Management of a solitary thyroid nodule [see comments]. N Engl J Med 1993; 328(8):553-9.
- Biscotti CV, Hollow JA, Toddy SM, Easley KA. ThinPrep versus conventional smear cytologic preparations in the analysis of thyroid fine-needle aspiration specimens. Am J Clin Pathol 1995; 104(2):150-3.
- Frost AR, Sidawy MK, Ferfelli M, et al. Utility of thin-layer preparations in thyroid fine-needle aspiration: diagnostic accuracy, cytomorphology, and optimal sample preparation. Cancer 1998; 84(1):17-25.
- Afify AM, Liu J, Al-Khafaji BM. Cytologic artifacts and pitfalls of thyroid fine-needle aspiration using ThinPrep: a comparative retrospective review. Cancer 2001; 93(3):179-86.
- Tulecke MA, Wang HH. ThinPrep for cytologic evaluation of follicular thyroid lesions: correlation with histologic findings. Diagn Cytopathol 2004; 30(1):7-13.
- Zhang Y, Fraser JL, Wang HH. Morphologic predictors of papillary carcinoma on fine-needle aspiration of thyroid with ThinPrep preparations. Diagn Cytopathol 2001; 24(6):378-83.
- Chen H, Zeiger MA, Clark DP, Westra WH, Udelsman R. Papillary carcinoma of the thyroid: can operative management be based solely on fine-needle aspiration? J Am Coll Surg 1997; 184(6):605-10.
- Renshaw AA. Accuracy of thyroid fine-needle aspiration using receiver operator characteristic curves. Am J Clin Pathol 2001; 116(4):477-82.
- Goldstein RE, Netterville JL, Burkey B, Johnson JE. Implications of follicular neoplasms, atypia, and lesions suspicious for malignancy diagnosed by fine-needle aspiration of thyroid nodules. Ann Surg 2002; 235(5):656-62; discussion 662-4.
- Renshaw AA. Focal features of papillary carcinoma of the thyroid in fine-needle aspiration material are strongly associated with papillary carcinoma at resection. Am J Clin Pathol 2002; 118(2):208-10.
- Al-Rikabi AC, Al-Omran M, Cheema M, El-Khwsky F, Al-Nuaim A. Pattern of thyroid lesions and role of fine needle aspiration cytology (FNA) in the management of thyroid enlargement: a retrospective study from a teaching hospital in Riyadh. Apmis 1998; 106(11):1069-74.
- Baloch ZW, Tam D, Langer J, Mandel S, LiVolsi VA, Gupta PK. Ultrasound-guided fine-needle aspiration biopsy of the thyroid: role of on-site assessment and multiple cytologic preparations. Diagn Cytopathol 2000; 23(6):425-9.
- Boyd LA, Earnhardt RC, Dunn JT, Frierson HF, Hanks JB. Preoperative evaluation and predictive value of fine-needle aspiration and frozen section of thyroid nodules. J Am Coll Surg 1998; 187(5):494-502.
- Hawkins F, Bellido D, Bernal C, et al. Fine needle aspiration biopsy in the diagnosis of thyroid cancer and thyroid disease. Cancer 1987; 59(6):1206-9.
- Ko HM, Jhu IK, Yang SH, et al. Clinicopathologic analysis of fine needle aspiration cytology of the thyroid. A review of 1,613 cases and correlation with histopathologic diagnoses. Acta Cytol 2003; 47(5):727-32.
- Mandreker SR, Nadkarni NS, Pinto RG, Menezes S. Role of fine needle aspiration cytology as the initial modality in the investigation of thyroid lesions. Acta Cytol 1995; 39(5):898-904.
- Miller JM, Kini SR, Hamburger JI. The diagnosis of malignant follicular neoplasms of the thyroid by needle biopsy. Cancer 1985; 55(12):2812-7.
- Morgan JL, Serpell JW, Cheng MS. Fine-needle aspiration cytology of thyroid nodules: how useful is it? ANZ J Surg 2003; 73(7):480-3.
- Prinz RA, O’Morchoe PJ, Barbato AL, et al. Fine needle aspiration biopsy of thyroid nodules. Ann Surg 1983; 198(1):70-3.
- Ravetto C, Colombo L, Dottorini ME. Usefulness of fine-needle aspiration in the diagnosis of thyroid carcinoma: a retrospective study in 37,895 patients. Cancer 2000; 90(6):357-63.
- Nam-Goong IS, Kim HY, Gong G, et al. Ultrasonography-guided fine-needle aspiration of thyroid incidentaloma: correlation with pathological findings. Clin Endocrinol (Oxf) 2004; 60(1):21-8.
- Silverman JF, West RL, Larkin EW, et al. The role of fine-needle aspiration biopsy in the rapid diagnosis and management of thyroid neoplasm. Cancer 1986; 57(6):1164-70.
- La Rosa GL, Belfiore A, Giuffrida D, et al. Evaluation of the fine needle aspiration biopsy in the preoperative selection of cold thyroid nodules. Cancer 1991; 67(8):2137-41.
- DeMay RM. Follicular lesions of the thyroid. W(h)ither follicular carcinoma? Am J Clin Pathol 2000; 114(5):681-3.
- Mateša N, Tabain I, Dabelic N, Petric V, Kusic Z. Diagnostic relevance of fine needle aspiration cytology for follicular lesions of the thyroid: retrospective study. Croat Med J 2002; 43(5):606-9.
- Blansfield JA, Sack MJ, Kukora JS. Recent experience with preoperative fine-needle aspiration biopsy of thyroid nodules in a community hospital. Arch Surg 2002; 137(7):818-21.

Diagnostic positif de carcinome papillaire
Rappel : Vous pouvez cliquer sur une image
de l’Atlas pour la voir dans un format plus grand.
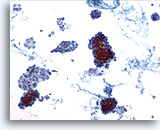
Figure 1
Carcinome papillaire.
L’hypercellularité avec présence de nombreux amas et groupes cohésifs de cellules folliculaires observés à faible grossissement (comme sur cette image) constituent le premier critère d’établissement d’un diagnostic définitif de carcinome papillaire.
10x
Figure 1
Carcinome papillaire.
L’hypercellularité avec présence de nombreux amas et groupes cohésifs de cellules folliculaires observés à faible grossissement (comme sur cette image) constituent le premier critère d’établissement d’un diagnostic définitif de carcinome papillaire.
10x
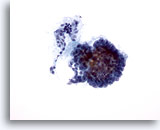
Figure 2
Carcinome papillaire.
La présence d’une architecture papillaire telle que celle visible sur cette image n’est pas obligatoire pour établir un diagnostic définitif de carcinome papillaire.
20X
Figure 2
Carcinome papillaire.
La présence d’une architecture papillaire telle que celle visible sur cette image n’est pas obligatoire pour établir un diagnostic définitif de carcinome papillaire.
20X
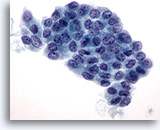
Figure 3
Carcinome papillaire.
Sur les préparations ThinPrep, les carcinomes papillaires se présentent souvent sous la forme d’amas de cellules folliculaires augmentées en taille avec membranes nucléaires irrégulières et petits nucléoles (mais proéminents) et souvent éosinophiles.
60X
Figure 3
Carcinome papillaire.
Sur les préparations ThinPrep, les carcinomes papillaires se présentent souvent sous la forme d’amas de cellules folliculaires augmentées en taille avec membranes nucléaires irrégulières et petits nucléoles (mais proéminents) et souvent éosinophiles.
60X
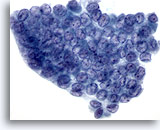
Figure 4
Carcinome papillaire.
Moulage, encombrement et superposition nucléaires résultant de l’augmentation marquée de la taille nucléaire. Fentes nucléaires et inclusions cytoplasmiques intranucléaires.
60X
Figure 4
Carcinome papillaire.
Moulage, encombrement et superposition nucléaires résultant de l’augmentation marquée de la taille nucléaire. Fentes nucléaires et inclusions cytoplasmiques intranucléaires.
60X
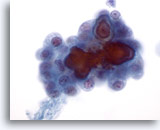
Figure 5
Carcinome papillaire.
Même si les caractéristiques observées sur les figures 1 à 4 suffisent à établir un diagnostic définitif de carcinome papillaire, la présence de psammomes (comme sur cette image) constitue un plus. Comme ces psammomes sont rarement visibles, leur identification n’est pas obligatoire pour établir un diagnostic définitif de carcinome papillaire.
60x
Figure 5
Carcinome papillaire.
Même si les caractéristiques observées sur les figures 1 à 4 suffisent à établir un diagnostic définitif de carcinome papillaire, la présence de psammomes (comme sur cette image) constitue un plus. Comme ces psammomes sont rarement visibles, leur identification n’est pas obligatoire pour établir un diagnostic définitif de carcinome papillaire.
60x
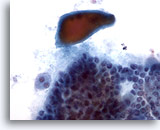
Figure 6
Carcinome papillaire.
Même si elle n’est pas spécifique au carcinome papillaire, la présence d’un colloïde dense (comme sur cette image) est parfois signalée dans cette pathologie.
40x
Figure 6
Carcinome papillaire.
Même si elle n’est pas spécifique au carcinome papillaire, la présence d’un colloïde dense (comme sur cette image) est parfois signalée dans cette pathologie.
40x
Suspicion de carcinome papillaire
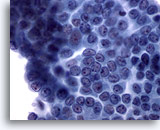
Figure 7: Carcinome papillaire.
Cet amas de cellules présente de nombreuses caractéristiques (mais pas toutes) d’un carcinome papillaire (chromatine poudreuse, fentes nucléaires, petits nucléoles proéminents, etc.). A noter l’absence d’inclusions cytoplasmiques intranucléaires. En outre, les noyaux sont augmentés en taille, mais pas jusqu’au moulage ou à l’encombrement. Après examen histologique de ces échantillons, le diagnostic de carcinome papillaire est confirmé dans 65 à 90 % des cas. Pour les 10 à 35 % restants, le diagnostic de “suspicion de carcinome papillaire” convient mieux.
60x
Figure 7
Carcinome papillaire.
Cet amas de cellules présente de nombreuses caractéristiques (mais pas toutes) d’un carcinome papillaire (chromatine poudreuse, fentes nucléaires, petits nucléoles proéminents, etc.). A noter l’absence d’inclusions cytoplasmiques intranucléaires. En outre, les noyaux sont augmentés en taille, mais pas jusqu’au moulage ou à l’encombrement. Après examen histologique de ces échantillons, le diagnostic de carcinome papillaire est confirmé dans 65 à 90 % des cas. Pour les 10 à 35 % restants, le diagnostic de “suspicion de carcinome papillaire” convient mieux.
60x
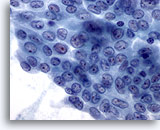
Figure 8
Carcinome papillaire.
Comme sur la figure 7, cet amas de cellules présente presque toutes les caractéristiques (mais pas toutes) d’un carcinome papillaire. Il est difficile de déterminer si cet échantillon doit être classé dans la catégorie “positif” ou “suspicion de carcinome papillaire” (les deux sont corrects). Bien entendu, les cellules visibles sur le reste de l’échantillon peuvent également aider à établir un diagnostic définitif.
60X
Figure 8
Carcinome papillaire.
Comme sur la figure 7, cet amas de cellules présente presque toutes les caractéristiques (mais pas toutes) d’un carcinome papillaire. Il est difficile de déterminer si cet échantillon doit être classé dans la catégorie “positif” ou “suspicion de carcinome papillaire” (les deux sont corrects). Bien entendu, les cellules visibles sur le reste de l’échantillon peuvent également aider à établir un diagnostic définitif.
60X
Résultat indéterminé de carcinome papillaire – Carcinome papillaire avec changement kystique
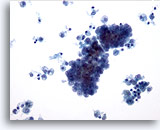
Figure 9
Carcinome papillaire.
La transformation kystique caractérisée par la présence de macrophages dans le fond est courante dans le carcinome papillaire.
20x
Figure 9
Carcinome papillaire.
La transformation kystique caractérisée par la présence de macrophages dans le fond est courante dans le carcinome papillaire.
20x
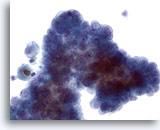
Figure 10
Carcinome papillaire.
Quand un carcinome papillaire devient kystique, ses caractéristiques nucléaires sont moins apparentes. Ce groupe encombré de cellules fait apparaître de petits nucléoles proéminents avec chromatine poudreuse. En revanche, l’augmentation de la taille nucléaire et les membranes irrégulières ne sont pas évidentes.
40x
Figure 10
Carcinome papillaire.
Quand un carcinome papillaire devient kystique, ses caractéristiques nucléaires sont moins apparentes. Ce groupe encombré de cellules fait apparaître de petits nucléoles proéminents avec chromatine poudreuse. En revanche, l’augmentation de la taille nucléaire et les membranes irrégulières ne sont pas évidentes.
40x
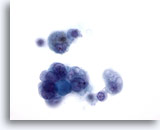
Figure 11: Carcinome papillaire.
Ce champ provient du même échantillon que la Figure 10. Les caractéristiques nucléaires de ce carcinome papillaire confirmé par les résultats histologiques sont encore moins apparentes dans ce champ. Comme toutes les lésions présentant quelques caractéristiques du carcinome papillaire (avec ou sans changement kystique) ne sont pas des carcinomes papillaires, il est préférable de classer ce type d’échantillons dans la catégorie “résultat indéterminé de carcinome papillaire”. Après examen histologique de ces échantillons, le diagnostic de carcinome papillaire est confirmé dans 20 à 54 % des cas.
60x
Figure 11
Carcinome papillaire.
Ce champ provient du même échantillon que la Figure 10. Les caractéristiques nucléaires de ce carcinome papillaire confirmé par les résultats histologiques sont encore moins apparentes dans ce champ. Comme toutes les lésions présentant quelques caractéristiques du carcinome papillaire (avec ou sans changement kystique) ne sont pas des carcinomes papillaires, il est préférable de classer ce type d’échantillons dans la catégorie “résultat indéterminé de carcinome papillaire”. Après examen histologique de ces échantillons, le diagnostic de carcinome papillaire est confirmé dans 20 à 54 % des cas.
60x
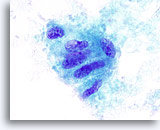
Figure 12
Résultat indéterminé de carcinoma papillaire, adénome trabéculaire hyalinisant.
Groupe de cellules folliculaires avec irrégularités nucléaires, petits nucléoles proéminents et une probable inclusion. Ce prélèvement effectué par cytoponction à l’aiguille fine a été classé dans la catégorie “Résultat indéterminé de carcinome papillaire”. L’échantillon recueilli à la suite de la thyroïdectomie a fait apparaître un adénome trabéculaire hyalinisant.
100x
Figure 12
Résultat indéterminé de carcinoma papillaire, adénome trabéculaire hyalinisant.
Groupe de cellules folliculaires avec irrégularités nucléaires, petits nucléoles proéminents et une probable inclusion. Ce prélèvement effectué par cytoponction à l’aiguille fine a été classé dans la catégorie “Résultat indéterminé de carcinome papillaire”. L’échantillon recueilli à la suite de la thyroïdectomie a fait apparaître un adénome trabéculaire hyalinisant.
100x
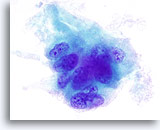
Figure 13
Résultat indéterminé de carcinoma papillaire, adénome trabéculaire hyalinisant.
On retrouve ici les fentes nucléaires et petits nucléoles proéminents de la Figure 12. L’histologie de la lésion montre que le matériel amorphe vert entourant ce groupe de cellules est en fait du collagène.
100x
Figure 13
Résultat indéterminé de carcinoma papillaire, adénome trabéculaire hyalinisant.
On retrouve ici les fentes nucléaires et petits nucléoles proéminents de la Figure 12. L’histologie de la lésion montre que le matériel amorphe vert entourant ce groupe de cellules est en fait du collagène.
100x
Diagnostic positif de carcinome médullaire

Figure 14
Carcinome médullaire.
Sur un prélèvement effectué par cytoponction à l’aiguille fine, un cancer médullaire se présente généralement sous la forme de groupes lâches et de cellules plasmacytoïdes monomorphes isolées. Ce champ comporte un fragment d’amyloïde.
20x
Figure 14
Carcinome médullaire.
Sur un prélèvement effectué par cytoponction à l’aiguille fine, un cancer médullaire se présente généralement sous la forme de groupes lâches et de cellules plasmacytoïdes monomorphes isolées. Ce champ comporte un fragment d’amyloïde.
20x
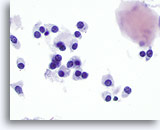
Figure 15
Carcinome médullaire.
Un plus fort grossissement fait apparaître des cellules rondes, ovales, polygonales ou fuselées avec des noyaux d’aspect similaire. Un fragment d’amyloïde se trouve dans le coin supérieur droit de l’image.
60x
Figure 15
Carcinome médullaire.
Un plus fort grossissement fait apparaître des cellules rondes, ovales, polygonales ou fuselées avec des noyaux d’aspect similaire. Un fragment d’amyloïde se trouve dans le coin supérieur droit de l’image.
60x
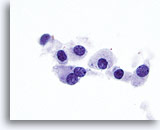
Figure 16
Carcinome médullaire.
Un grossissement encore plus fort permet d’observer le cytoplasme finement granulaire et la chromatine grossièrement granulaire. Les nucléoles proéminents occasionnels et la binucléation occasionnelle sont caractéristiques du cancer médullaire.
100x
Figure 16
Carcinome médullaire.
Un grossissement encore plus fort permet d’observer le cytoplasme finement granulaire et la chromatine grossièrement granulaire. Les nucléoles proéminents occasionnels et la binucléation occasionnelle sont caractéristiques du cancer médullaire.
100x
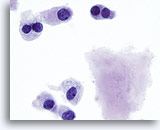
Figure 17
Carcinome médullaire.
Davantage de cellules binucléées avec amyloïde.
100x
Figure 17
Carcinome médullaire.
Davantage de cellules binucléées avec amyloïde.
100x
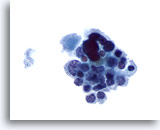
Figure 18
Carcinome médullaire.
Groupe lâche de cellules uniformes principalement petites avec quelques grandes cellules atypiques. Les petites cellules présentent un noyau excentré et un cytoplasme finement granulaire. Cette figure et les suivantes illustrent une présentation inhabituelle de cancer médullaire pour une cytoponction à l’aiguille fine.
60x
Figure 18
Carcinome médullaire.
Groupe lâche de cellules uniformes principalement petites avec quelques grandes cellules atypiques. Les petites cellules présentent un noyau excentré et un cytoplasme finement granulaire. Cette figure et les suivantes illustrent une présentation inhabituelle de cancer médullaire pour une cytoponction à l’aiguille fine.
60x
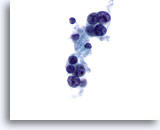
Figure 19
Carcinome médullaire.
Le cancer médullaire présente parfois des nucléoles proéminents, comme sur cette image. La plupart des cellules ont ici perdu leur cytoplasme.
60x
Figure 19
Carcinome médullaire.
Le cancer médullaire présente parfois des nucléoles proéminents, comme sur cette image. La plupart des cellules ont ici perdu leur cytoplasme.
60x
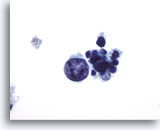
Figure 20
Carcinome médullaire.
Ce champ montre une cellule tumorale très grande, atypique mais dégénérée avec plusieurs petites cellules tumorales uniformes dégénérées.
60x
Figure 20
Carcinome médullaire.
Ce champ montre une cellule tumorale très grande, atypique mais dégénérée avec plusieurs petites cellules tumorales uniformes dégénérées.
60x
Diagnostic positif de carcinome thyroïdien anaplasique
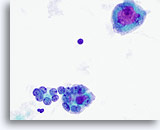
Figure 21
Carcinome anaplasique.
Les deux micro-follicules situés dans la moitié inférieure de l’image se composent de cellules folliculaires atypiques dont l’augmentation de taille est variable et certaines contenant des nucléoles proéminents. Une cellule géante semblable à un ostéoclaste avec grands nucléoles proéminents se trouve dans la moitié supérieure.
60x
Figure 21
Carcinome anaplasique.
Les deux micro-follicules situés dans la moitié inférieure de l’image se composent de cellules folliculaires atypiques dont l’augmentation de taille est variable et certaines contenant des nucléoles proéminents. Une cellule géante semblable à un ostéoclaste avec grands nucléoles proéminents se trouve dans la moitié supérieure.
60x
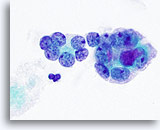
Figure 22
Carcinome anaplasique.
Plus fort grossissement des micro-follicules de la Figure 21.
100x
Figure 22
Carcinome anaplasique.
Plus fort grossissement des micro-follicules de la Figure 21.
100x
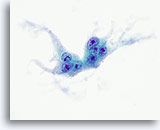
Figure 23
Carcinome anaplasique.
Autre cellule géante semblable à un ostéoclaste.
60x
Figure 23
Carcinome anaplasique.
Autre cellule géante semblable à un ostéoclaste.
60x
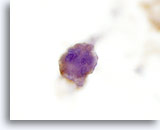
Figure 24
Carcinome anaplasique.
La réaction positive des cellules tumorales à la thyroglobuline lors de l’immunocytochimie confirme leur origine thyroïdienne.
60x
Figure 24
Carcinome anaplasique.
La réaction positive des cellules tumorales à la thyroglobuline lors de l’immunocytochimie confirme leur origine thyroïdienne.
60x
Résultat indéterminé de tumeur maligne – Néoplasme à cellules de Hürthle
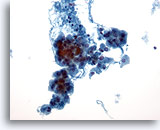
Figure 25
Néoplasme à cellules de Hürthle.
En cytologie, les néoplasmes à cellules de Hürthle sont caractérisés par un échantillon cellulaire comportant de nombreux groupes manquant de cohésion et des cellules de Hürthle isolées.
20x
Figure 25
Néoplasme à cellules de Hürthle.
En cytologie, les néoplasmes à cellules de Hürthle sont caractérisés par un échantillon cellulaire comportant de nombreux groupes manquant de cohésion et des cellules de Hürthle isolées.
20x
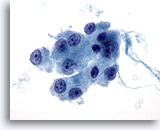
Figure 26
Néoplasme à cellules de Hürthle.
A fort grossissement, le cytoplasme granulaire modéré à abondant et les nucléoles centraux proéminents caractérisent les cellules de Hürthle.
60x
Figure 26
Néoplasme à cellules de Hürthle.
A fort grossissement, le cytoplasme granulaire modéré à abondant et les nucléoles centraux proéminents caractérisent les cellules de Hürthle.
60x
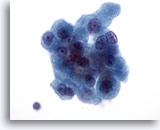
Figure 27
Néoplasme à cellules de Hürthle.
La binucléation (coin supérieur droit et coin inférieur gauche de ce groupe de cellules) est une autre caractéristique des cellules de Hürthle.
60x
Figure 27
Néoplasme à cellules de Hürthle.
La binucléation (coin supérieur droit et coin inférieur gauche de ce groupe de cellules) est une autre caractéristique des cellules de Hürthle.
60x
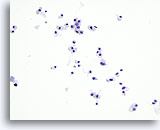
Figure 28
Néoplasme à cellules de Hürthle.
Comme le carcinome médullaire, le néoplasme à cellules de Hürthle se présente sous la forme de nombreux groupes lâches et de cellules tumorales isolées sur un échantillon prélevé par cytoponction à l’aiguille fine. En revanche, le cytoplasme est plus abondant dans le néoplasme à cellules de Hürthle.
20x
Figure 28
Néoplasme à cellules de Hürthle.
Comme le carcinome médullaire, le néoplasme à cellules de Hürthle se présente sous la forme de nombreux groupes lâches et de cellules tumorales isolées sur un échantillon prélevé par cytoponction à l’aiguille fine. En revanche, le cytoplasme est plus abondant dans le néoplasme à cellules de Hürthle.
20x
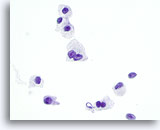
Figure 29
Néoplasme à cellules de Hürthle.
La binucléation fréquente montrée sur cette figure représente une autre caractéristique commune au néoplasme à cellules de Hürthle et au carcinome médullaire.
60x
Figure 29
Néoplasme à cellules de Hürthle.
La binucléation fréquente montrée sur cette figure représente une autre caractéristique commune au néoplasme à cellules de Hürthle et au carcinome médullaire.
60x
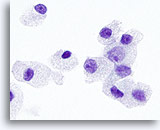
Figure 30
Néoplasme à cellules de Hürthle.
A fort grossissement, les granules cytoplasmiques et les nucléoles des néoplasmes à cellules de Hürthle sont plus grands et plus proéminents que ceux des carcinomes médullaires.
100x
Figure 30
Néoplasme à cellules de Hürthle.
A fort grossissement, les granules cytoplasmiques et les nucléoles des néoplasmes à cellules de Hürthle sont plus grands et plus proéminents que ceux des carcinomes médullaires.
100x
Résultat indéterminé de tumeur maligne – Néoplasme microfolliculaire avec apparition de cellules de Hürthle
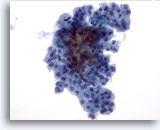
Figure 31
Néoplasme microfolliculaire avec apparition de cellules de Hürthle.
Groupes encombrés de cellules folliculaires sans colloïde dans le fond.
40x
Figure 31
Néoplasme microfolliculaire avec apparition de cellules de Hürthle.
Groupes encombrés de cellules folliculaires sans colloïde dans le fond.
40x
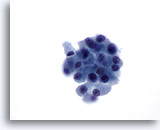
Figure 32
Néoplasme microfolliculaire avec apparition de cellules de Hürthle.
A plus fort grossissement, les cellules folliculaires semblent manquer de cohésion et présentent une quantité assez importante de cytoplasme granulaire. En revanche, toutes ces cellules n’ont pas de grands nucléoles proéminents.
60x
Figure 32
Néoplasme microfolliculaire avec apparition de cellules de Hürthle.
A plus fort grossissement, les cellules folliculaires semblent manquer de cohésion et présentent une quantité assez importante de cytoplasme granulaire. En revanche, toutes ces cellules n’ont pas de grands nucléoles proéminents.
60x
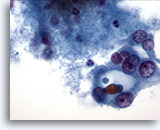
Figure 33
Néoplasme microfolliculaire avec apparition de cellules de Hürthle.
Les cellules de Hürthle situées dans le champ droit de cette image semblent former un microfollicule.
60x
Figure 33
Néoplasme microfolliculaire avec apparition de cellules de Hürthle.
Les cellules de Hürthle situées dans le champ droit de cette image semblent former un microfollicule.
60x
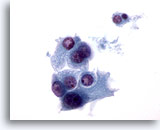
Figure 34
Néoplasme microfolliculaire avec apparition de cellules de Hürthle.
Sur cette image montrant une autre partie de l’échantillon que la Figure 33, le manque de cohésion de ces cellules de Hürthle est plus évident.
60x
Figure 34
Néoplasme microfolliculaire avec apparition de cellules de Hürthle.
Sur cette image montrant une autre partie de l’échantillon que la Figure 33, le manque de cohésion de ces cellules de Hürthle est plus évident.
60x
Résultat indéterminé de tumeur maligne – Néoplasme microfolliculaire
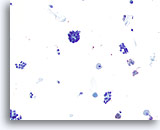
Figure 35
Néoplasme microfolliculaire.
Ce grossissement relativement faible fait apparaître des groupes/microfollicules encombrés dispersés avec certains macrophages dans le fond.
20x
Figure 35
Néoplasme microfolliculaire.
Ce grossissement relativement faible fait apparaître des groupes/microfollicules encombrés dispersés avec certains macrophages dans le fond.
20x
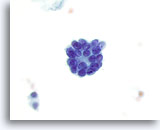
Figure 36
Néoplasme microfolliculaire.
Fort grossissement d’un microfollicule.
60x
Figure 36
Néoplasme microfolliculaire.
Fort grossissement d’un microfollicule.
60x
Lésion très probablement bénigne – concordant avec une lésion mixte (micro et macrofolliculaire)
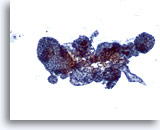
Figure 37
Lésion macrofolliculaire.
Présence de plusieurs follicules de taille variable.
10x
Figure 37
Lésion macrofolliculaire.
Présence de plusieurs follicules de taille variable.
10x
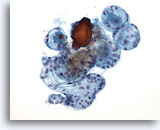
Figure 38
Lésion macrofolliculaire.
Un plus fort grossissement que la Figure 37 montre des follicules intacts de taille variable.
20x
Figure 38
Lésion macrofolliculaire.
Un plus fort grossissement que la Figure 37 montre des follicules intacts de taille variable.
20x
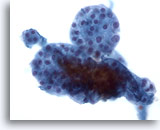
Figure 39
Lésion macrofolliculaire.
Un grossissement encore plus fort montre un groupe de petits follicules.
40x
Figure 39
Lésion macrofolliculaire.
Un grossissement encore plus fort montre un groupe de petits follicules.
40x
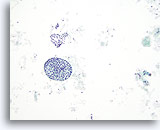
Figure 40
Lésion macrofolliculaire.
Cette image montre un macrofollicule et un amas de cellules folliculaires. Qu’ils se trouvent dans des follicules ou dans des amas, les macrofollicules sont caractérisés par des cellules folliculaires très espacées.
10x
Figure 40
Lésion macrofolliculaire.
Cette image montre un macrofollicule et un amas de cellules folliculaires. Qu’ils se trouvent dans des follicules ou dans des amas, les macrofollicules sont caractérisés par des cellules folliculaires très espacées.
10x
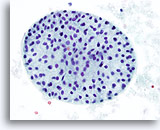
Figure 41
Lésion macrofolliculaire.
Plus fort grossissement du macrofollicule de la Figure 40.
40x
Figure 41
Lésion macrofolliculaire.
Plus fort grossissement du macrofollicule de la Figure 40.
40x

Figure 42
Lésion macrofolliculaire.
Le plus souvent, les macrofollicules se présentent sous la forme d’amas de cellules folliculaires comme sur cette image.
20x
Figure 42
Lésion macrofolliculaire.
Le plus souvent, les macrofollicules se présentent sous la forme d’amas de cellules folliculaires comme sur cette image.
20x
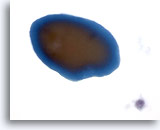
Figure 43
Lésion macrofolliculaire.
Sur les lames ThinPrep, un colloïde apparaît généralement sous la forme d’un fragment de matériel amorphe homogène avec bord saillant et deux nuances de couleur.
60x
Figure 43
Lésion macrofolliculaire.
Sur les lames ThinPrep, un colloïde apparaît généralement sous la forme d’un fragment de matériel amorphe homogène avec bord saillant et deux nuances de couleur.
60x
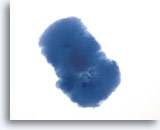
Figure 44
Lésion macrofolliculaire.
Le colloïde peut également présenter une texture légèrement irrégulière sur une lame ThinPrep.
60x
Figure 44
Lésion macrofolliculaire.
Le colloïde peut également présenter une texture légèrement irrégulière sur une lame ThinPrep.
60x
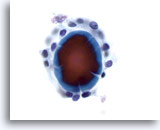
Figure 45
Lésion macrofolliculaire.
Le fragment de colloïde au centre d’un follicule montre des artefacts de fissuration.
60x
Figure 45
Lésion macrofolliculaire.
Le fragment de colloïde au centre d’un follicule montre des artefacts de fissuration.
60x
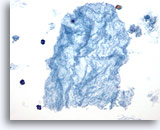
Figure 46
Lésion macrofolliculaire.
Ce matériel à l’aspect de papier s’est avéré fortement associé à la quantité de colloïde sur l’échantillon recueilli après thyroïdectomie et représente très probablement un colloïde séreux.
40x
Figure 46
Lésion macrofolliculaire.
Ce matériel à l’aspect de papier s’est avéré fortement associé à la quantité de colloïde sur l’échantillon recueilli après thyroïdectomie et représente très probablement un colloïde séreux.
40x
Absence de cellules malignes concordant avec une thyroïdite de Hashimoto

Figure 47
Thyroïdite de Hashimoto.
Présence de nombreuses cellules mononucléaires avec cytoplasme rare et d’un follicule lymphoïde.
20x
Figure 47
Thyroïdite de Hashimoto.
Présence de nombreuses cellules mononucléaires avec cytoplasme rare et d’un follicule lymphoïde.
20x
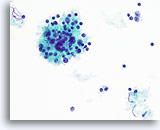
Figure 48
Thyroïdite de Hashimoto.
Un plus fort grossissement montre les cellules mononucléaires et le follicule lymphoïde avec cellules lymphoïdes à divers stades de maturation.
40x
Figure 48
Thyroïdite de Hashimoto.
Un plus fort grossissement montre les cellules mononucléaires et le follicule lymphoïde avec cellules lymphoïdes à divers stades de maturation.
40x
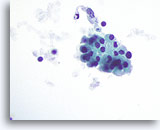
Figure 49
Thyroïdite de Hashimoto.
Groupe cohésif de cellules de Hürthle avec cytoplasme granulaire.
60x
Figure 49
Thyroïdite de Hashimoto.
Groupe cohésif de cellules de Hürthle avec cytoplasme granulaire.
60x
Retour au début
Retour à la table des matières

















































