Qualité du prélèvement
James Linder, MD
L’interprétation correcte d’un échantillon de frottis cervico-vaginal repose sur le nombre de cellules épithéliales malpighiennes. Dans la terminologie Bethesda 2001, les frottis doivent être classés dans la catégorie “satisfaisant pour l’évaluation” ou “non satisfaisant pour l’évaluation”. La catégorie “satisfaisant mais limité par” des précédentes classifications Bethesda a été éliminée. La présence ou l’absence d’éléments endocervicaux/de la zone de transformation et d’autres facteurs de qualité peut être incluse comme composant descriptif de la catégorie “Satisfaisant”, mais pas pour “limiter” la qualité. La présence d’un élément de la zone de transformation doit être justifiée par l’observation d’au moins 10 cellules endocervicales ou malpighiennes métaplasiques bien conservées. Si une lésion de haut grade ou un cancer est observé(e), il n’est pas nécessaire de signaler la présence/absence de cet élément.
SATISFAISANT POUR L’ÉVALUATION
En général, un échantillon doit contenir au minimum 5 000 cellules malpighiennes bien visualisées/conservées pour être considéré comme satisfaisant. Les éléments suivants doivent cependant être pris en compte :
- Des critères objectifs stricts ne peuvent pas être appliqués à tous les cas. Par exemple, les lames avec regroupement cellulaire, atrophie ou cytolyse sont techniquement complexes à compter. Les laboratoires doivent donc appliquer leur jugement professionnel et employer un processus d’examen hiérarchique pour évaluer ces lames.
- L’évaluation de la cellularité ne nécessite pas toujours un comptage. Si le cytotechnologiste pense que l’échantillon contient mois de 5 000 cellules malpighiennes bien visualisées/conservées, il peut avoir recours à un comptage sur le modèle suivant.
Tous les échantillons contenant des cellules anormales sont par définition satisfaisants pour l’évaluation. S’il s’avère nécessaire de compter les cellules malpighiennes dans une lame ThinPrep : 1. un minimum de 10 champs doit être compté dans un diamètre qui inclut le centre de la préparation. Le tableau suivant indique le nombre moyen de cellules par champ microscopique permettant d’atteindre 5 000 cellules :
|
DIAM PRÉP (mm)
SURFACE |
20
314.2 |
| Oculaire FN20 / objectif 10X |
# Nbre de champs à FN20 10X
# Nbre de cellules/champ pour un total de 5 000 |
100
50.0 |
| Oculaire FN20 / objectif 40X |
# Nbre de champs à FN20 40X
# Nbre de cellules/champ pour un total de 5 000 |
1600
3.1 |
| Oculaire FN22 / objectif 10X |
# Nbre de champs à FN22 10X
# Nbre de cellules/champ pour un total de 5 000 |
82.6
60.5 |
| Oculaire FN22 / objectif 40X |
# Nbre de champs à FN22 40X
# Nbre de cellules/champ pour un total de 5 000 |
1322
3.8 |
Formule à appliquer pour les oculaires absents du tableau ci-dessus :
Nombre de cellules requis par champ = 5000 / (Surface du cercle / Surface de l’oculaire)
Formule de calcul du diamètre d’un champ oculaire ou microscopique (exprimé en millimètres) : nombre de champs de l’oculaire / grossissement de l’objectif. La surface du champ peut être déterminée par la formule de calcul de la surface d’un cercle [pi x R²].
Pour les lames traitées avec le système d’imagerie ThinPrep®, la qualité doit être déterminée selon la procédure décrite dans le manuel de l’opérateur.
Le système Bethesda 2001 indique que des informations supplémentaires relatives à la signification des facteurs de qualité et des implications en termes de suivi de la patiente peuvent éventuellement être fournies dans une note. Le traitement et l’évaluation de prélèvements non satisfaisants sont très fastidieux. En effet, même si ces prélèvements ne peuvent pas exclure de lésion épithéliale, certaines informations utiles (présence d’organismes infectieux, etc.) peuvent être fournies pour faciliter la prise en charge directe de la patiente. Voici les termes indiqués par le système Bethesda 2001 pour clarifier ces éléments :
A) Frottis rejeté :
Échantillon rejeté (non traité) car ____ (échantillon non étiqueté, lame cassée, etc.)
B) Frottis non satisfaisant intégralement évalué :
Échantillon traité et examiné, mais non satisfaisant pour évaluation des anomalies épithéliales en raison de ____ (épithélium malpighien insuffisant dû à la présence de sang, etc.). Commentaires/recommandations supplémentaires, si nécessaire .
FACTEURS MASQUANTS
Les échantillons avec >75 % de cellules masquées doivent être classés dans la catégorie “non satisfaisant” (supposant l’absence de cellules anormales). Si entre 50 et 75 % de cellules sont masquées, le terme “satisfaisant” doit être suivi d’un commentaire indiquant que l’échantillon est partiellement masqué.
Les microphotographies de cet atlas présentent un large éventail d’échantillons cellulaires contenant du matériel malpighien et glandulaire adéquat. Nous avons également inclus des microphotographies illustrant des échantillons qui contiennent le nombre minimum de cellules, ainsi que des exemples d’éléments de la zone de transformation.

Rappel : Vous pouvez cliquer sur une image
de l’Atlas pour la voir dans un format plus grand.

Satisfaisant
Champ 10X représentatif contenant 60 cellules malpighiennes bien visualisées/conservées sur une lame ThinPrep adéquate.
Satisfaisant
Champ 10X représentatif contenant 60 cellules malpighiennes bien visualisées/conservées sur une lame ThinPrep adéquate.
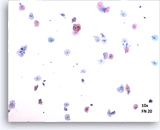
Satisfaisant
Champ 10X représentatif contenant 50 cellules malpighiennes bien visualisées/conservées sur une lame ThinPrep adéquate.
Satisfaisant
Champ 10X représentatif contenant 50 cellules malpighiennes bien visualisées/conservées sur une lame ThinPrep adéquate.

Non Satisfaisant
Champ 10X représentatif contenant 40 cellules malpighiennes bien visualisées/conservées sur une lame ThinPrep non satisfaisante.
Non Satisfaisant
Champ 10X représentatif contenant 40 cellules malpighiennes bien visualisées/conservées sur une lame ThinPrep non satisfaisante.
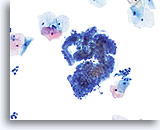
Élément de la zone de transformation
Cellules endocervicales disposées en palissade et en nid d’abeille composant un élément de la zone de transformation.
20X
Élément de la zone de transformation
Cellules endocervicales disposées en palissade et en nid d’abeille composant un élément de la zone de transformation.
20X
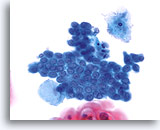
Élément de la zone de transformation
Cellules endocervicales cuboïdales plus petites avec noyau en haut de leur cytoplasme représentant un élément de la zone de transformation.
40X
Élément de la zone de transformation
Cellules endocervicales cuboïdales plus petites avec noyau en haut de leur cytoplasme représentant un élément de la zone de transformation.
40X
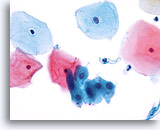
Élément de la zone de transformation
Cellules malpighiennes métaplasiques représentant un élément de la zone de transformation.
40X
Élément de la zone de transformation
Cellules malpighiennes métaplasiques représentant un élément de la zone de transformation.
40X
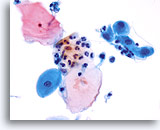
Élément de la zone de transformation
Métaplasie malpighienne représentant la zone de transformation.
40X
Élément de la zone de transformation
Métaplasie malpighienne représentant la zone de transformation.
40X
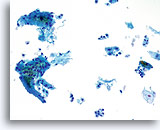
Facteur limitant
Cellules inflammatoires limitant le composant cellulaire malpighien de l’échantillon.
20X
Facteur limitant
Cellules inflammatoires limitant le composant cellulaire malpighien de l’échantillon.
20X
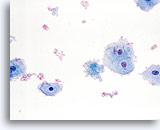
Facteur limitant
Sang limitant la qualité du composant cellulaire malpighien.
40X
Facteur limitant
Sang limitant la qualité du composant cellulaire malpighien.
40X
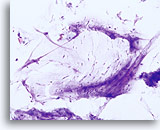
Facteur limitant
Lubrifiant limitant la qualité du composant cellulaire malpighien.
20X
Facteur limitant
Lubrifiant limitant la qualité du composant cellulaire malpighien.
20X
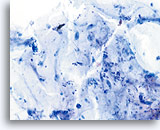
Facteur limitant
Mucus limitant la qualité du composant cellulaire malpighien.
20X
Facteur limitant
Mucus limitant la qualité du composant cellulaire malpighien.
20X
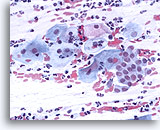
Frottis cervico-vaginal conventionnel
Frottis cervico-vaginal conventionnel avec zone de transformation et composants malpighiens.
40X
Frottis cervico-vaginal conventionnel
Frottis cervico-vaginal conventionnel avec zone de transformation et composants malpighiens.
40X
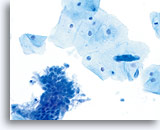
Frottis ThinPrep
Échantillon de la même patiente préparé avec la méthode ThinPrep. Présence de composants malpighiens et glandulaires.
40X
Frottis ThinPrep
Échantillon de la même patiente préparé avec la méthode ThinPrep. Présence de composants malpighiens et glandulaires.
40X
En résumé, quelle que soit la méthode de préparation de l’échantillon, un échantillonnage approprié et un diagnostic précis de l’état de santé de la patiente exigent le respect des consignes de prélèvement d’un test de Papanicolaou recommandées par le National Committee for Clinical Laboratory Standards (NCCLS). En cas d’accumulation de débris inflammatoires, de sang ou de mucus sur le col, cette accumulation apparaît sur la lame si elle n’est pas retirée au moment du prélèvement. L’utilisation de lubrifiant entravant le transfert des cellules sur la lame de verre, celle-ci ne fournit pas une représentation correcte de la situation de la patiente et peut entraîner un diagnostic erroné.
Un prélèvement approprié et un rinçage rapide complet des instruments de prélèvement permettent l’obtention d’un échantillon représentatif de l’épithélium de la patiente à transférer sur la lame de verre pendant le traitement, ainsi qu’une meilleure détection des pathologies du col.
SUGGESTIONS DE LECTURES :
- Bernstein SJ, et al: Liquid-based cervical cytologic smear study and conventional Papanicolaou smears: A metaanalysis of prospective studies comparing cytologic diagnosis and sample adequacy. Am J Obstet Gynecol 2001;185:308-17.
- Bethesda 2001 Post workshop recommendations.
www.bethesda2001.cancer.gov.
- Corkill M, et al: Specimen adequacy of ThinPrep sample preparations in a direct-to-vial study. Acta Cytol 1997;41:39-44.
- Darragh TM, et al: Comparison of conventional cytologic smears and ThinPrep preparations from the anal canal. Acta Cytol 1997; 41: 1167-70.
- Diaz-Rosario LA, Kabawat SE: Performance of a fluid-based, thin-layer Papanicolaou smear method in the clinical setting of an independent laboratory and an outpatient screening population in New England. Arch Pathol Lab Med 1999;123(9):817-21.
- Guidos BJ, Selvaggi SM: Use of the ThinPrep Pap Test in clinical practice. Diagn Cytopathol 1999;20:70-73.
- Haroon S, et al: Reproducibility of cervicovaginal ThinPrep® cellularity assessment. Diagn Cytolpathol 2002 jan;26(1):19-21.
- Henry JA, Wadehra V: Influence of smear quality on the rate of detecting significant cervical cytologic abnormalities. Acta Cytol 1996; 40: 529-35.
- Kivlahan C, Ingram E: Papanicolaou smears without endocervical cells. Are they inadequate? Acta Cytol 1986; 30: 258-60.
- Mintzer MP, et al: The effect of the quality of Papanicolaou smears on the detection of cytologic abnormalities. Cancer Cytopathol 1999; 87: 113-7.
- Mitchell HS: Longitudinal analysis of histologic high-grade disease after negative cervical cytology according to endocervical status. Cancer 2001;Aug 25;93(4):237-40.
- Papillo J, et al: Evaluation of the ThinPrep Pap Test in clinical practice: a seven-month 16,314-case experience in northern Vermont. Acta Cytol 1998;42:204-208.
- Renshaw AA, et al: Accuracy and reproducibility of estimating the adequacy of the squamous component of cervicovaginal smears. Am J Clin Path 1999; 111: 38-42.
- Selvaggi SM, Guidos BJ: Specimen adequacy and the ThinPrep Pap Test: The endocervical component. Diagn Cytopathol 2000; 23(1):23-26.
- Sherman ME, et al: Cytologic diagnosis of anal intraepithelial neoplasia using smears and Hologic Thin-Preps. Mod Path 1995; 8: 270-74.
- Spires SE, et al: Assessment of cervicovaginal smear adequacy. The Bethesda system guidelines and reproducibility. Am J Clin Path 1994; 102: 354-9.
- Timmerman TG, et al: Objective criteria to determine cellularity in the ThinPrep Papanicolaou test. Acta Cytol 1998; 42: 1242.
- Valente P et al: The determination of Papanicolaou smear adequacy using a semiquantitative method to evaluate cellularity. Diagn Cytopathol 1991; 7: 576-80.
Retour au début













