Adecuación de la muestra
James Linder, MD
Para que una muestra pueda ser interpretada correctamente, debe contener un número adecuado de células epiteliales escamosas. La terminología del sistema Bethesda 2001 recomienda que las extensiones sean clasificadas como “satisfactorias para la evaluación” o “insatisfactoria para la evaluación”. La categoría “satisfactorio pero limitado por”, que se mencionaba en los esquemas previos de Bethesda fue eliminada. Una descripción de la presencia o ausencia de componente endocervical/zona de transformación y otros factores cualitativos cualesquiera se pueden incluir como componentes descriptivos de “satisfactoria”, pero no “limitan” la adecuación de la muestra. Se deben observar al menos 10 células bien conservadas endocervicales o metaplásicas para informar que está presente el componente de la zona de transformación. Si el espécimen muestra una lesión de alto grado o cáncer, no es necesario informar de la presencia / ausencia del componente de transformación.
SATISFACTORIO PARA LA EVALUACIÓN
Generalmente son necesarias un mínimo de 5000 células escamosas bien visualizadas / preservadas para que la muestra sea considerada satisfactoria, con las siguientes precauciones:
- Es reconocido que los criterios objetivos estrictos no son aplicables en cada caso. Por ejemplo, extendidos con agrupamiento celular, atrofia, o citólisis son técnicamente difíciles de contar, y los laboratorios deben aplicar su propia experiencia y emplear una revisión jerárquica cuando se evalúen estos extendidos
- No todas las muestras requieren realizar un contaje para asegurar la celularidad. Si el citotécnico piensa que hay menos de 5000 células escamosas se puede utilizar un esquema de contaje como el siguiente
Cualquier muestra con células atípicas es por definición satisfactoria para evaluación. Si es necesario contar células escamosas en una portaobjetos ThinPrep: 1.- Se deben contar un mínimo de 10 campos a lo largo de un diámetro que incluya el centro de la preparación. El porcentaje de células por campo microscópico para asegurar 5000 células se muestra en la tabla siguiente:
|
DIAM DE PREP mm
AREA |
20
314.2 |
| ocularFN20 /objetivo 10x |
# Nº Campos FN20 10x
# Nº Células/Campo para total de 5K |
100
50.0 |
| ocularFN20 /objetivo40x |
# Nº Campos FN20 40x
# Nº Células/Campo para total de 5K |
1600
3.1 |
| ocularFN22 /objetivo10x |
# Nº Campos FN22 10x
# Nº Células/Campo para total de 5K |
82.6
60.5 |
| ocularFN22 /objetivo40x |
# Nº Campos FN22 40x
# Nº Células/Campo para total de 5K |
1322
3.8 |
Para microscopios que utilizan oculares que no se muestran aquí, la fórmula es la siguiente:
Numero de Células Necesarias por Campo=
5000 / (Área del círculo / Área del Ocular)
El diámetro de un ocular o un campo microscópico en milímetros es el número de campo del ocular dividido por el aumento del objetivo. El área del campo se puede entonces determinar por la fórmula del área de un círculo (pí x radio al cuadrado).
Para los portas procesados con el Sistema de Imagen ThinPrep, la adecuación debe determinarse como se indica en el Manual del Operador.
De acuerdo con el Bethesda 2001, la información adicional en el contexto de adecuación de la muestra y cualquier implicación para el seguimiento de la paciente se puede realizar opcionalmente en una sugerencia o nota didáctica. Los extendidos insatisfactorios que son procesados y evaluados requieren un tiempo y esfuerzo considerables. Mientras que tales muestras no pueden excluir una lesión epitelial, pueden proporcionar alguna información útil (presencia de organismos infecciosos, etc.) que puede ayudar a futuros tratamientos del paciente. El vocabulario sugerido por el Sistema Bethesda 2001 para clarificar los informes es el siguiente:
A) Muestra Rechazada:
Muestra rechazada (no procesada) debido a _____ (la muestra no estaba etiquetada, el portaobjetos estaba roto, etc.)
B) Muestra evaluada en su totalidad e insatisfactoria.
Muestra evaluada y examinada, pero insatisfactoria para la evaluación de anomalías epiteliales debido a _______ (insuficiente epitelio escamoso debido a abundantes hematíes, etc.) Comentarios o recomendaciones, según corresponda:
FACTORES QUE INTERFIEREN EN LA EVALUACIÓN DE LA MUESTRA
Las muestra con más del 75% de las células enmascaradas, no claramente visibles para efectuar una evaluación adecuada, deben ser calificadas de insatisfactorias. Cuando entre un 50-75% de las células están enmascaradas, tras el término satisfactorio es preciso que le siga una aclaración describiendo que la muestra está parcialmente cubierta.
Las fotomicrografías que contiene este atlas mostrarán una amplia variedad de muestras celulares que contiene material escamoso y glandular adecuado. Para este propósito, las fotomicrografías incluyen el número mínimo de células para que la muestra sea adecuada, así como ejemplos de los componentes de la zona de transformación.

Nota: Puede clicar en cualquier imagen del
Atlas para ver la imagen aumentada

Satisfactorio:
Imagen de un campo representativo a 10X que contiene 60 células escamosas bien visualizadas/preservadas de un porta adecuado ThinPrep
Satisfactorio:
Imagen de un campo representativo a 10X que contiene 60 células escamosas bien visualizadas/preservadas de un porta adecuado ThinPrep
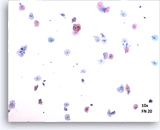
Satisfactorio:
Imagen de un campo representativo a 10X que contiene 50 células escamosas bien visualizadas/preservadas de un porta adecuado ThinPrep
Satisfactorio:
Imagen de un campo representativo a 10X que contiene 50 células escamosas bien visualizadas/preservadas de un porta adecuado ThinPrep

Insatisfactorio
Imagen de un campo representativo a 10X que contiene 40 células escamosas bien visualizadas/preservadas de un porta ThinPrep insatisfactorio.
Insatisfactorio
Imagen de un campo representativo a 10X que contiene 40 células escamosas bien visualizadas/preservadas de un porta ThinPrep insatisfactorio.
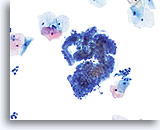
Componente de la Zona de Transformación
Células endocervicales demostrando tanto agrupaciones en empalizada como en panal de abeja forman parte de un componente de la zona de transformación.20X
Componente de la Zona de Transformación
Células endocervicales demostrando tanto agrupaciones en empalizada como en panal de abeja forman parte de un componente de la zona de transformación. 20X
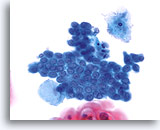
Componente de la Zona de Transformación
Células endocervicales cuboidales más pequeñas con el núcleo localizado en el borde del citoplasma proporciona un componente de la zona de transformación. 40X
Componente de la Zona de Transformación
Células endocervicales cuboidales más pequeñas con el núcleo localizado en el borde del citoplasma proporciona un componente de la zona de transformación. 40X
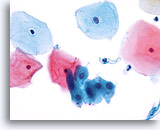
Componente de la Zona de Transformación
Las células metaplásicas escamosas representan un componente de la zona de transformación.40X
Componente de la Zona de Transformación
Las células metaplásicas escamosas representan un componente de la zona de transformación. 40X
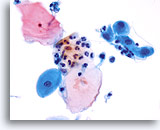
Componente de la Zona de Transformación
La metaplasia escamosa representa la zona de transformación
40X
Componente de la Zona de Transformación
La metaplasia escamosa representa la zona de transformación
40X
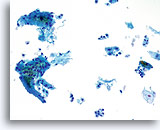
Factor limitante:
Las células inflamatorias limitan el componente de células escamosas de la muestra 20X
Factor limitante:
Las células inflamatorias limitan el componente de células escamosas de la muestra 20X
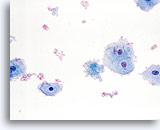
Factor limitante:
La sangre limita la adecuación del componente celular escamoso. 40X
Factor limitante:
La sangre limita la adecuación del componente celular escamoso. 40X
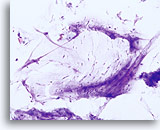
Factor limitante:
Lubricante limitando la adecuación del componente celular escamoso. 20X
Factor limitante:
Lubricante limitando la adecuación del componente celular escamoso. 20X
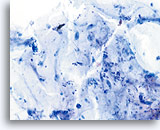
Factor limitante:
Moco limitando la adecuación del componente celular escamoso. 20X
Factor limitante:
Moco limitando la adecuación del componente celular escamoso. 20X
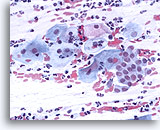
Extensión Convencional
Extensión convencional con la zona de transformación y los componentes escamosos. 40X
Extensión Convencional
Extensión convencional con la zona de transformación y los componentes escamosos. 40X
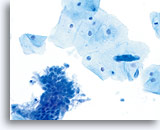
ThinPrep Pap Test
El mismo paciente, muestra preparada con el método ThinPrep. Están presentes los componentes escamoso y glandular.40X
ThinPrep Pap Test
El mismo paciente, muestra preparada con el método ThinPrep. Están presentes los componentes escamoso y glandular. 40X
En resumen, Sin tener en cuenta de cómo se prepara la muestra, siguiendo las guías para una correcta recogida del test de Papanicolaou, como se recomienda por el Comité Nacional para Standards de Laboratorio Clínico (NCCLS), es esencial para una toma de muestra adecuada y un diagnostico certero de las condiciones de la paciente. Si los restos inflamatorios, sangre o moco se acumulan en el cérvix y no se quita adecuadamente, el acúmulo será recogido y aparecerá en el portaobjetos. Si se utiliza lubricante interferirá en la transferencia de células al cristal. Consecuentemente el cristal no representará las condiciones del paciente y puede llevar a un diagnóstico erróneo
Una toma de muestra adecuada, junto con el completo enjuagado del dispositivo (s) de recogida en una forma correcta, permitirá que una muestra representativa del epitelio del paciente sea transferida al cristal durante el procesamiento y una mejora en la detección de lesión del cérvix
LECTURAS RECOMENDADAS:
- Bernstein SJ, et al: Liquid-based cervical cytologic smear study and conventional Papanicolaou smears: A metaanalysis of prospective studies comparing cytologic diagnosis and sample adequacy. Am J Obstet Gynecol 2001;185:308-17.
- Bethesda 2001 Post workshop recommendations.
www.bethesda2001.cancer.gov.
- Corkill M, et al: Specimen adequacy of ThinPrep sample preparations in a direct-to-vial study. Acta Cytol 1997;41:39-44.
- Darragh TM, et al: Comparison of conventional cytologic smears and ThinPrep preparations from the anal canal. Acta Cytol 1997; 41: 1167-70.
- Diaz-Rosario LA, Kabawat SE: Performance of a fluid-based, thin-layer Papanicolaou smear method in the clinical setting of an independent laboratory and an outpatient screening population in New England. Arch Pathol Lab Med 1999;123(9):817-21.
- Guidos BJ, Selvaggi SM: Use of the ThinPrep Pap Test in clinical practice. Diagn Cytopathol 1999;20:70-73.
- Haroon S, et al: Reproducibility of cervicovaginal ThinPrep® cellularity assessment. Diagn Cytolpathol 2002 jan;26(1):19-21.
- Henry JA, Wadehra V: Influence of smear quality on the rate of detecting significant cervical cytologic abnormalities. Acta Cytol 1996; 40: 529-35.
- Kivlahan C, Ingram E: Papanicolaou smears without endocervical cells. Are they inadequate? Acta Cytol 1986; 30: 258-60.
- Mintzer MP, et al: The effect of the quality of Papanicolaou smears on the detection of cytologic abnormalities. Cancer Cytopathol 1999; 87: 113-7.
- Mitchell HS: Longitudinal analysis of histologic high-grade disease after negative cervical cytology according to endocervical status. Cancer 2001;Aug 25;93(4):237-40.
- Papillo J, et al: Evaluation of the ThinPrep Pap Test in clinical practice: a seven-month 16,314-case experience in northern Vermont. Acta Cytol 1998;42:204-208.
- Renshaw AA, et al: Accuracy and reproducibility of estimating the adequacy of the squamous component of cervicovaginal smears. Am J Clin Path 1999; 111: 38-42.
- Selvaggi SM, Guidos BJ: Specimen adequacy and the ThinPrep Pap Test: The endocervical component. Diagn Cytopathol 2000; 23(1):23-26.
- Sherman ME, et al: Cytologic diagnosis of anal intraepithelial neoplasia using smears and Hologic Thin-Preps. Mod Path 1995; 8: 270-74.
- Spires SE, et al: Assessment of cervicovaginal smear adequacy. The Bethesda system guidelines and reproducibility. Am J Clin Path 1994; 102: 354-9.
- Timmerman TG, et al: Objective criteria to determine cellularity in the ThinPrep Papanicolaou test. Acta Cytol 1998; 42: 1242.
- Valente P et al: The determination of Papanicolaou smear adequacy using a semiquantitative method to evaluate cellularity. Diagn Cytopathol 1991; 7: 576-80.
Volver arriba













