Adeguatezza del campione
James Linder, medico
Per interpretare correttamente un campione per il Pap test, è necessario che questo contenga un numero adeguato di cellule epiteliali squamose. La terminologia utilizzata al congresso Bethesda 2001 suddivide i Pap test in “soddisfacenti ai fini della valutazione” o “inadeguati ai fini della valutazione”. La categoria “soddisfacenti ma limitati da”, che faceva parte della precedente classificazione Bethesda, è stata eliminata. E’ possibile includere l’eventuale presenza o assenza del componente endocervicale /della giunzione squamo-colonnare e di qualsiasi altro fattore qualitativo come componente descrittiva “Soddisfacente”ma non come fattore limitante l’adeguatezza. È necessario osservare almeno 10 cellule endocervicali o metaplastiche squamose per sostenere la presenza di un componente della giunzione squamo-colonnare. Se il campione presenta una lesione di alto grado o un cancro, non è necessario comunicare la presenza/assenza di un componente della giunzione squamo-colonnare.
SODDISFACENTE AI FINI DELLA VALUTAZIONE
In genere, sono necessarie almeno 5.000 cellule squamose ben visibili e conservate per considerare soddisfacente un campione, tenendo presenti i seguenti punti:
- È comunemente accettato che criteri oggettivi rigorosi non sono applicabili in ogni situazione. Ad esempio, i vetrini con raggruppamenti di cellule, atrofia o citolisi presentano difficoltà tecniche durante il conteggio e durante la valutazione i laboratori sono tenuti ad applicare giudizi professionali e a praticare un esame gerarchico.
- Non tutti i campioni richiedono un conteggio che ne determini la cellularità. Se il citotecnologo ritiene che possano essere presenti meno di 5.000 cellule squamose ben visibili e conservate, è possibile utilizzare lo schema di conteggio riportato di seguito.
Tutti i campioni con cellule anormali sono per definizione soddisfacenti ai fini della valutazione. Se è necessario contare le cellule squamose in un vetrino ThinPrep: 1. devono essere conteggiati almeno 10 campi lungo un diametro che include il centro della preparazione. Nella tabella seguente viene riportato il numero medio di cellule che devono essere presenti affinché il campo del microscopio raggiunga le 5.000 cellule.
|
DIAM PREP (mm)
AREA |
20
314.2 |
| Lente FN20/obiettivo 10X |
N. campi con FN20 10X
N. cellule/campo per un totale di 5.000 |
100
50.0 |
| Lente FN20/obiettivo 40X |
N. campi con FN20 40X
N. cellule/campo per un totale di 5.000 |
1600
3.1 |
| Lente FN22/obiettivo 10X |
N. campi con FN22 10X
N. cellule/campo per un totale di 5.000 |
82.6
60.5 |
| Lente FN22/obiettivo 40X |
N. campi con FN22 40X
N. cellule/campo per un totale di 5.000 |
1322
3.8 |
Qualora si utilizzassero oculari non riportati, la formula è:
Numero di cellule necessarie per campo =
5.000 / (area del cerchio / area dell’oculare)
Il diametro in millimetri di un oculare o di un campo del microscopio è il numero del campo della lente diviso per la capacità d’ingrandimento dell’obiettivo. È possibile determinare l’area del campo utilizzando la formula dell’area del cerchio [pi X (raggio al quadrato)].
Per i vetrini elaborati con il sistema di rappresentazione delle immagini ThinPrep® l’adeguatezza deve essere determinata come indicato nel Manuale dell’operatore.
In base al Bethesda 2001, è possibile fornire informazioni aggiuntive sul significato dei qualificatori di adeguatezza ed eventuali implicazioni per le visite di controllo della paziente in una nota didattica. I Pap test inadeguati che vengono elaborati e valutati richiedono un notevole dispendio di tempo ed energie. Nonostante questi campioni non consentano di escludere una lesione epiteliale, possono fornire comunque alcune utili informazioni (presenza di organismi infettivi, ecc.), che facilitano la futura gestione della paziente. Di seguito viene riportata la terminologia suggerita dal Bethesda 2001 per rendere chiare le relazioni.
A) Preparato rifiutato:
Campione rifiutato (non elaborato) a causa di ____ (campione non etichettato, vetrino rotto, ecc.)
B)Preparato inadeguato completamente valutato:
Campione elaborato ed esaminato, ma inadeguato per la valutazione di anomalie epiteliali a causa di ____ (epitelio squamoso insufficiente a causa di sangue, ecc.) Commenti/segnalazioni aggiuntivi, in base alle esigenze
FATTORI DI OSCURAMENTO
I campioni con >75% di cellule oscurate devono essere considerati inadeguati (se si presume che non siano presenti cellule anormali). Se la percentuale di cellule oscurate è compresa tra il 50% e il 75%, il termine “Soddisfacente” deve essere accompagnato da una dichiarazione che descrive il parziale oscuramento del campione.
Le microfotografie contenute nell’Atlante mostrano una vasta gamma di campioni cellulari contenenti materiale squamoso e ghiandolare adeguato. Ai fini della comprensione di questo argomento, le microfotografie contenenti il numero minimo di cellule per garantire l’adeguatezza del campione sono state incluse accanto ad esempi di componenti della giunzione squamo-colonnare.

Ricorda: Puoi cliccare su qualsiasi immagine per ingrandire l’immagine.

Soddisfacente
Campo rappresentativo 10X con 60 cellule squamose ben visibili e conservate provenienti da un vetrino ThinPrep adeguato.
Soddisfacente
Campo rappresentativo 10X con 60 cellule squamose ben visibili e conservate provenienti da un vetrino ThinPrep adeguato.
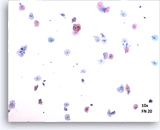
Soddisfacente
Campo rappresentativo 10X con 50 cellule squamose ben visibili e conservate provenienti da un vetrino ThinPrep adeguato.
Soddisfacente
Campo rappresentativo 10X con 50 cellule squamose ben visibili e conservate provenienti da un vetrino ThinPrep adeguato.

Inadeguato
Campo rappresentativo 10X con 40 cellule squamose ben visibili e conservate provenienti da un vetrino ThinPrep inadeguato.
Inadeguato
Campo rappresentativo 10X con 40 cellule squamose ben visibili e conservate provenienti da un vetrino ThinPrep inadeguato.
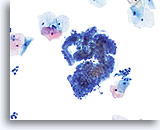
Componente della giunzione squamo-colonnare
Le cellule endocervicali con disposizioni a palizzata e a nido d’ape costituiscono un componente della giunzione squamo-colonnare.
20X
Componente della giunzione squamo-colonnare
Le cellule endocervicali con disposizioni a palizzata e a nido d’ape costituiscono un componente della giunzione squamo-colonnare.
20X
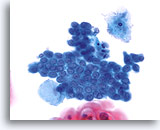
Componente della giunzione squamo-colonnare
Le cellule endocervicali cuboidali più piccole con nuclei posizionati sopra il citoplasma costituiscono un componente della giunzione squamo-colonnare.
40X
Componente della giunzione squamo-colonnare
Le cellule endocervicali cuboidali più piccole con nuclei posizionati sopra il citoplasma costituiscono un componente della giunzione squamo-colonnare.
40X
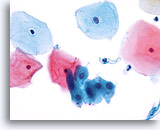
Componente della giunzione squamo-colonnare
Le cellule metaplastiche squamose rappresentano un componente della giunzione squamo-colonnare.
40X
Componente della giunzione squamo-colonnare
Le cellule metaplastiche squamose rappresentano un componente della giunzione squamo-colonnare.
40X
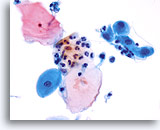
Componente della giunzione squamo-colonnare
La metaplasia squamosa rappresenta la giunzione squamo-colonnare.
40X
Componente della giunzione squamo-colonnare
La metaplasia squamosa rappresenta la giunzione squamo-colonnare. 40X
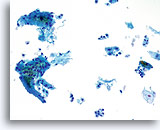
Fattore limitante
Cellule infiammatorie che limitano il componente delle cellule squamose del campione.
20X
Fattore limitante
Cellule infiammatorie che limitano il componente delle cellule squamose del campione. 20X
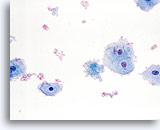
Fattore limitante
Sangue che limita l’adeguatezza del componente delle cellule squamose.
40X
Fattore limitante
Sangue che limita l’adeguatezza del componente delle cellule squamose. 40X
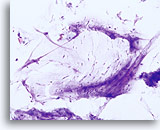
Fattore limitante
Lubrificante che limita l’adeguatezza del componente delle cellule squamose. 20X
Fattore limitante
Lubrificante che limita l’adeguatezza del componente delle cellule squamose. 20X
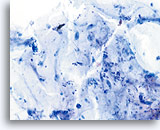
Fattore limitante
Muco che limita l’adeguatezza del componente delle cellule squamose. 20X
Fattore limitante
Muco che limita l’adeguatezza del componente delle cellule squamose. 20X
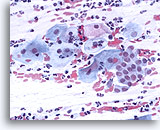
Striscio tradizionale
Striscio tradizionale con giunzione squamo-colonnare e componenti squamosi.
40X
Striscio tradizionale
Striscio tradizionale con giunzione squamo-colonnare e componenti squamosi. 40X
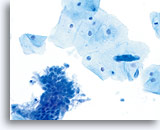
ThinPrep Pap Test
Stesso campione paziente preparato con il metodo ThinPrep. Sono presenti componenti squamosi e ghiandolari. 40X
ThinPrep Pap Test
Stesso campione paziente preparato con il metodo ThinPrep. Sono presenti componenti squamosi e ghiandolari. 40X
In sintesi, a prescindere dalla modalità di preparazione del campione, è essenziale rispettare le linee guida indicate per la raccolta corretta di un test Papanicolaou dal National Committee for Clinical Laboratory Standards (NCCLS), in modo da effettuare un campionamento adeguato e formulare una diagnosi accurata della condizione della paziente. Se nella cervice si accumulano frammenti infiammatori, sangue o muco che non vengono rimossi, l’accumulo viene raccolto e compare nel vetrino. Se si utilizza del lubrificante, è possibile che questo interferisca con il trasferimento delle cellule sul vetrino. Di conseguenza, il vetrino non è rappresentativo della condizione della paziente e può generare una diagnosi sbagliata.
Una raccolta adeguata e il risciacquo tempestivo e completo dei dispositivi di raccolta garantiscono il trasferimento di un campione rappresentativo dell’epitelio della paziente sul vetrino durante l’elaborazione e un significativo miglioramento nell’individuazione di una malattia della cervice.
BIBLIOGRAFIA CONSIGLIATA:
- Bernstein SJ, et al: Liquid-based cervical cytologic smear study and conventional Papanicolaou smears: A metaanalysis of prospective studies comparing cytologic diagnosis and sample adequacy. Am J Obstet Gynecol 2001;185:308-17.
- Bethesda 2001 Post workshop recommendations.
www.bethesda2001.cancer.gov.
- Corkill M, et al: Specimen adequacy of ThinPrep sample preparations in a direct-to-vial study. Acta Cytol 1997;41:39-44.
- Darragh TM, et al: Comparison of conventional cytologic smears and ThinPrep preparations from the anal canal. Acta Cytol 1997; 41: 1167-70.
- Diaz-Rosario LA, Kabawat SE: Performance of a fluid-based, thin-layer Papanicolaou smear method in the clinical setting of an independent laboratory and an outpatient screening population in New England. Arch Pathol Lab Med 1999;123(9):817-21.
- Guidos BJ, Selvaggi SM: Use of the ThinPrep Pap Test in clinical practice. Diagn Cytopathol 1999;20:70-73.
- Haroon S, et al: Reproducibility of cervicovaginal ThinPrep® cellularity assessment. Diagn Cytolpathol 2002 jan;26(1):19-21.
- Henry JA, Wadehra V: Influence of smear quality on the rate of detecting significant cervical cytologic abnormalities. Acta Cytol 1996; 40: 529-35.
- Kivlahan C, Ingram E: Papanicolaou smears without endocervical cells. Are they inadequate? Acta Cytol 1986; 30: 258-60.
- Mintzer MP, et al: The effect of the quality of Papanicolaou smears on the detection of cytologic abnormalities. Cancer Cytopathol 1999; 87: 113-7.
- Mitchell HS: Longitudinal analysis of histologic high-grade disease after negative cervical cytology according to endocervical status. Cancer 2001;Aug 25;93(4):237-40.
- Papillo J, et al: Evaluation of the ThinPrep Pap Test in clinical practice: a seven-month 16,314-case experience in northern Vermont. Acta Cytol 1998;42:204-208.
- Renshaw AA, et al: Accuracy and reproducibility of estimating the adequacy of the squamous component of cervicovaginal smears. Am J Clin Path 1999; 111: 38-42.
- Selvaggi SM, Guidos BJ: Specimen adequacy and the ThinPrep Pap Test: The endocervical component. Diagn Cytopathol 2000; 23(1):23-26.
- Sherman ME, et al: Cytologic diagnosis of anal intraepithelial neoplasia using smears and Hologic Thin-Preps. Mod Path 1995; 8: 270-74.
- Spires SE, et al: Assessment of cervicovaginal smear adequacy. The Bethesda system guidelines and reproducibility. Am J Clin Path 1994; 102: 354-9.
- Timmerman TG, et al: Objective criteria to determine cellularity in the ThinPrep Papanicolaou test. Acta Cytol 1998; 42: 1242.
- Valente P et al: The determination of Papanicolaou smear adequacy using a semiquantitative method to evaluate cellularity. Diagn Cytopathol 1991; 7: 576-80.
Torna a inizio pagina













