妇科地图集 第一部分
鸣谢
Suzanne M. Werneke, BA, CT(ASCP)
在此,我想向 Kurt Douglass, CT (ASCP) 表示感谢,他由始至终都在为此项目而努力,并感谢他所提供的) ThinPrep 细胞形态参考手册 最初版本,该手册至今仍在使用。此外,Mike LeDonne, CT (ASCP) 提供了许多早期的数码图片,这些图片已在本图谱中使用;我也要向其表示感谢。
本人还想向我们所有的特邀编辑致谢,他们为达到最后期限要求都付出了辛勤的劳动。从这些病理学家和细胞学技师的每个人身上,我们都受益良多;我们对他们的热情表示感谢,并对他们在细胞检测领域投入的激情表示钦佩。
最后,我还要向 Charlotte L. Brahm, CT(ASCP) 总编表示诚挚的谢意;虽然本图谱内未曾出现其姓名,但他却付出了孜孜不倦的努力,并使该图谱成功出炉。
参与者:
Raheela Ashfaq, MD
Professor, Department of Pathology, University of Texas Southwestern Medical Center, and Director of Cytopathology and Oncodiagnostic Laboratory, Parkland Health and Hospital, Dallas, TX
R. Marshall Austin, MD, PhD
Medical Director and Director of Cytopathology and Gynecologic Pathology Services, Coastal Pathology Associates, Charleston, SC
John M. Bauer, MD
Medical Director, Piedmont Pathology, Incorporated, Hickory, NC
Diane D. Davey, MD
Professor of Pathology and Laboratory Medicine, Director of Cytopathology and Bone Marrow Service, Director of Cytopathology Fellowship Program, University of Kentucky, Lexington, KY
Luis A. Diaz-Rosario, MD
Medical Director, Anatomic Pathology, Quest Diagnostics, Incorporated, Tampa, FL
Martha L. Hutchinson, MD, PhD
Associate Professor Pathology, Brown University, Providence, RI
Deanna K. Iverson, MHS, SCT(ASCP), HTL
Pathology Manager, Palo Alto Medical Foundation, Palo Alto, CA
Joyce E. Johnson, MD
Associate Professor, Department of Pathology, Director Division of Education, Vanderbilt University Medical Center, Nashville, TN
James Linder, MD
Medical Director, Hologic, Inc., Marlborough, MA; Professor, Pathology and Microbiology,
University of Nebraska Medical Center, Omaha, NE
Jacalyn L. Papillo, BS, CT(ASCP)
Cytopathology Manager, Fletcher Allen Healthcare, Burlington, VT
Pamela Smith Piraino, CT(ASCP)
Clear Path Diagnostics, Syracuse, NY
Richard A. Smith, MD, PhD
Chief of Pathology, Sturdy Memorial Hospital, Attleboro, MA
Zahniser, David, PhD
President, Diagnostic Vision Incorporated, Wellesley, MA
简介
本图谱旨在帮助细胞学技师和病理学家们拓展和完善自己在使用 ThinPrep®涂片检测法诊断妇科细胞疾病时的专业水平。ThinPrep 涂片检测法的早期研究与开发工作在 Hologic 公司完成;这为与传统巴氏涂片法进行对比建立了一个基础。自那时起,便得到了来自全球其它从事临床工作的细胞学技师和病理学家的帮助,并使得该基础得到了完善。对于 ThinPrep 涂片检测法的用户而言,本参考图谱旨在成为一种培训工具和一部不断更新的参考资料。
由于该图谱的编制工作是在“美国国家癌症研究所”完成,并由 Robert J. Kurman 和 Diane Solomon 在名为The Bethesda System for Reporting Cervical/Vaginal Cytologic Diagnoses: Definitions, Criteria and Explanatory Notes for Terminology and Specimen Adequacy and Art and Science of Cytopathology. (New York: Springer-Verlag, 1994) 的出版物中撰写摘要,因此该图谱的编排方式与 Bethesda 系统相对应。该图谱还包含有更新内容,并将 Bethesda 2001 命名规则包括在内。此外,对于涉及异型性、非典型性和恶性度更高的细胞诊断标准,本图谱还参考了由 Richard DeMay 编撰的 Art and Science of Cytopathology。
对于各种诊断类别,这些图片展示了通过 ThinPrep 涂片检测 (TPPT) 法所看到的细胞形态、与之对应的传统巴氏涂片外貌,以及主要的相似本体。如果没有特别说明,本图谱中的所有图片均表示 ThinPrep 玻片。这些图片旨在展示在 ThinPrep 标本涂片上所发现的典型形态,并可能会对其进行个别诊断。
THINPREP 涂片方法概述
ThinPrep® 标本涂片系统经过 FDA 认证,可作为传统方法的替代法,用于检测非典型细胞、宫颈癌及其前期病变,以及其他由 Bethesda 系统定义的癌细胞类别。经证实,ThinPrep 涂片检测法与传统的巴氏涂片法相比,在检测低度鳞状上皮内病变 (LSIL),以及不同患者人群中恶性度更高的病变方面更为有效(包括在采用直接装入标本瓶式 HSIL 检测法来检测 HSIL 和恶性度更高的病变时,检出率提高了 59.7%)。此外,与传统的巴氏涂片法相比,标本质量也有显著提高。
在提高涂片检测准确性方面,优化的标本采集法和涂片方法都是最为重要的因素。由于传统涂片与 ThinPrep 涂片检测法所采用的标本涂片流程有所不同,这使得传统涂片与 ThinPrep 标本在显微镜下的外貌也有所不同。如果要对 ThinPrep 涂片检测玻片进行正确的诊断,则需要对 ThinPrep 涂片法有所了解。如果样本质量会对标本的保存和读片造成影响,则这点便会尤为重要。出于这种原因,现将 ThinPrep 涂片法概述如下。
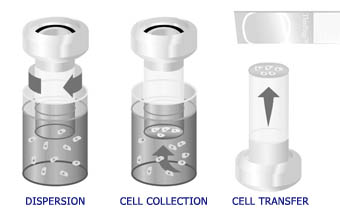
ThinPrep 处理器能够自动完成涂片流程,包括标本分散、精确过滤并将细胞收集到滤膜上,以及将细胞转移至显微镜玻片上。
ThinPrep 处理器:
操作原理
ThinPrep 涂片流程首先由临床医生使用毛刷或毛刷/塑料抹片组合装置,采集患者的妇科标本。然后,将该装置放入装有 PreservCyt® 溶液的标本瓶中漂洗。在此之后,对该 ThinPrep 标本瓶进行封装、贴标签处理,并将其送至配备有 ThinPrep 处理器的实验室中。
在实验室中,该标本瓶会与相应的细胞检测申请表相对应;然后会为该表、标本瓶以及 ThinPrep 光镜玻片分配一个细胞检测编号。与一次性妇科过滤器柱体(刮取用过滤器)一道,该标本瓶以及与之匹配的玻片会被放入 ThinPrep 处理器中,并由操作人员选择合适的玻片顺序。在旋转过滤器 (T2000) 或标本瓶 (T3000) 时,液体内会产生一定的剪切力,这足以使随机混入的物质、血细胞、粘液和非诊断性细胞碎片得到分离,同时使实际所需的细胞团保持完整;由此,该仪器便使标本得到均匀的分布。如果漂洗正确,所收集到的细胞便会全部进入溶液;而不是像在进行传统的巴氏涂片之后,细胞会残留在采集装置上,并被丢弃掉。加上细胞标本在离心阶段已得到均匀的分布,这样便使得转移至玻片上的细胞标本具有一定的代表性,并能更加准确地反映患者的上皮状况。
随后,对滤膜施加一定的负压,并通过滤膜将液体抽吸出来;这样,细胞便被收集在 TransCyt 过滤器的滤膜上。随着标本瓶内的物质不断被收集到至滤膜上,滤膜上的滤孔便会越发拥堵,从而使处理器停止抽吸。TransCyt 过滤器内的通过流速会得到实时监控,这可将标本的差异程度降至最低。
当处理器停止过滤时,将过滤器柱体从标本瓶中取出,并部分旋转,将过滤物排入废物瓶中。然后,将过滤器柱体翻转过来,与其上方的玻片相接触。这时,过滤器受到微弱的空气压力作用,将细胞从过滤器转移至玻片上。由于细胞本身具有粘着特性,并且 ThinPrep 玻片本身也存在电化学特性,这样与滤膜相比,细胞与玻片之间便会表现出更强的吸附力,从而令细胞转移至玻片上,并在一个直径为 20mm 的圆圈内形成细胞薄层。在完成细胞转移之后,玻片会与过滤器柱体分离,并自动弹入保存固定液内。随后,操作人员将玻片取出,并放入染色架 (T2000),等待进行后继的常规涂片染色和盖玻片操作。在使用 T3000 处理器时,玻片会附有一层保存固定液,并由该仪器固定;此后,玻片会被放入染色架,等待进行后继的常规涂片染色和盖玻片操作。
参考资料:
- Hutchinson ML, et al: Homogeneous sampling accounts for the increased diagnostic accuracy using the ThinPrep® Processor. Am J of Clin Pathol 1994; 101:215-219.
- ThinPrep® 2000 System Package Insert, Hologic, Inc., 2001.
- TP® 2000 Operator’s Manual, Rev G, Hologic, Inc., 2000.
- TP® 3000 Operator’s Manual, Rev C, Hologic, Inc., 2000-2001.
科学基础
David Zahniser, PhD
巴氏涂片所存在的假阴性问题是细胞检测实验室所面对的一个重大质量问题。女性宫颈疾病未被检出通常与采样错误或读片错误有关。采样错误是巴氏涂片假阴性的主要原因,涉及范围从 60 至 80% 不等;读片错误和诊断错误则是其余错误的原因。采样错误通常可归咎于临床医生在细胞成熟时未能正确地对病变组织进行采样。这时,会认为病变组织过小,或在子宫颈管内的部位过高。显然,采样错误是巴氏涂片敏感性受到限制的重要原因。ThinPrep®2000 系统的早期开发工作已帮助揭示出传统巴氏涂片过程中所存在的固有缺陷,以及其他已得到进一步确定的采样错误。如今,研究显示采样错误不一定仅取决于临床医生的操作,而更多地是与人工涂片技术的局限有关。
ThinPrep 技术的起源可追溯至早期;当时,各种研究工作正在展开,旨在开发出一种定量系统,并以此对巴氏涂片技术进行分析。二十世纪六十年代,数字计算机使得读片系统的建立成为可能。从一开始起,计算机成像系统就因为人工涂片的不一致性而受到限制。对于自动系统分析而言,传统的宫颈涂片技术显然过于复杂。为得到能够由计算机读取的涂片,许多涂片设备的研发工作纷纷展开。第一代自动涂片系统可得到单个细胞群,但不能得到适宜原始计算机进行分析的细胞团。为分散这些细胞层和细胞团,人们对各种机械方法进行了测试。在将宫颈刮取物采集至溶液中之后,便会对其进行严苛的机械操作。最为成功的涂片设备使用的是注射器式操作;即通过大容量注射针将细胞标本抽吸出来,并得到单个细胞群。这些设备为计算机提供了简化了的细胞群,并在此方面较为成功。不幸的是,虽然能够成功得到分散的单个细胞群,但与之相伴的却是细胞缺失和组织结构遭到破坏,并对人工诊断造成影响。这时,来自荷兰的工作发现使某些与注射器抽吸有关的问题迎刃而解。在进行分散步骤时,他们使用柱体,并使其在细胞悬液中高速旋转。其思路是当柱体在标本瓶中旋转时,会产生与注射器操作相似的剪切力。通过控制分散柱体的转速,便可对细胞的分散程度进行掌控。当前的 ThinPrep 处理器也采取了柱体分散技术;但为了保持自然细胞团的完整性,所采用的细胞分散转速较低。此外,采集方法也得到了改进,这使得标本的涂片方法有了进一步的优化。
在分散步骤得到发展的同时,过滤方法也处在研发之中。通过对非诊断性背景物质进行限制,标本质量有了进一步的提高。同时,人们也倍加小心,确保标本中原有的基本信息不会丢失。为从悬液中收集到细胞物质,并通过简单的过滤来限制此类人为假象,人们选择了塑料滤膜。在这些过滤器的生产流程当中,滤孔随机分布,并且尺寸一致。
这时,涂片设备还需要一个步骤:将悬液中的细胞转移到光镜玻片上。为使细胞至玻片的转移步骤得到优化,并同时适宜进行人工和计算机分析,人们对数种技术进行了研究。在使用滤膜时,通过将过滤器和细胞压在玻片上,可使细胞转移到玻片上;这样,可得到一层均匀的细胞薄层,并可使细胞得到均匀的分布,同时还能保持相似的细胞形态。
由于受到细胞学技师人力匮乏,以及巴氏涂片诉讼案件增加的推动,当人们对巴氏涂片自动化操作的兴趣重新被点燃时,这种兴趣便一发不可收拾。当时,市场上出现了许多商用计算机读片仪器。然而,虽然计算机技术已然进步,但对涂片稳定性的要求仍然不断。ThinPrep 技术致力于解决涂片的局限问题,并由此而获得了前进动力;同时,ThinPrep 也得到了来自非临床以及临床研究的支持,这些研究有助于对巴氏涂片法所存在的限制更好地加以理解。
参考资料:
- Linder J and Zahniser: ThinPrep Papanicolaou testing to reduce false-negative cervical
THINPREP® 玻片镜下评估
Deanna K. Iverson, MHS, SCT(ASCP), HTL
早在二十世纪二十年代初,George Papanicolaou 便制定出了传统的巴氏涂片形态标准。随着时间的推移,人们根据数项研究对其进行了修改,并妥善地进行了记录。对于传统的涂片方法以及 ThinPrep 涂片检测法,人们对基本形态标准所作的修改为数甚少。在使用 ThinPrep®系统时,光镜读片的特定差异往往与液基采集法有关。在由仪器进行处理的过程中,组织结构不应发生改变,并且可使用典型的细胞形态来进行诊断;注意到这些都是至关重要的。ThinPrep 与传统的巴氏涂片在形态方面存在相似性,但在涂片差异方面却远远胜出;并且还能够轻松延用传统形态学方面的经验。以下摘要涉及 ThinPrep 巴氏检测的主要形态特性以及异型性检测的最佳读片方式。
在使用传统的巴氏涂片时,应以缓慢、有系统的方式,并在完成盖玻片操作之后进行 ThinPrep 涂片检测 (TPPT) 玻片的读片工作。ThinPrep 玻片上细胞沉积物的圆形边缘可用作参考点。在使用低倍镜 (10x) 对玻片进行系统性评估之前,最好通过扫描 (4x) 物镜对玻片进行一次快速评估,并借此评估细胞的结构、分辨颈管细胞,并评估涂片的技术质量。
经验丰富的细胞学技师和病理学家能够迅速分辨出 ThinPrep 涂片检测玻片上不同类型的细胞。但是,细胞学家仍会遇到就生物角度而言较为棘手的案例,并需要仔细进行检查。这时,仍可对细胞结构(正常和异常细胞群)进行定量评估,该评估与传统方法较为相似。然而,在使用 ThinPrep 涂片检测玻片时,异常细胞最终存在与否与其数量相比要更为重要一些。
ThinPrep 涂片检测玻片具有一些独特的特性,包括细胞涂片均匀、液基固定、涂片痕迹和标本背景。
细胞涂片均匀
- 集中
- 分布均匀
- 直径为 20mm 的圆形区域
由于细胞物质被采集至溶液中,并在随后经过过滤,因此 ThinPrep 涂片检查玻片的标本外貌看起来与传统巴氏涂片有所区别。对于传统的巴氏涂片而言,其细胞层厚薄不均、具有干涸的细胞,并且细胞物质通常已发生了机械性扭曲;而 ThinPrep 涂片检测玻片上的细胞物质则较为集中,并且均匀地分布在直径为 20mm 的圆形区域内。这时,仍可以观察到上皮细胞层,但细胞重叠的情况较少。
液基固定:
- 细胞在溶液中呈团状
- 细胞浆的细节得到提高
- 甲醇液基采集法
- 细胞核的细节得到提高
- 染性发生变化
液基固定:ThinPrep 涂片检测玻片的独特特性便是细胞物质的收集和存放工作都是在液基保存固定液内完成的。ThinPrep 涂片检测玻片上的细胞形态与非妇科标本较为相似;其中,细胞在溶液中易呈团状,但在 ThinPrep 涂片检测玻片上仍然能够容易地对各种类型的细胞进行分辨。颈管细胞可呈现出多个三维形状,并且可能会与子宫内膜细胞发生混淆。在采用高倍镜进行检查时,可在细胞团的边缘看到呈栅栏结构的颈管细胞。
ThinPrep 涂片检测法所采用的液基保存固定液中含有甲醇,这可使细胞的保存和细胞核形态的保持得到了提高。由于细胞浆的细节得到提高,这样便能更好地对原位细胞和细胞的分化程度加以确定。同时,由于采用了液基固定法,细胞核形态的保持也因此得到了提高。但由于细胞核存在过度诊断的可能,因此在评估 ThinPrep 涂片检测玻片时应保持谨慎,避免对保存良好的细胞核进行过度诊断。如果传统的巴氏涂片上混有 95% 的乙醇,则在 ThinPrep 玻片上观察到的核增强现象会与在该涂片上看到的情况较为相似。
在传统的巴氏涂片上,核深染情况通常与鳞状病变有关;而在 ThinPrep 涂片检测玻片上,这种情况可能会有所减少。出于这种原因,对于 ThinPrep 涂片检测玻片而言,染色质深染可能并不能作为一种可靠的依据。如果出现染色质深染,则应对其加以考虑;但如果没有出现染色质深染,则不能将其作为排除细胞核异型的依据。在未出现染色质深染的情况下,由于必须依赖细胞核的大小和形状上的变化,因此要对 ThinPrep 涂片检测玻片内的高度病变作出准确的诊断,便会极富挑战;而在传统的巴氏涂片中, 细胞的形状标准往往会被忽略。
细胞大小:
- 比例上较细小
- 单个细胞较明显
细胞大小:由于采用了液基固定法,ThinPrep 涂片检测玻片内的细胞可能在比例上会显得较为细小。在确定细胞大小和细胞核的大小时,保存良好的中层细胞不失为一种有用的参照物。在评估和诊断未成熟的组织转化型细胞时,这是尤为重要的。因此,应务必在高倍镜下对这些细胞进行检查,并仔细对细胞核进行评估,看其是否存在核异型的情况(在没有出现染色质深染的情况下尤其如此)。
单个细胞经过分散,会作为“随机次级标本”的一部分出现,这也是 ThinPrep 系统的特点。由于血液和炎症物质不会覆盖住这些细胞,因此与传统的巴氏涂片相比,涂片内的单个细胞会显得更多一些。
涂片的痕迹:
- 消失的“涂片”痕迹
- 发生改变的背景痕迹
涂片的痕迹:与在保存良好的传统巴氏涂片上观察到的情况相比,ThinPrep 涂片检测玻片上的细胞结构和构成背景通常会与之较为相似。ThinPrep 涂片检测玻片上的细胞物质较为一致,并且分布均匀。这样,细胞的组织结构(细胞层与合胞体)得以保留,并且机械性扭曲也大为减少。
背景:与传统的巴氏涂片不同,ThinPrep 涂片检测玻片内的背景通常较为干净。因此,通常能够比较容易地分辨出正常和异常的细胞群。虽然 ThinPrep 玻片上会出现血液、粘液、炎症物质和癌性背景,但由于采集和涂片方法上的差异,这些物质的外貌与在传统巴氏涂片上观察到的情况会略有不同。 如果在涂片过程中从患者身上采集到血液和炎症物质并不太多,则这些物质很少会对 ThinPrep 涂片检测玻片造成干扰。在液体介质中,新鲜血液会被溶血剂溶解掉,从而将红细胞变为无色(“影”细胞)。虽然陈积的血液不会被完全溶解掉,但所呈现出的红色染色也会有所不同。在考虑细胞的恶性程度时,能够将新鲜血液同陈积血液区分开来是非常有用的。
在 ThinPrep 涂片检测玻片上,炎症物质的分散会更加均匀,并且通常会看到这些物质同上皮细胞附着在一起。有时,玻片背景可能会较为“肮脏”。这时,玻片上的物质显得脏污破烂,并且几乎没有保存良好的鳞状上皮细胞。如果观察到这种背景,则对以下因素加以考虑便显得至关重要:是否存在传染病、细胞溶解,以及/或恶性疾病(癌性背景)。如果存在,则在 ThinPrep 涂片检测玻片上便可观察到癌性背景(炎症细胞、红细胞、血纤蛋白、坏死的细胞碎片以及腺体蛋白物质),并遍布整个玻片背景,且位于上皮细胞的周围或与之发生重叠(“粘着”的癌性背景)。